
1
Fifth stage
Medicine
Lec-6
د . منوع
1/1/2014
antibiotics
The term antibiotics (antimicrobial, anti-infective): encompass a wide variety of
pharmaceutical agents that include antibacterial, antifungal, antiviral, and antiparasitic
drugs. Of these, antibacterial agents are by far the most commonly used. These agents kill
microorganisms by inhibiting, damaging or destroying a target that is a required component
of the organism.
BACTERIOCIDAL DRUGS
which cause death and disruption of the bacterial cell, include drugs that primarily act on
the cell wall (eg, β-lactams), cell membrane (eg, daptomycin), or bacterial DNA (eg,
fluoroquinolones).
BACTERIOSTATIC AGENTS
inhibit bacterial replication without killing the organism. Most bacteriostatic drugs,
including sulfonamides, tetracyclines, and macrolides, act by inhibiting protein synthesis.
The distinction is not absolute, and some agents that are bactericidal against certain
organisms may only be bacteriostatic against others and vice versa. In most cases, this
distinction is not significant in vivo; however, bactericidal agents are preferred in the case
of serious infections such as endocarditis and meningitis to achieve rapid cure.
MECHANISMS OF ANTIBIOTIC ACTIONS
1. Inhibition of cell wall synthesis: Penicillin, cephalosporin, vancomycine, etc.
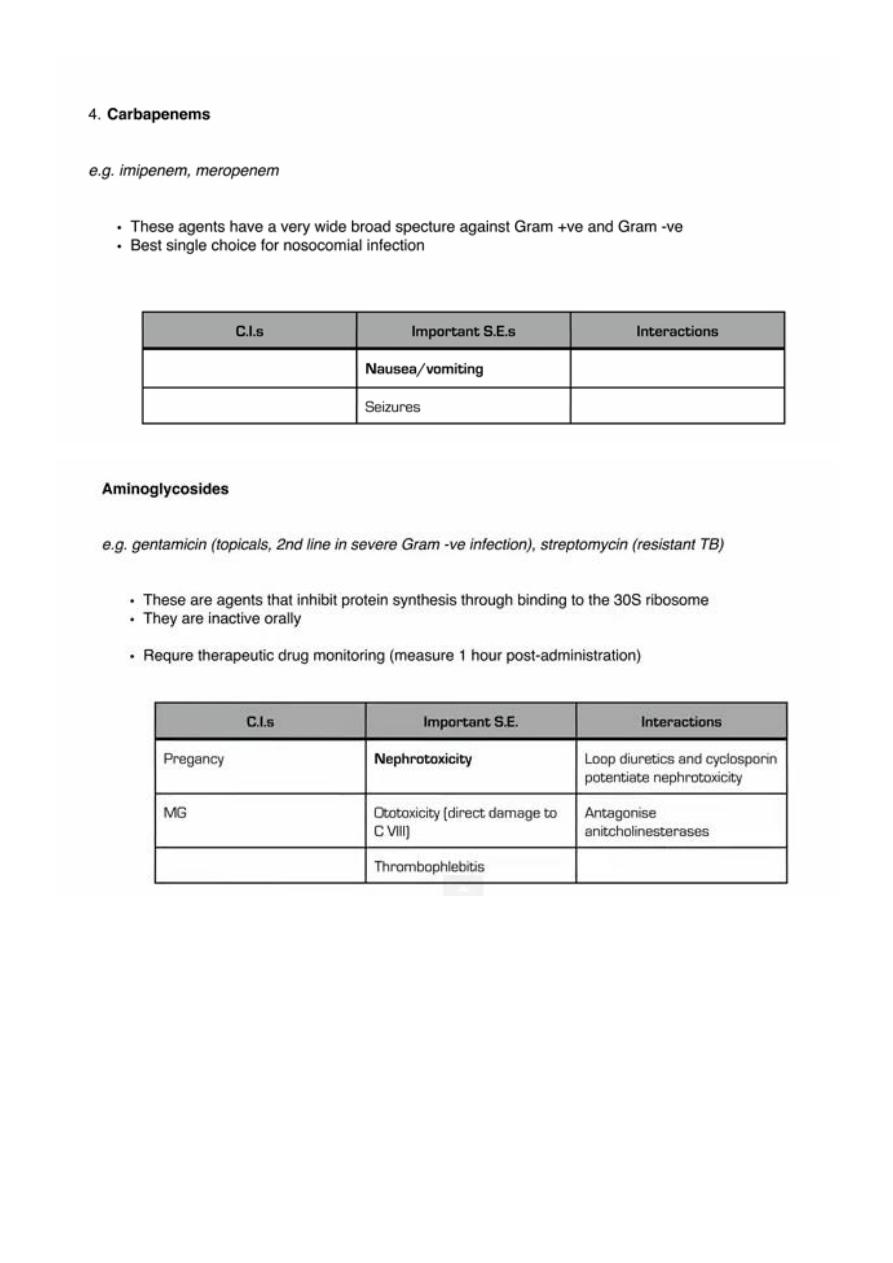
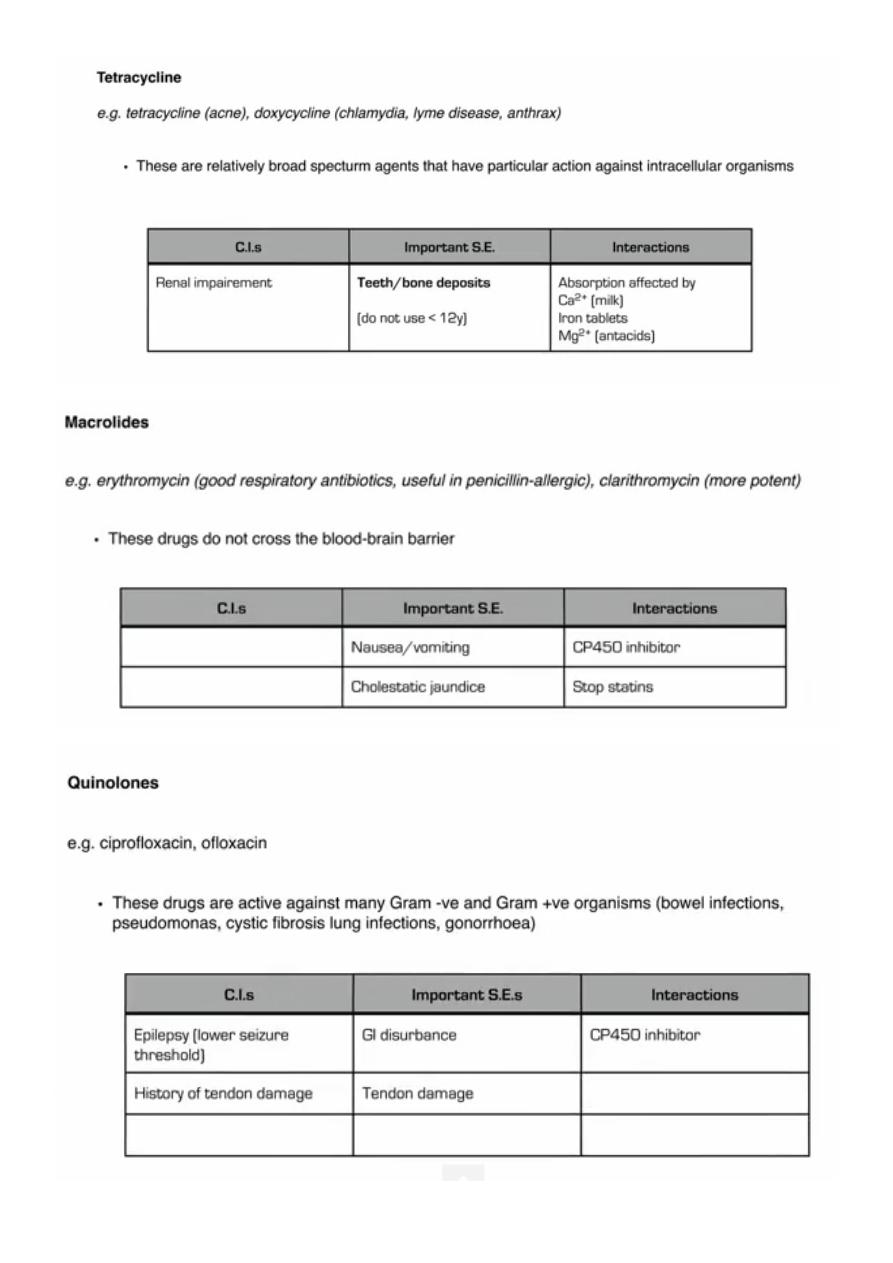
2. Inhibition of protein synthesis: Aminoglycosides, macrolides, tetracyclines.
3. Inhibition of nucleic acid synthesis: quinolones, anti-viral agents, Nitroimidazoles,
Rifamycins, etc.
4. Inhibition of folic acid synthesis: Sulfonamide, trimethoprim.
5. Disruption of cell membrane: like antifungal agents, daptomycin (newer agent for
gram-positive cocci).
EMPIRIC ANTIMICROBIAL THERAPY
Because microbiological results do not become available for 24 to 72 hours, initial therapy
for infection is often empiric and guided by the clinical presentation. It has been shown that
inadequate therapy for infections in critically ill, hospitalized patients is associated with
poor outcomes, including greater morbidity and mortality as well as increased length of
stay. Therefore, a common approach is to use broad-spectrum antimicrobial agents as
initial empiric therapy (sometimes with a combination of antimicrobial agents) with the

2
intent to cover multiple possible pathogens commonly associated with the specific clinical
syndrome.
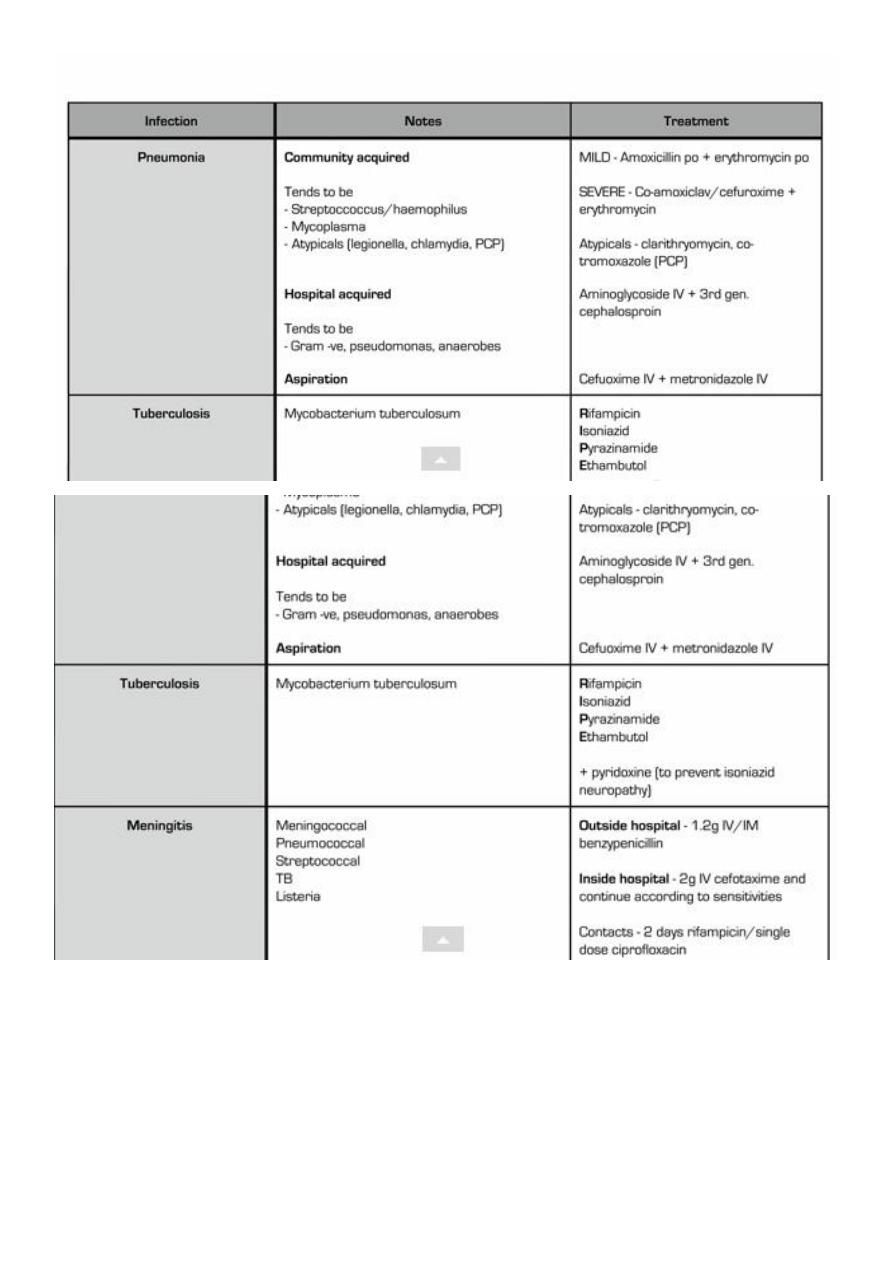
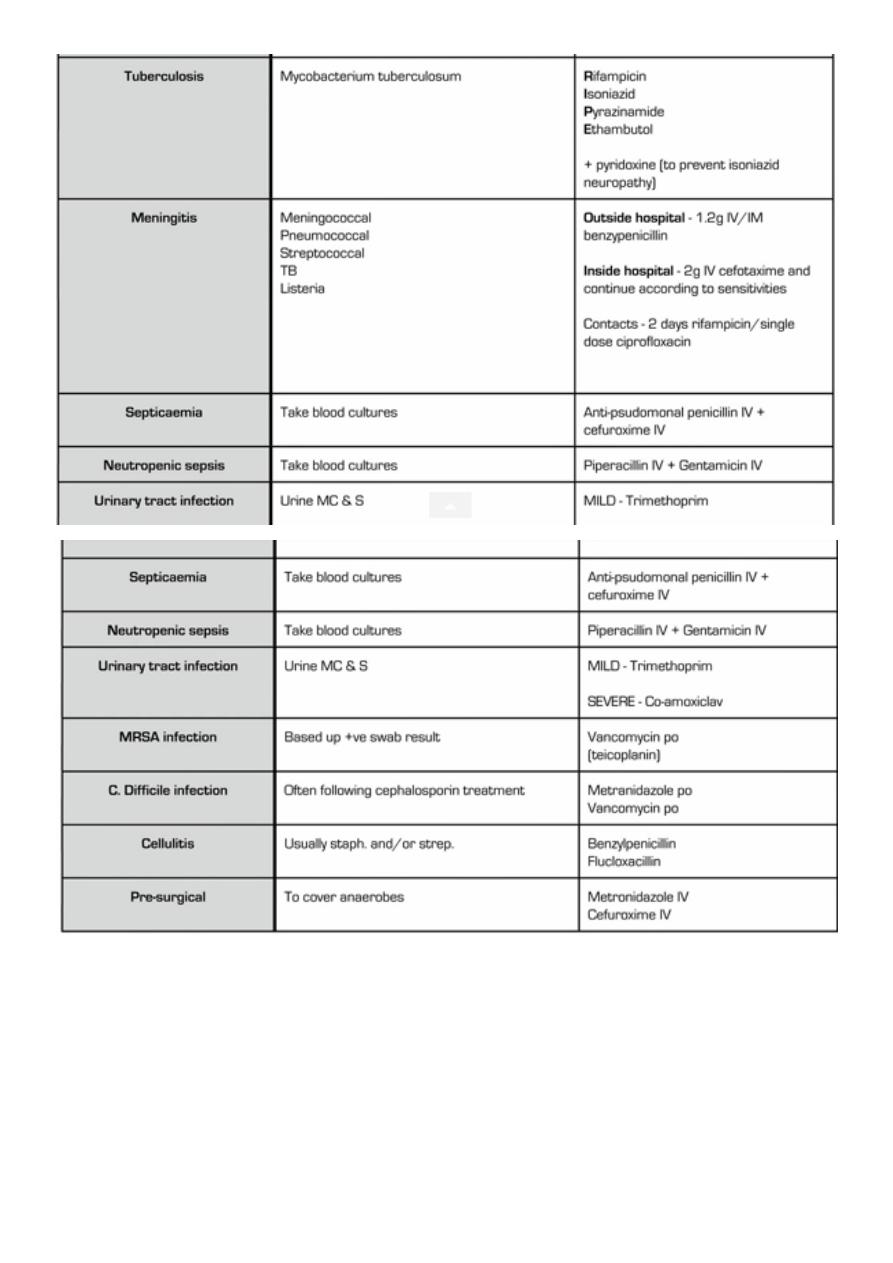
e. g. in community acquired suspected bacterial meningitis the most likely pathogens would
be Streptococcus pneumoniae and Neisseria meningitidis, and thus a combination of a
third-generation cephalosporin (ceftriaxone) plus vancomycin would be recommended as
empiric therapy.
Hospital-acquired infections are frequently related to the presence of invasive devices and
procedures that result in loss of the normal barriers to infection, as is the case with
intravascular catheter–associated bacteremia, ventilator-associated pneumonia, and
catheter-associated urinary tract infections (UTIs). They are commonly caused by drug-
resistant organisms, both gram-positive (eg, methicillin-resistant Staphylococcus aureus
[MRSA] and gram-negative (eg, Pseudomonas aeruginosa) bacteria, which are often
endemic in hospitals.
Optimum empiric therapy depends on the site of infection, patient characteristics and local
antimicrobial resistance patterns.
Hospital antibiotic policies are used to guide rational antimicrobial prescribing, maximising
efficacy while minimising antimicrobial resistance and cost.
Targeted therapy.
is aimed at the causal pathogen(s) of known antimicrobial sensitivity. Once microbiology
results have helped to identify the etiologic pathogen and/or antimicrobial susceptibility
data are available, every attempt should be made to narrow the antibiotic spectrum. This is
a critically important component of antibiotic therapy because it can reduce cost and
toxicity and prevent the emergence of antimicrobial resistance in the community.
Antimicrobial agents with a narrower spectrum should be directed at the most likely
pathogens for infections such as community-acquired pneumonia or cellulitis in the
ambulatory setting because specific microbiological tests are not typically performed.
Combination therapy
It is sometimes appropriate to use antimicrobial agents in combination:
• to increase efficacy (e.g. enterococcal endocarditis, where a β-lactam/aminoglycoside
combination results in better outcomes than a β-lactam alone)
• when no single agent’s spectrum covers all potential pathogens (e.g. in polymicrobial
infection or empiric treatment of sepsis)
• to reduce antimicrobial resistance, as the organism would need to develop resistance to
multiple agents simultaneously (e.g. anti-tuberculous chemotherapy, antiretroviral therapy.

3
Antimicrobial resistance
The development of resistance is inevitable following the introduction of a new antibiotic.
Initial rates of resistance to new drugs are normally on the order of 1%. However, modern
uses of antibiotics have caused a huge increase in the number of resistant bacteria. In fact,
within 8-12 years after wide-spread use, strains resistant to multiple drugs become
widespread. Multiple drug resistant strains of some bacteria have reached the proportion
that virtually no antibiotics are available for treatment.
The three fundamental mechanisms of antimicrobial resistance are:
(1) enzymatic degradation of antibacterial drugs,
(2) alteration of bacterial proteins that are antimicrobial targets, and
(3) changes in membrane permeability to antibiotics.
Antibiotic resistance can be either plasmid mediated or maintained on the bacterial
chromosome. The most important mechanism of resistance to the penicillins and
cephalosporins is antibiotic hydrolysis mediated by the bacterial enzyme beta-lactamase.
The expression of chromosomal beta-lactamase can either be induced or stably depressed
by exposure to beta-lactam drugs. Methods to overcome resistance to beta-lactam
antibiotics include the development of new antibiotics that are stable to beta-lactamase
attack and the co-administration of beta-lactamase inhibitors with beta-lactam drugs.
Resistance to methicillin, which is stable to gram-positive beta-lactamase, occurs through
the alteration of an antibiotic target protein, penicillin-binding protein 2.
Production of antibiotic-modifying enzymes and synthesis of antibiotic-insensitive bacterial
targets are the primary resistance mechanisms for the other classes of antibiotics, including
trimethoprim, the sulfonamides, the aminoglycosides, chloramphenicol, and the quinolone
drugs. Reduced antibiotic penetration is also a resistance mechanism for several classes of
antibiotics, including the beta-lactam drugs, the aminoglycosides, chloramphenicol, and the
quinolones
The term post-antibiotic era has been coined to describe a future in which the acquisition
of resistance by bacteria will have been so extensive that antibiotic therapy is rendered
useless. A more realistic scenario, which is currently being experienced, is a gradual but
inexorable progression of resistance, necessitating the use of ever more toxic and
expensive antimicrobials.
Factors promoting antimicrobial resistance include
1. The inappropriate use of antibiotics (e.g. in viral infections)
2. Inadequate dosage or treatment duration.
3. Use of antimicrobials as growth-promoters in agriculture.

4
Combination antimicrobial therapy may reduce the emergence of resistance. This is
recommended in treatment of patients infected with HIV, which is highly prone to
spontaneous mutation. Despite use of combination therapy for M. tuberculosis, multidrug-
resistant tuberculosis (MDR-TB, resistant to isoniazid and rifampicin) and extremely drug-
resistant tuberculosis (XDR-TB, resistant to isoniazid and rifampicin, any fluoroquinolone
and at least one injectable antimicrobial antituberculous agent) have been reported
worldwide and are increasing in incidence.
Duration of therapy:
Treatment duration reflects the severity of infection and accessibility of the infected site to
antimicrobial agents. For most infections, there is limited evidence available to support a
specific duration of treatment . Depending on the indication, initial intravenous therapy
may be switched to oral after fever has settled for approximately 48 hours. In the absence
of specific guidance, antimicrobial therapy should be stopped when there is no longer any
clinical evidence of infection.
Duration of therapy:
Viral infections
Herpes simplex encephalitis 2–3 wks
Bacterial infections
Gonorrhoea Single dose
Infective endocarditis
(streptococcal, native valve 4 wks)
gentamicin for first 2 wks
Infective endocarditis
(prosthetic valve)
≥ 6 wks
Osteomyelitis 4–6 wks
Pneumonia (community acquired,
severe) 10 days (no organism identified), 14–21 days (Staph. aureus or Legionella spp.)
Septic arthritis 2–4 wks
Urinary tract infection (male) 2 wks
Urinary tract infection, upper (female) 7 days
Urinary tract infection, lower (female) 3 days

5
Mycobacterial infections
Tuberculosis (meningeal) 12 mths
Tuberculosis (pulmonary) 6 mths
Fungal infections
Invasive pulmonary aspergillosis
Until clinical/radiological resolution and reversal of predisposition.
Candidaemia (acute disseminated) 2 wks after last positive blood culture and resolution of
signs and symptoms
Antimicrobial prophylaxis
Primary prophylaxis is used when there is a risk of infection from a procedure or exposure It
should be of short duration with minimal adverse effects, and may be combined with
passive immunization.
Secondary prophylaxis is used in patients who have been treated successfully for an
infection but remain predisposed to it. It is used in haemato-oncology patients in the
context of fungal infection and in HIV positive individuals with an opportunistic infection
who do not respond to antiretroviral therapy
ANTIMICROBAL SUSCEPTIABILITY TESTING (AST)
When a pathogenic microorganism is identified in clinical cultures, the next step performed
in most microbiology laboratories is antimicrobial susceptibility testing (AST). Antimicrobial
susceptibility testing measures the ability of a specific organism to grow in the presence of
a particular drug in vitro.
The goal of AST is to predict the clinical success or failure of the antibiotic being tested
against a particular organism.
Data are reported in the form of minimum inhibitory concentration (MIC): the lowest
concentration of an antibiotic that inhibits visible growth of a microorganism, and are
interpreted by the laboratory as “susceptible,” “resistant,” or “intermediate
For many agents, antimicrobial effect can be categorized as concentration-dependent or
time-dependent. The efficacy of antimicrobial agents whose killing is concentration
dependent (e.g. aminoglycosides) increases with the amount . For this reason, it has
become customary to administer aminoglycosides (e.g. gentamicin) infrequently at high
doses (e.g. 7 mg/kg) rather than frequently at low doses. This has the added advantage of
minimising toxicity by reducing the likelihood of drug accumulation. Conversely, the β-
lactam antibiotics, macrolides and clindamycin exhibit time dependent killing, and their
efficacy depends on Cmax exceeding the MIC for a certain time (which is different for each
class of agent). This is reflected in the dosing interval of benzylpenicillin, which is usually

6
given every 4 hours in severe infection (e.g. meningococcal meningitis), and may be
administered by continuous infusion. For other antimicrobial agents, the
pharmacodynamics relationships are more complex and often less well
Therapeutic drug monitoring
Therapeutic drug monitoring is used to confirm that levels of antimicrobial agents with a
low therapeutic index (e.g. aminoglycosides) are not excessive, and that levels of agents
with marked pharmacokinetic variability (e.g. vancomycin) are adequate. Specific
recommendations for monitoring depend on individual clinical circumstances; for instance,
different pre- and post-dose levels of gentamicin are recommended, depending on whether
it is being used in traditional divided doses, once daily or for synergy in endocarditis
Antimicrobial agents in pregnancy
Contraindicated
• Chloramphenicol: neonatal ‘grey baby’ syndrome – collapse,
hypotension and cyanosis
• Fluconazole: teratogenic in high doses
• Quinolones: arthropathy in animal studies
• Sulphonamides: neonatal haemolysis and methaemoglobinaemia
• Tetracyclines, glycylcyclines: skeletal abnormalities in
animals in 1st trimester; fetal dental discoloration and maternal hepatotoxicity with large
parenteral doses in 2nd or 3rd trimesters
• Trimethoprim: teratogenic in 1st trimester
Relatively contraindicated
• Aminoglycosides: potential damage to fetal auditory and vestibular nerves in 2nd and
3rd trimesters
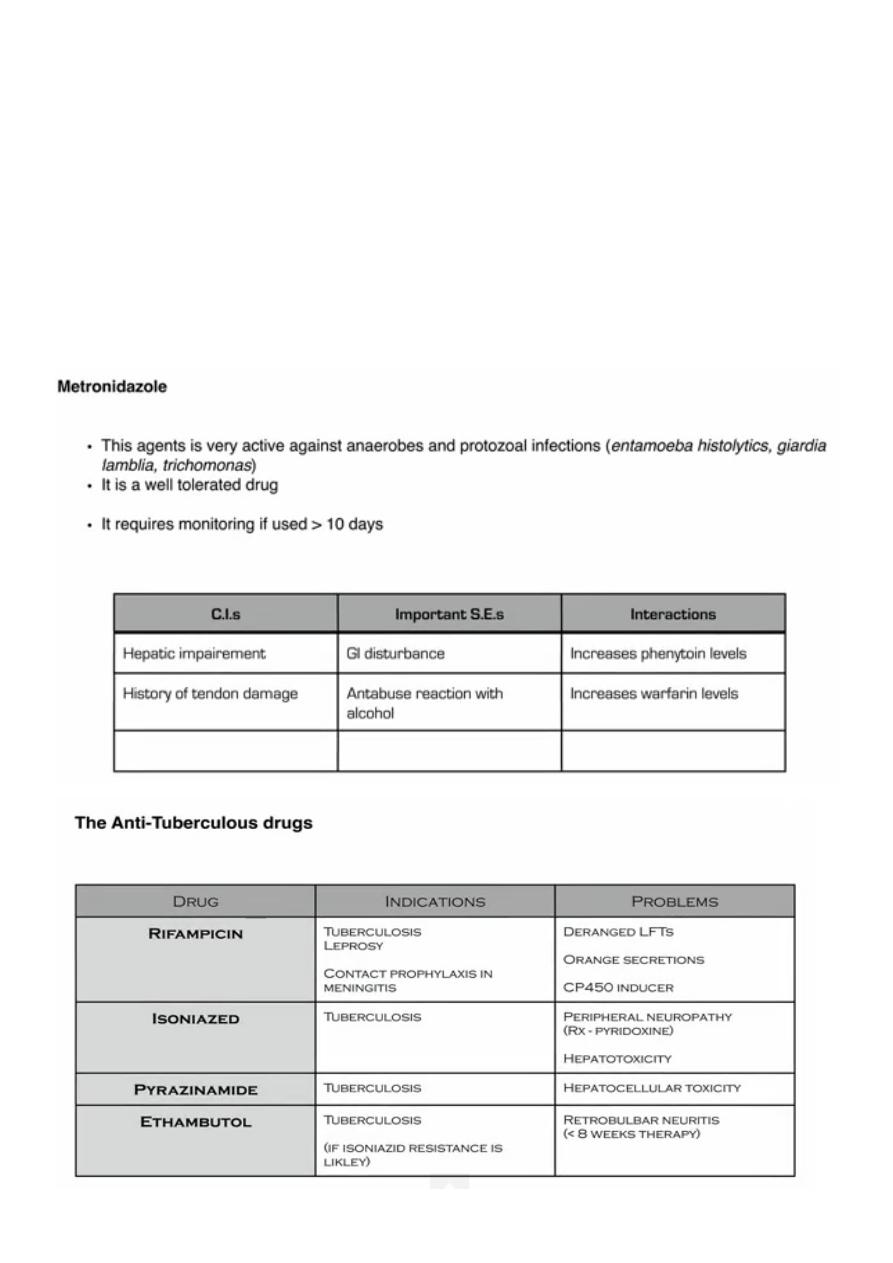
• Metronidazole: avoidance of high dosages is recommended.
Not known to be harmful; use only when necessary
• Aciclovir
• Cephalosporins
• Clarithromycin
• Clindamycin

7
• Erythromycin
• Glycopeptides
• Linezolid
• Meropenem
• Penicillins
Problems with antimicrobial therapy in old age
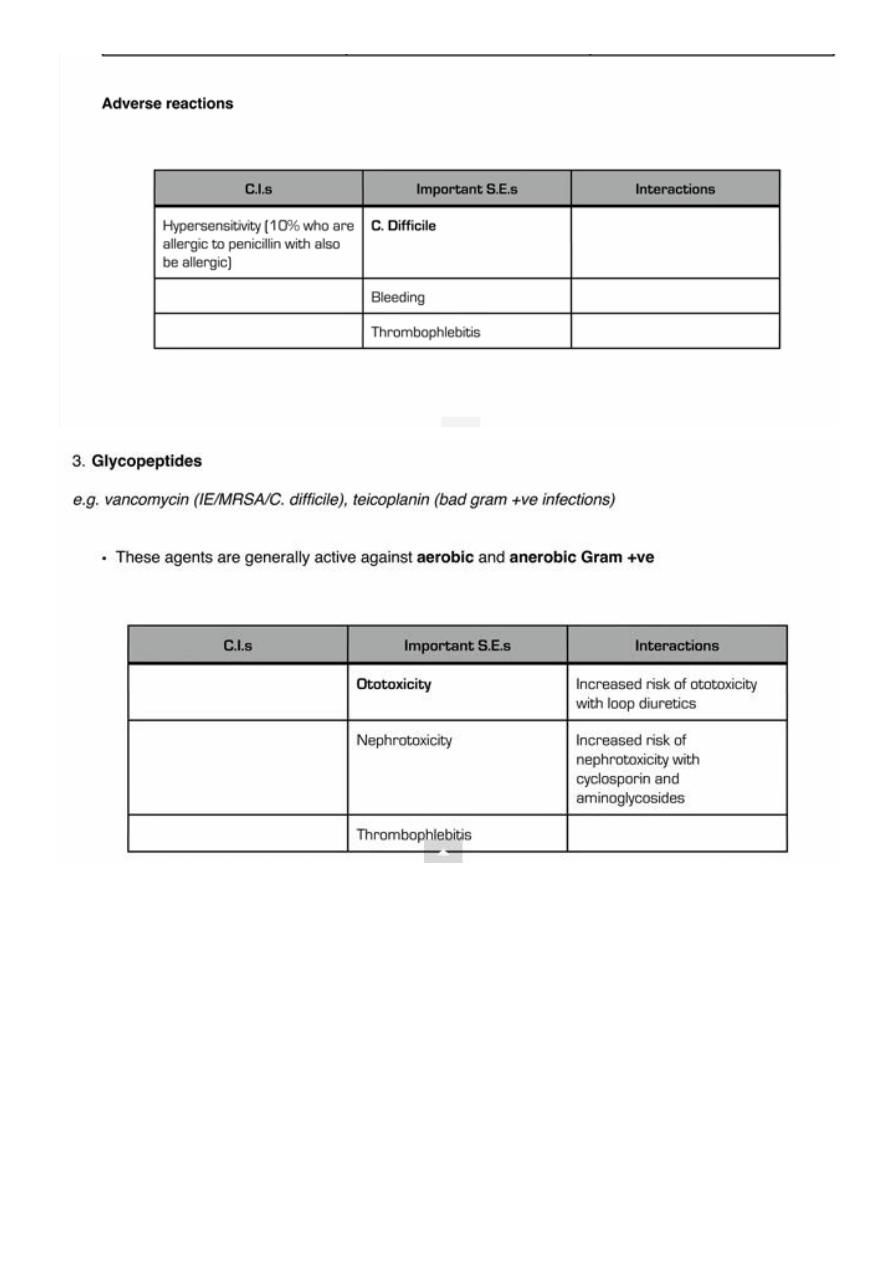
Clostridium difficile infection: all antibiotics predispose to some extent, but second- and
third-generation cephalosporins and co-amoxiclav especially so.
• Hypersensitivity reactions: rise in incidence due to increased previous exposure.
• Renal impairment: may be significant in old age, despite ‘normal’ creatinine levels.
Nephrotoxicity: more likely, e.g. first-generation cephalosporins, aminoglycosides.
• Accumulation of β-lactam antibiotics: may result in myoclonus, seizures or coma.
• Reduced gastric acid production: gastric pH is higher, which causes increased penicillin
absorption.
• Reduced hepatic metabolism: results in a higher risk of isoniazid-related hepatotoxicity.
• Quinolones: associated with confusion and may increase the risk of seizures.
8
9
11
11
12
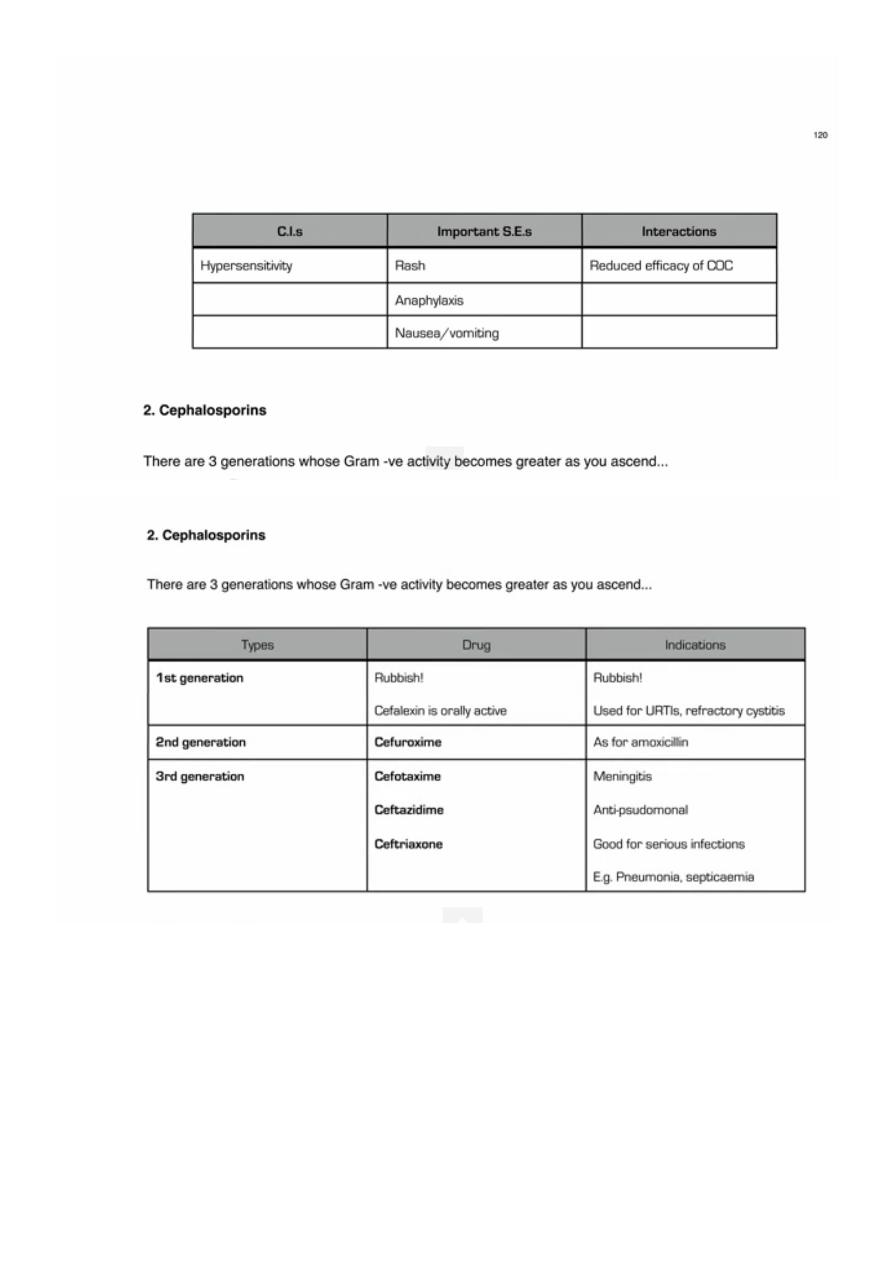
QUINOLONES
1. Naladixic acid: limited to UGT. No systemic effects.
2. Ciprofloxacin, Norfloxacin (no systemic effect), Ofloxacin. More gram-negative. For
acute diarrheal illness. Some gram positive but no pneumococcal. Atypical mycoplasma,
Clamedia, not efficiently stained by GS as no cell wall and these bacteria are
intracellular.
3. 3
rd
generation: Levofloxacin for respiratory tract infection including pneumococci and
legionella. More gram positive.
4. 4
th
generation: Moxifloxacine: Pseudomonas in infants with cystic fibrosis.
13
14
