

Maturation of Red Blood Cells—Requirement for
Vitamin B12 (Cyanocobalamin) and Folic Acid
The erythropoietic cells of the bone marrow are among
the most
rapidly
growing and reproducing cells in the
entire body. Two vitamins, vitamin
B12
and
folic
acid are
important for final maturation of the red blood cells,
Both of these are essential for the synthesis of
DNA
,
Therefore, lack of either vitamin B12 or folic acid causes
abnormal and
diminished
DNA
and, consequently,
failure
of
nuclear
maturation and cell division.
Furthermore, the erythroblastic cells of the bone
marrow, in addition to failing to
proliferate
rapidly,
produce mainly larger than normal red cells called
macrocytes
, and the cell itself is often irregular, large,
and oval instead of the usual biconcave disc.
These poorly formed cells, after entering the circulating
blood, are capable of
carrying
oxygen
normally
, but their
fragility causes them to have a short life, one half to one
third normal. Therefore, it is said that deficiency of
either vitamin B12 or folic acid causes
maturation
failure
in the process of erythropoiesis.

Absorption of Vitamin B12 from the Gastrointestinal
Maturation Failure Caused by Pernicious Anemia.
The basic abnormality is an
atrophic
gastric
mucosa that
fails to produce normal gastric secretions. The
parietal
cells
of the gastric glands secrete a glycoprotein called
intrinsic
factor
, which combines with vitamin B12 in food
and makes the B12 available for absorption by the gut. It
does this in the following way:
(1) Intrinsic factor binds tightly with the vitamin B12. In
this bound state, the B12 is
protected
from digestion by
the gastrointestinal secretions.
(2) Still in the bound state, intrinsic factor
binds
to
specific receptor sites on the brush border membranes of
the mucosal cells in the ileum.
(3) Then, vitamin B12 is
transported
into the blood
during the next few hours by the process of
pinocytosis
,
carrying intrinsic factor and the vitamin together
through the membrane.
Lack
of
intrinsic
factor
, therefore, causes diminished
availability of vitamin B12 because of faulty absorption
of the vitamin.
Once
vitamin
B12
has been absorbed from the
gastrointestinal tract, it is first
stored
in large quantities
in the liver, then released slowly as needed by the bone
marrow. The
minimum
amount
of vitamin B12 required
each day to maintain normal red cell maturation is only
1 to 3 micrograms, and the normal
storage
in the liver
and other body tissues is about 1000 times this amount.
Therefore, 3 to 4 years of defective B12 absorption are
usually required to cause maturation failure anemia.

Failure of Maturation Caused by Deficiency of Folic
Acid(Pteroylglutamic Acid).
Folic acid is a normal constituent of green
vegetables
,
some
fruits
, and
meats
(especially liver). However, it is
easily destroyed during
cooking
.
Also,
people
with
gastrointestinal
absorption
abnormalities
, such as the frequently occurring small
intestinal disease called
sprue
, often have serious
difficulty absorbing both folic acid and vitamin B12.
Therefore, in many instances of maturation failure, the
cause is deficiency of intestinal absorption of both folic
acid and vitamin B12.
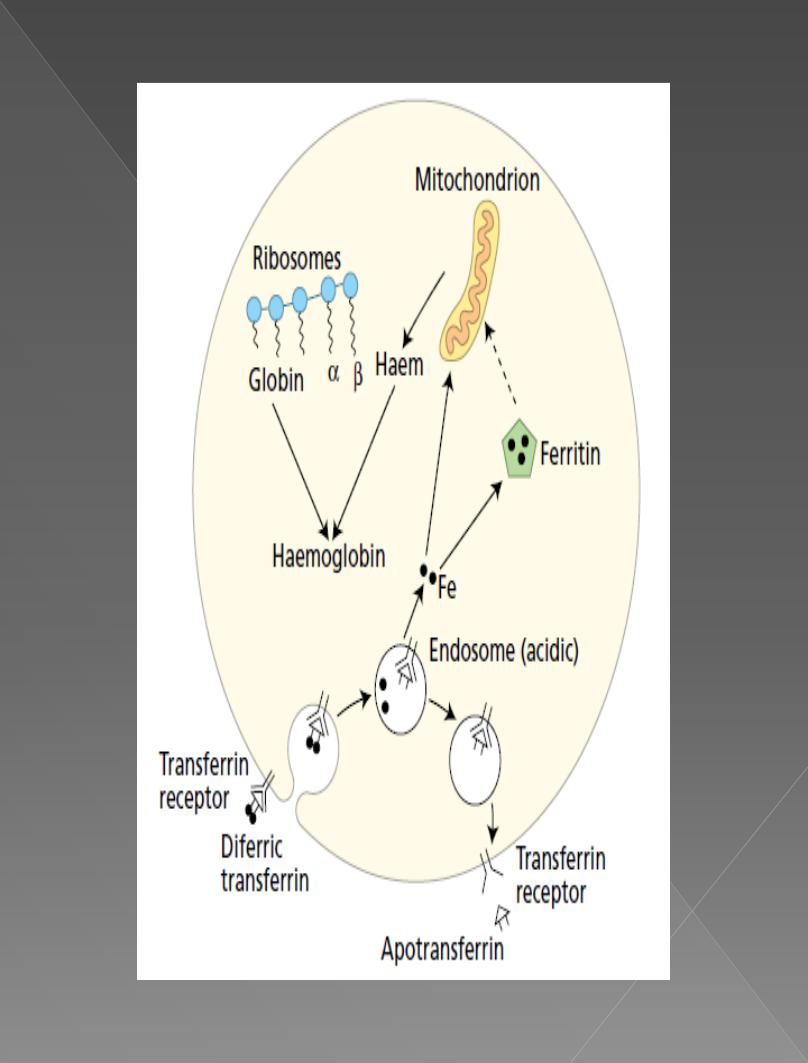
Formation of Hemoglobin
Synthesis of hemoglobin
begins
in the proerythroblasts
and continues even into the reticulocyte stage of the red
blood cells. Therefore, when reticulocytes leave the bone
marrow and pass into the blood stream, they
continue
to
form minute quantities of hemoglobin for another day or
so until they become mature erythrocytes.
succinyl-CoA
, formed in the Krebs metabolic cycle, binds
with
glycine
to form a
pyrrole
molecule. In turn, four
pyrroles combine to form
protoporphyrin
IX, which then
combines with iron to form the
heme
molecule. Finally,
each heme molecule combines with a long polypeptide
chain, a
globin
synthesized by ribosomes, forming a
subunit of hemoglobin called a hemoglobin chain. four of
these in turn bind together loosely to form the whole
hemoglobin molecule.

There are several slight variations in the different subunit hemoglobin
chains
, depending on the amino acid composition of the polypeptide
portion. The different types of chains are designated
alpha
chains
,
beta
chains, gamma chains, and delta chains
.
The most common form of
hemoglobin in the adult human being,
hemoglobin
A,
is a combination
of two alpha chains and two beta chains.
because there are
four
hemoglobin chains in each hemoglobin molecule,
one finds
four iron atoms
in each hemoglobin molecule (one per each
heme molecule); each of these can bind loosely with
one molecule of
oxygen
(
O
2
),
making a total of
four
molecules
of oxygen (or eight
oxygen atoms) that can be transported by each hemoglobin molecule.
The types of hemoglobin chains in the hemoglobin molecule determine
the
binding affinity
of the hemoglobin for oxygen.
Abnormalities
of the
chains can
alter the physical
characteristics of the hemoglobin molecule
as well.
For instance, in
sickle
cell anemia, the amino acid
valine
is substituted
for
glutamic
acid at one point in each of the two beta chains. When this
type of hemoglobin is
exposed to low oxygen
, it forms elongated
crystals inside the red blood cells that are sometimes
15
micrometers in
length. These make it almost impossible for the cells to pass through
many small capillaries, and the spiked ends of the crystals are likely to
rupture the cell membranes, leading to sickle cell anemia.

Combination of Hemoglobin with Oxygen.
The most important feature of the hemoglobin molecule
is its ability to combine loosely and
reversibly
with
oxygen.
oxygen does not become ionic oxygen but is carried as
molecular oxygen (composed of two oxygen atoms) to the
tissues, where, because of the loose, readily reversible
combination, it
is released into the tissue fluids still in the
form of molecular oxygen rather than ionic oxygen.
Iron Metabolism
iron is important for the formation not only of
hemoglobin but also of other essential elements in the
body (e.g.,
myoglobin, cytochromes, cytochrome oxidase,
peroxidase, catalase).
The total quantity of iron in the body averages
4 to 5
grams
, about
65
per cent of which is in the form of
hemoglobin. About
4
per cent is in the form of myoglobin
while
15 to 30
per cent is stored for later use, mainly in
the reticuloendothelial system and liver parenchymal
cells, principally in the form of ferritin.

Transport and Storage of Iron.
iron is
absorbed
from the small intestine, it immediately
combines in the blood plasma with a beta globulin,
apotransferrin
, to form
transferrin
, which is then
transported in the plasma. The iron is
loosely
bound
in
the transferrin and, consequently, can be released to any
tissue cell at any point in the body.
Excess
iron
in the blood is
deposited
especially in the
liver
hepatocytes and less in the
reticuloendothelial
cells
of the bone marrow. In the cell cytoplasm, iron combines
mainly with a protein,
apoferritin
, to form
ferritin
, which
is storage iron.
Smaller quantities of the iron in the storage pool are in
an extremely insoluble form called
hemosiderin
.
A unique characteristic of the transferrin molecule is
that it
binds
strongly with
receptors
in the cell
membranes of erythroblasts in the bone marrow. Then,
along with its bound iron, it is ingested into the
erythroblasts by
endocytosis
. There the transferrin
delivers the iron directly to the mitochondria, where
heme is synthesized.
When red blood cells have
lived
their life span and are
destroyed, the hemoglobin released from the cells is
ingested
by
monocyte-macrophage
cells. There, iron is
liberated and is stored mainly in the ferritin pool to be
used as needed for the formation of new hemoglobin.

Daily Loss of Iron.
A
man
excretes about
0.6
milligram of iron each day,
mainly into the feces. Additional quantities of iron are
lost when bleeding occurs. For a
woman
, additional
menstrual loss of blood brings long term iron loss to an
average of about
1.3
mg/day.
Absorption of Iron from the Intestinal Tract
Iron is absorbed from
all
parts of the small intestine;
mostly by the following mechanism:- The
liver
secretes
moderate amounts of
apotransferrin
into the bile, which
flows through the bile duct into the duodenum.
Here, the apotransferrin
binds
with free
iron
and also
with certain iron compounds, such as
hemoglobin
and
myoglobin
from meat, two of the most important sources
of iron in the diet. This combination is called transferrin.
It, in turn, is attracted to and binds with receptors in the
membranes of the intestinal epithelial cells. Then, by
pinocytosis
, the transferrin molecule, carrying its iron
store, is
absorbed
into the epithelial cells and
later
released
into
the blood capillaries beneath these cells in
the form of plasma transferrin.
even when tremendous quantities of iron are present in
the food, only small proportions can be absorbed.

Regulation of Total Body Iron by Controlling Rate
of Absorption.
When the body has become
saturated
with iron so that
essentially all apoferritin in the iron storage areas is
already combined with iron, the rate of additional iron
absorption from the intestinal tract becomes greatly
decreased.
Conversely
, when the iron stores have become
depleted
, the rate of absorption can accelerate probably
five
or more times normal. Thus, total body iron is
regulated mainly by altering the rate of absorption.
Life Span and Destruction of Red Blood Cells
When red blood cells are delivered from the bone
marrow into the circulatory system, they normally
circulate an average of
120
days before being destroyed.
Even though mature red cells do not have a nucleus,
mitochondria,
or
endoplasmic reticulum, they do have
cytoplasmic
enzymes
that are capable of
metabolizing
glucose
and forming small amounts of adenosine
triphosphate.
These enzymes also:-
(1) maintain
pliability
of the cell membrane,
(2) maintain membrane
transport
of
ions
,
(3) keep the iron of the cells’ hemoglobin in the
ferrous
form rather than ferric form, and
(4) prevent
oxidation
of the proteins in the red cells.
Even so, the
metabolic
systems
of old red cells become
progressively
less
active
, and the cells become more and
more
fragile
, presumably because their life processes
wear out.
Once the red cell membrane becomes fragile, the cell
ruptures during passage through some tight spot of the
circulation. Many of the red cells self-destruct in the
spleen, where they squeeze through the red pulp of the
spleen (3 micrometers diameter of
red
pulp
trabeculae).
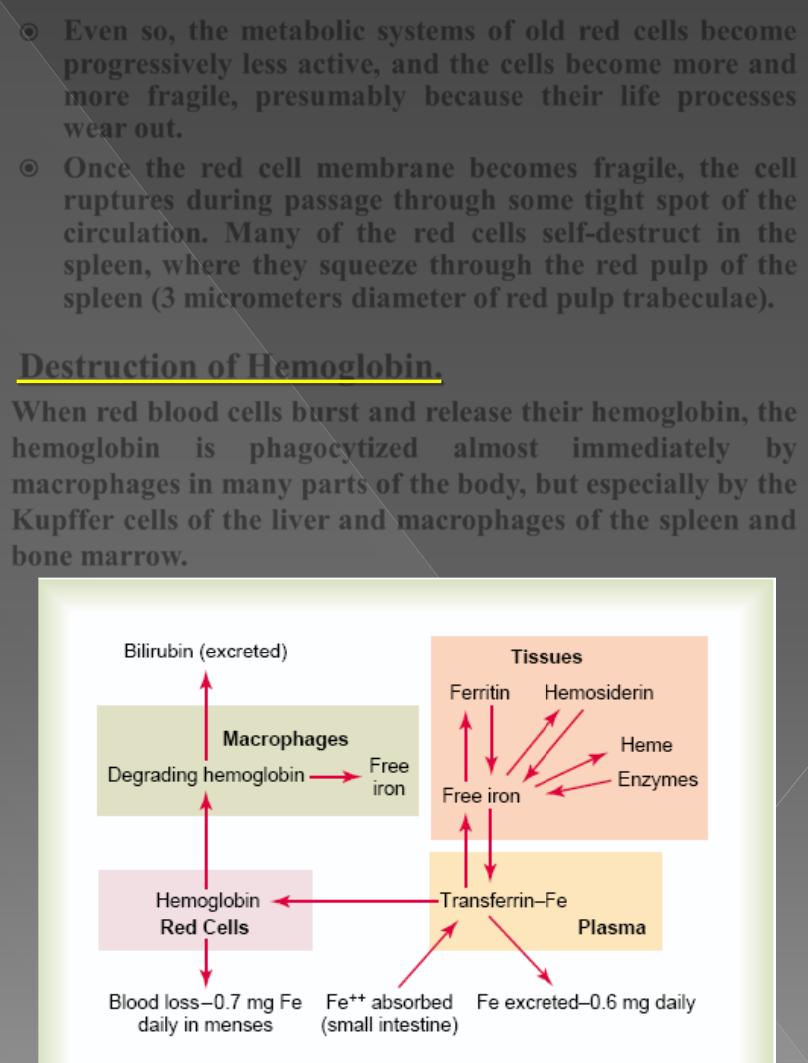
Destruction of Hemoglobin.
When red blood cells
burst
and release their hemoglobin, the
hemoglobin
is
phagocytized
almost
immediately
by
macrophages
in many parts of the body, but especially by the
Kupffer
cells of the liver and
macrophages
of the spleen and
bone marrow.

During the next few hours to days, the
macrophages
release
iron
from the hemoglobin and pass it back into the blood, to be
carried by transferrin either to the bone marrow for the
production of new red blood cells or to the liver and other
tissues for storage in the form of ferritin.
The
porphyrin portion
of the hemoglobin molecule is converted by
the macrophages, through a series of stages, into the
bile
pigment
bilirubin
, which is released into the blood and later
removed from the body by secretion through the liver into the
bile;
Anemias
Anemia means deficiency of hemoglobin in the blood, which
can be caused by either too
few
red blood cells or too
little
hemoglobin
in the cells. Some types of anemia and their
physiologic causes are the following:-
1. Blood Loss Anemia
.
After rapid hemorrhage, the body replaces the
fluid portion
of
the plasma in
1 to 3 days
,
but this leaves a low concentration of red blood cells.
If a second hemorrhage does not occur, the
red blood cell
concentration
usually returns to normal within
3 to 6 weeks
.
In
chronic blood loss
, a person frequently cannot absorb
enough iron from the intestines to form hemoglobin as rapidly
as it is lost. Red cells are then produced that are much smaller
than normal and have too little hemoglobin inside them, giving
rise to
microcytic, hypochromic anemia
,
2. Aplastic Anemia
.
Bone marrow aplasia
means
lack of functioning bone marrow.
For instance, a person exposed to
gamma
ray
radiation from a
nuclear bomb blast can sustain complete destruction of bone
marrow, followed in a few weeks by lethal anemia. Likewise,
excessive
x-ray
treatment, certain
industrial
chemicals
, and
even
drugs
to which the person might be sensitive can cause the
same effect.

3. Megaloblastic Anemia.
loss
of vitamin B12, folic acid, or intrinsic factor can lead
to
slow
reproduction
of erythroblasts (cannot proliferate
rapidly enough to form normal numbers of red blood
cells, in the bone marrow) As a result, the red cells
grow
too large and have bizarre shapes, and are called
megaloblasts.
Thus,
atrophy
of
the
stomach
mucosa, as occurs in
pernicious anemia, or
loss
of the entire stomach after
surgical total gastrectomy can lead to megaloblastic
anemia. Also, patients who have intestinal
sprue
, in
which folic acid, vitamin B12, and other vitamin B
compounds are poorly absorbed, often develop
megaloblastic anemia.
4. Hemolytic Anemia.
Different abnormalities of the red blood cells, many of
which are hereditarily acquired, make the cells
fragile
,
so that they rupture easily as they go through the
capillaries, especially through the spleen.
a. In hereditary spherocytosis
, the red cells are very
small
and
spherical
rather than being biconcave discs. These
cells
cannot withstand compression forces
because they
do not have the normal
loose,
baglike
cell membrane
structure of the biconcave discs. On passing through the
splenic pulp and some other tight vascular beds, they are
easily ruptured

.
b. In sickle cell anemia
,
which is present in 1.0 per cent of West
African
and
American
blacks, the cells have an abnormal type of
hemoglobin called
hemoglobin
S
, containing faulty beta
chains in the hemoglobin molecule,. When this
hemoglobin is exposed to low concentrations of
oxygen
, it
precipitates into long
crystals
inside the red blood cell.
These crystals elongate the cell and give it the
appearance of a sickle rather than a biconcave disc. The
precipitated
hemoglobin
also
damages
the
cell
membrane, so that the cells become highly fragile,
leading to serious anemia.
Such patients frequently experience a vicious circle of
events called a sickle cell disease “
crisis
,” in which low
oxygen tension in the tissues causes sickling, which leads
to ruptured red cells, which causes a further decrease in
oxygen tension and still more sickling and red cell
destruction.
c. In erythroblastosis fetalis
Rh-positive
red blood cells in the fetus are attacked by
antibodies
from an Rh-negative mother. These antibodies
make
the Rh-positive cells
fragile
, leading to rapid
rupture and causing the child to be born with serious
anemia.

Effects of Anemia on Function of the Circulatory
System
The
viscosity
of the blood
depends
almost entirely on the
blood
concentration
of red blood cells. In severe anemia, the
blood viscosity may fall to as low as
1.5
times that of water
rather than the normal value of about
3
.
This
decreases
the
resistance
to blood flow in the peripheral
blood vessels, so that far greater than normal
quantities
of
blood flow through the tissues and return to the heart,
thereby greatly
increasing
cardiac output.
Moreover,
hypoxia
resulting from diminished transport of
oxygen by the blood causes the peripheral tissue blood
vessels to
dilate
, allowing a further increase in the return of
blood to the heart and increasing the cardiac output to a
still higher level— sometimes three to four times normal.
Thus, one of the major effects of anemia is
greatly increased
cardiac
output, as well as increased pumping workload on
the heart.
The increased cardiac output in anemia partially
offsets
the
reduced oxygen-carrying effect of the anemia, because even
though each unit quantity of blood carries only small
quantities of oxygen, the rate of blood flow may be
increased enough so that almost
normal quantities of
oxygen are actually delivered to the tissues.
However, when a person with anemia begins to
exercise
,
the heart is not capable of pumping much greater quantities
of blood than it is already pumping. Consequently, during
exercise, which greatly increases tissue demand for oxygen,
extreme tissue hypoxia
results, and
acute cardiac failure
ensues.

Polycythemia
Secondary Polycythemia.
Whenever the tissues become hypoxic because of
too
little
oxygen in
the breathed air, such as at high altitudes (called
physiologic
polycythemia), or because of failure of oxygen delivery to the tissues,
such as in
cardiac
failure, the blood-forming organs automatically
produce large quantities of extra red blood cells.
Polycythemia Vera.
In addition to those people who have physiologic polycythemia, others
have a
pathological
condition known as polycythaemia vera, in which
hematocrit may be
60
to
70
per cent instead of the normal 40 to 45 per
cent. Polycythemia vera is caused by a
genetic
aberration in the
hemocytoblastic
cells that produce the blood cells.
In polycythemia vera, not only does the hematocrit increase, but the
total
blood volume
also increases, on some occasions to almost twice
normal. As a result, the entire vascular system becomes intensely
engorged. In addition,
many blood capillaries become plugged
by the
viscous blood; the viscosity of the blood in polycythaemia vera
sometimes increases from the normal of 3 times the viscosity of water
to
10
times that of water.
Effect of Polycythemia on Function of the Circulatory
System
Because of the greatly increased
viscosity
of the blood in polycythemia,
blood flow through the peripheral blood vessels is often very
sluggish
,
decreases
the rate of
venous
return
to the heart. Conversely, the blood
volume
is greatly increased in polycythemia, which tends to increase
venous return. So, the
cardiac output in polycythemia is not far from
normal.
The
arterial pressure
is also normal in most people with polycythemia,
although in about one third of them, the arterial pressure is elevated.
The
color of the skin
depends to a great extent on the quantity of blood
in the skin
subpapillary
venous plexus. In polycythemia vera, the
quantity of blood in this plexus is greatly increased. Further, because
the blood passes
sluggishly
through the skin capillaries before entering
the venous plexus, deoxygenated hemoglobin is elevated. The
blue
color
of all this deoxygenated hemoglobin masks the red color of the
oxygenated hemoglobin givig bluish (cyanotic) tint to the skin.
