8
Lec. 4 - Ketogenesis (Biosynthesis of
ketone bodies)
In humans, liver mitochondria has capacity to divert any
excess acetyl-CoA formed in the liver during oxidation of
fatty acids or oxidation of pyruvate that exceed capacity of
citric acid cycle to the ketone bodies , where they can
reconvert to acetyl CoA & oxidized by citric acid cycle.
Why ketone bodies synthesized by the liver:
The production and export of ketone bodies from the liver to
extrahepatic tissues allow continued oxidation of fatty acids
in the liver when acetyl-CoA is not being oxidized in the
citric acid cycle.
Ketone bodies are important sources of energy
for the peripheral tissues because:
1) They are soluble in aqueous solution (don't need to be
incorporated into lipoproteins or carried by albumin like lipid).
2) Produced in liver when acetyl-CoA present exceed the
oxidative capacity of the liver.
3) They are used in proportion to their concentration in the blood
by extrahepatic tissues (skeletal & cardiac muscle & renal
cortex).
4) Brain, heart & muscle can use ketone bodies to meet their
energy needs if the blood levels rise sufficiently (during
prolonged periods of fasting).
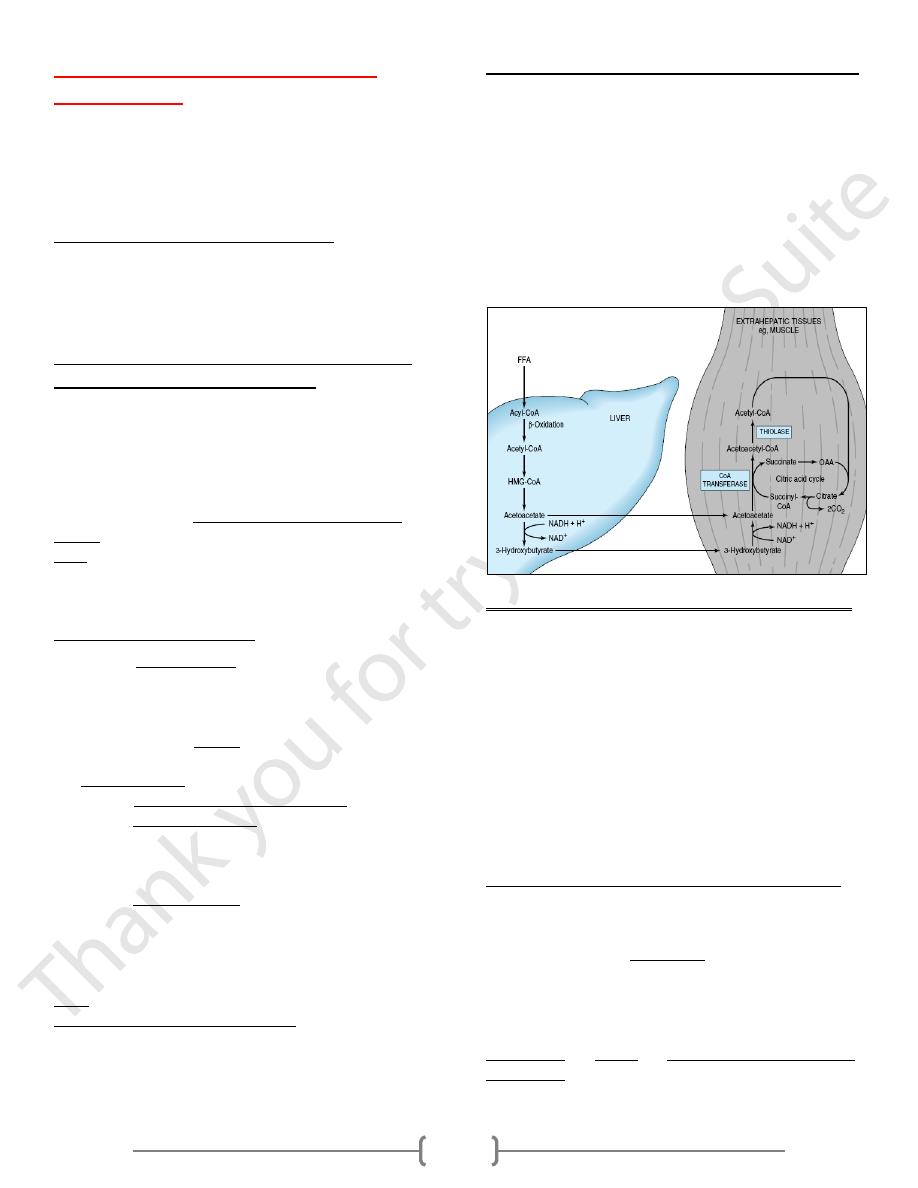
Synthesis of ketone bodies
1) Formation of acetoacetyl CoA can occur by one of 2
processes:
a. Incomplete breakdown of fatty acid.
b. Enzymatic condensation of two molecules of acetyl-CoA,
which catalyzed by thiolase (the reversal of thiolase
reaction of fatty acid oxidation).
2) The acetoacetyl-CoA, condenses with 3
rd
molecule of acetyl-
CoA to form β -hydroxy- β -methylglutaryl-CoA (HMG-CoA)
catalyzed by HMG-CoA synthase (the rate limiting step in the
synthesis of ketone bodies & present in significant quantities
only in the liver).
3) HMG-CoA is cleaved to free acetoacetate and acetyl-CoA
catalyzed by HMG-CoA lyase.
4) The acetoacetate is reversibly reduced by D-β-hydroxy-
butyrate dehydrogenase with NADH as hydrogen donor to
β–hydroxybutyrate or it can be spontaneously
decarboxylated to form acetone.
Note:
D-β-hydroxy-butyrate dehydrogenase
[mitochondrial enzyme, specific for the D stereoisomer; it
does not act on L- β -hydroxyacyl-CoA and is not to be
confused with L- β -hydroxyacyl-CoA dehydrogenase of the
β-oxidation pathway.
Utilization of ketone bodies by peripheral tissues
• Liver constantly produces low levels of ketone bodies, but
their production becomes significant during starvation, when
ketone bodies are needed to provide energy to the peripheral
tissues.
• Liver actively produces ketone bodies, but it can't utilize it as
a fuel because [can not reconvert acetoacetate to acetyl CoA]
,while in extrahepatic tissues, acetoacetate is activated to
acetoacetyl-CoA by succinyl CoA - acetoacetate CoA
transferase which transfer CoA portion from succinyl-CoA
to acetoacetate to form acetoacetyl-CoA .
Utilization of ketone bodies including the following steps:
1) 3-hydroxy butyrate is oxidized to acetoacetate by 3-hydroxy
butyrate dehydrogenase, producing NADH.
2) Acetoacetate receives a coenzyme A from succinyl CoA by
the action of succinyl CoA - acetoacetate CoA transferase
[succinyl CoA transferase] present in all tissues except the
liver?
Its absence allows the liver to produce ketone bodies but not
utilize them; this ensures that extrahepatic tissues have access
to ketone bodies as a fuel source during prolonged fasting &
starvation.
3) Acetoacetyl CoA is actively removed by its conversion to two
molecules of acetyl CoA by the action of thiolase.
Ketogenesis is regulated at three crucial steps:
1) Partition of acetyl-CoA between the pathway of
ketogenesis and the citric acid cycle.
• Fall in concentration of oxaloacetate, within the mitochondria,
impair the ability of the citric acid cycle to metabolize acetyl-
CoA and divert fatty acid oxidation toward ketogenesis.
Because increase in the [NADH]/[NAD+] ratio caused by
increased β-oxidation affecting the equilibrium between
oxaloacetate and malate and decreasing the concentration of
oxaloacetate.

9
2) Free fatty acid mobilization from adipose tissue; directly
affects the level of ketogenesis
the factors regulating mobilization of free fatty acids from
adipose tissue are important in controlling ketogenesis.
3) The activity of carnitine palmitoyl transferase- I in liver,
which determines the proportion of the fatty acid flux that is
oxidized rather than esterified; HOW
• CPT-I activity is low in the fed state, leading to decrease fatty
acid oxidation, and , high in starvation, allowing fatty acid
oxidation to increase
• Malonyl-CoA, formed by acetyl-CoA carboxylase in the fed
state, is a potent inhibitor of CPT-I.
• Concentration of free fatty acids increases with the onset of
starvation, acetyl- CoA carboxylase is inhibited and malonyl-
CoA decreases, CPT-I transport more of acyl-CoA to
mitochondria to be oxidized (increase production of Acetyl-
CoA).
• These events are reinforced in starvation by decrease in the
[insulin]/[glucagon] ratio.
Lec. 5 - Ketosis
Higher level of ketone bodies than normal present in the blood
(ketonemia) or urine (ketonuria).
Ketoacidosis: increase acidity of the blood due to presence of
high concentration of ketone bodies.
ketone bodies are moderately strong acids and buffered with
alkali reserve (plasma bicarbonate) when present in blood but
their continuous production in large quantity progressively
depletes this reserve, causing ketoacidosis .
The higher ketone bodies conc. in the blood or urine due to
increased production by liver rather than decrease in their
utilization by extrahepatic tissues.
Ketoacidosis develops from excessive production of acetyl –
CoA due to body attempts to obtain energy from stored fat in
the absence of adequate carbohydrate metabolites. This
condition reinforced by : Inadequate incorporation of acetyl-
CoA into TCA due to decrease of the oxaloacetate
concentration
Ketosis reflects excessive use of fat due to:
1- Intracellular glucose deficiency
2- Low insulin level & activity:
How
This will increase rate of production of gluconeogenic
substrate by glycolysis & proteolysis & rate of hepatic
gluconeogenesis.
Lead to increase rate of glucose released into the
extracellular, this is appropriate in starvation, but aggravates
the hyperglycemia in DM.
ketosis can be reversed by restoring adequate of
carbohydrate metabolism.
1) In starvation:
Restorations consist of adequate carbohydrate ingestion.
2) In diabetic ketosis :
can be reversed by insulin administration ,which permits
circulating blood glucose to be taken up by the cells ,with
production of oxaloacetate (the acceptor of acetyl –CoA ),
normal metabolism is restored & decrease release of FA from
adipose tissues .
