
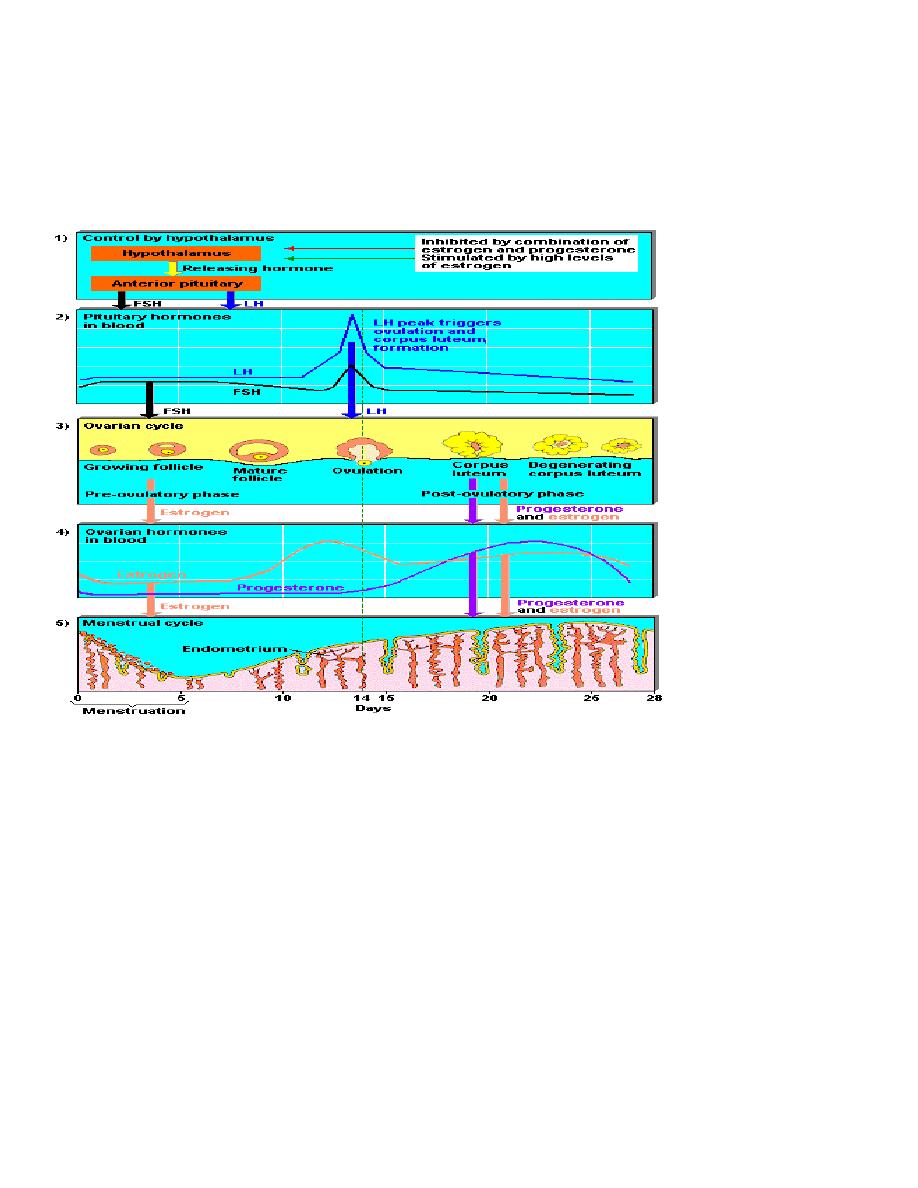
Physiology of normal menstrual cycle
external manifestation of a normal menstrual cycle occurs as a result of the
shedding of the endometrial lining following failure of fertilization of the oocyte
or failure of implantation. The cycle depends on changes occurring within the
ovaries and fluctuation in ovarian hormone levels, that are themselves controlled
by the pituitary and hypothalamus, the hypothalamo–pituitary–ovarian axis
(HPO).
The hypothalamus
The hypothalamus in the forebrain secretes the peptide hormone
gonadotrophin-releasing hormone (GnRH), which in turn controls pituitary
hormone secretion. GnRH must be released in a pulsatile fashion to stimulate
pituitary secretion of luteinizing hormone (LH) and follicle stimulating hormone
(FSH). If GnRH is given in a constant high dose, it desensitizes the GnRH
receptor and reduces LH and FSH release.
Drugs that are GnRH agonists (e.g. buserelin and goserelin) can be used as
treatments for endometriosis and other gynaecological problems. Although they
mimic the GnRH hormone, when administered continuously, they will
downregulate the pituitary and consequently decrease LH and FSH secretion.
This has effects on ovarian function such that oestrogen and progesterone levels
also fall, and most women using these analogues become amenorrhoeic. These
preparations are used as treatments for endometriosis and to shrink fibroids prior
to surgery.
Pituitary gland
GnRH stimulation of the basophil cells in the anterior Pituitary gland causes
synthesis and release of the Gonadotrophic hormones, FSH and LH. This process is
modulated by the ovarian sex steroid hormones oestrogen and progesterone .
Low levels of oestrogen have an inhibitory effect on LH production (negative
feedback), high levels of oestrogen will increase LH production (positive
feedback).
The mechanism of action for the positive feedback effect of oestrogen involves an
increase in GnRH receptor concentrations, while the mechanism of the negative
feedback effect is uncertain.
Fifth stage Lec-
Dr.
gynaecology
14/11/2016

The high levels of circulating oestrogen in the late follicular phase of the ovary act
via the positive feedback mechanism to generate a periovulatory LH surge from
the pituitary.
The clinical relevance of these mechanisms is seen in the use of the combined
oral contraceptive pill, which artificially creates a constant serum oestrogen
level in the negative feedback range, inducing a correspondingly low level of
gonadotrophin hormone release.
Unlike oestrogen, low levels of progesterone have a positive feedback effect on
pituitary LH and FSH secretion (as seen immediately prior to ovulation) and
contribute to the FSH surge.
High levels of progesterone, as seen in the luteal phase, inhibit pituitary LH and
FSH production.
Positive feedback effects of progesterone occur via increasing Sensitivity to
GnRH in the pituitary. Negative feedback effects Are generated through both
decreased GnRH production from the hypothalamus and decreased sensitivity to
GnRH in the pituitary. It is known that progesterone can only have these effects on
gonadotropic hormone release after priming by oestrogen
In addition to these well-known hormones, there are other hormones which are
involved in pituitary gonadotrophin secretion.
Inhibin and activin are peptide hormones produced by granulosa cells in the
ovaries, with opposing effects on gonadotrophin production. Inhibin inhibits
pituitary FSH secretion, whereas activin stimulates it.
Ovaries
Ovaries with developing oocytes are present in the female fetus from an early
stage of development. By the end of the second trimester in utero, the number of
oocytes has reached a maximum and they arrest at the first prophase step in
meiotic division. No new oocytes are formed during the female lifetime.
With the onset of menarche, the primordial follicles containing oocytes will
activate and grow in a cyclical fashion, causing ovulation and subsequent
menstruation in the event of non-fertilization.
In the course of a normal menstrual cycle, the ovary will go through three
phases:
1 Follicular phase
2 Ovulation
3 Luteal phase.
Follicular phase
The initial stages of follicular development are independent of hormone
stimulation. However, follicular development will fail at the preantral stage and
follicular atresia will ensue if pituitary hormones LH and FSH are absent.
FSH levels rise in the first days of the menstrual cycle, when oestrogen,
progesterone and inhibin levels are low. This stimulates a cohort of small Antral
follicles on the ovaries to grow.
Within the follicles, there are two cell types which are involved in the processing
of steroids, including oestrogen and progesterone. These are the theca and
the granulosa cells, which respond to LH and FSH stimulation, respectively.
LH stimulates production of androgens from cholesterol within theca cells.
These androgens are converted into oestrogens by the process of aromatization in
granulosa cells, under the influence of FSH.
The roles of FSH and LH in follicular development are demonstrated by studies
on women undergoing ovulation induction in whom endogenous gonadotrophin
production has been suppressed. If pure FSH alone is used for ovulation induction,
an ovulatory follicle can be produced, but oestrogen production is markedly
reduced.
Both FSH and LH are required to generate a normal cycle With adequate amounts
of oestrogen.

As the follicles grow and oestrogen secretion increases, there is negative feedback
on the pituitary to decrease FSH secretion. This assists in the selection of one
follicle to continue in its development towards ovulation – the dominant follicle.
In the ovary ,the follicle which has the most efficient Aromatase activity and
highest concentration of FSH-Induced LH receptors will be the most likely to
survive as FSH levels drop, while smaller follicles will undergo atresia.
The dominant follicle will go on producing oestrogen and also inhibin, which
enhances androgen synthesis under LH control.
Ovarian stimulation beyond the control of the normal
hypothalamo–pituitary–ovarian axis will not progress in the manner described
above ,as it is dependent on appropriate gonadotrophic hormone response from the
pituitary controlling the follicular development.
Administration of exogenous gonadotrophins is likely to stimulate growth of
multiple follicles which continue to develop and are released at ovulation (and can
lead to Multiple gestations at a rate of around 30 per cent).
This situation is used to advantage in patients requiring in vitro fertilization (IVF),
as many oocytes can be harvested from ovaries which have been stimulated as
described above. They can then undergo fertilization in vitro, and surviving
embryos can be chosen for transfer back to the uterus.
There are other autocrine and paracrine mediators playing a role in the follicular
phase of the menstrualcycle. These include inhibin and activin. Inhibin is
produced in men in the testicles to inhibit pituitary FSH production. In women, it
is secreted by the granulose cells within the ovaries. It participates in feedback to
the pituitary to downregulate FSH release, and also appears to enhance ongoing
androgen synthesis. Activin is structurally similar to inhibin, but has an opposite
action.It is produced in granulosa cells and in the pituitary, and acts to increase
FSH binding on the follicles.
Insulin-like growth factors (IGF-I, IGF-II) act as paracrine regulators.
Circulating levels do not change during the menstrual cycle, but follicular Fluid
levels increase towards ovulation, with the Highest level found in the dominant
follicle. The actions of IGF-I and -II are modified by their binding
Proteins:insulin-like growth factor binding proteins (IGFBPs).
In the follicular phase, IGF-I is produced by theca cells under the action of LH.
IGF-I receptors are present on both theca and granulosa cells.
Within the theca, IGF-I augments LH-induced Steroidogenesis.In granulosa cells,
IGF-I augments the Stimulatory effects of FSH on mitosis, aromatase activity
And inhibin production.
In the preovulatory follicle,IGF-I enhances LH-induced progesterone production
from granulosa cells.

Following ovulation, IGF-II is produced from luteinized granulosa cells, and acts
in an autocrine manner to augment LH-induced proliferation of granulosa cells.
Kisspeptins are proteins which have more recently been found to play a role in
regulation of the HPO axis, via the mediation of the metabolic hormone leptin’s
effect on the hypothalamus. Leptin is thought to be key in the relationship
between energy production, weight and reproductive health. Mutations in the
kisspeptin receptor, gpr-54, are associated with delayed or absent puberty,
probably due to a reduction in leptin-linked triggers for gonadotrophin release.
Ovulation
By the end of the follicular phase, which lasts an average of 14 days, the dominant
follicle has grown to approximately 20 mm in diameter. As the follicle matures,
FSH induces LH receptors on the granulosa cells to compensate for lower FSH
levels and Prepare for the signal for ovulation. Production of oestrogen increases
until they reach the necessary threshold to exert a positive feedback effort on the
hypothalamus and pituitary to cause the LH surge. This occurs over 24–36 hours,
during which time the LH-induced luteinization of granulosa cells in the
Dominant follicle causes progesterone to be produced, adding further to the
positive feedback for LH secretion and causing a small periovulatory rise in FSH.
Androgens,synthesized in the theca cells, also rise Around the time of ovulation
and this is thought to have an Important role in stimulating libido, ensuring that
sexual activity is likely to occur at the time of greatest fertility.
The LH surge is one of the best predictors of imminent ovulation, and this is the
hormone detected in urine by most over-the-counter ‘ovulation predictor’ tests.
The LH surge has another function in stimulating the resumption of meiosis in the
oocyte just prior to its release. The physical ovulation of the oocyte occurs after
breakdown of the follicular wall Occurs under the influence of LH, FSH and
Progesterone controlled proteolytic enzymes, such as plasminogen activators and
prostaglandins.
There appears to be an inflammatory-type response within the follicle wall which
may assist in extrusion of the oocyte by stimulating smooth muscle activity.
Studies have shown that inhibition of prostaglandin production may result in
failure of ovulation. Thus, women wishing to become pregnant should be advised
to avoid taking prostaglandin synthetase inhibitors, such as aspirin and
ibuprofen,which may inhibit oocyte release.
Luteal phase
After the release of the oocyte, the remaining granulose and theca cells on the
ovary form the corpus luteum. The granulosa cells have a vacuolated appearance
with accumulated yellow pigment, hence the name corpus luteum (‘yellow body’).
The corpus luteum undergoes extensive vascularization in order to supply
granulosa cells with a rich blood supply for continued steroidogenesis. This is
aided by local production of vascular endothelial growth factor (VEGF).
Ongoing pituitary LH secretion and granulosa cell activity ensures a supply of
progesterone which Stabilizes the endometrium in preparation for pregnancy.
Progesterone levels are at their highest in the cycle During the luteal phase. This
also has the effect of Suppressing FSH and LH secretion to a level that will not
produce further follicular growth in the ovary during that cycle.
The luteal phase lasts 14 days in most women, without great variation. In the
absence of beta human chorionic gonadotrophin (bHCG) being produced from an
implanting embryo, the corpus luteum will regress in a process known as
luteolysis.
The mature corpus luteum is less sensitive to LH, produces Less progesterone,
and will gradually disappear from the ovary. The withdrawal of progesterone has
the effect on the uterus of causing shedding of the endometrium and thus
menstruation. Reduction in levels of progesterone, oestrogen and inhibin feeding
back to the pituitary cause increased secretion of gonadotrophic hormones,
particularly FSH.
New preantral follicles begin to be stimulated and the cycle begins anew.
Endometrium
The hormone changes effected by the HPO axis During the menstrual cycle will
occur whether the uterus is present or not. However, the specific secondary
changes in the uterine endometrium give the most obvious external sign of regular
cycles.
menstruation
The endometrium is under the influence of sex steroids that circulate in females of
reproductive age.Sequential exposure to oestrogen and progesterone will result in
cellular proliferation and differentiation, in preparation for the implantation of an
embryo in the event of pregnancy, followed by regular bleeding in response to
progesterone withdrawal if the corpus luteum regresses.
During the ovarian follicular phase, the endometrium undergoes proliferation
(the ‘proliferative phase’); during the ovarian luteal phase, it has its ‘secretory
phase’.
Decidualization, the formation of a specialized glandular endometrium, is an
irreversible process and apoptosis occurs if there is no embryo implantation.

Menstruation (day 1) is the shedding of the ‘dead’ endometrium and ceases as the
endometrium regenerates (which normally happens by day 5–6 of the cycle).
The secretory endometrium has 3 distinct zones:
1. basal layer(25%),which is retained during menstruation and shows few changes
during the cycle(stratum basalis).
2. Stratum spongiosum(mid portion 50%),have oedematous stroma and exhausted
glands.
3. Stratum compactum(upper portion 25%),have prominent decidualized stromal
cells.
The endometrium is composed of two layers, the Uppermost(2 zones) of which is
shed during menstruation.
A fall in circulating levels of oestrogen and progesterone approximately 14 days
after ovulation leads to loss of tissue fluid, vasoconstriction of spiral arterioles and
distal ischaemia. This results in tissue breakdown, and loss of the upper layer
along with bleeding from fragments of the remaining arterioles is seen as
menstrual bleeding. Enhanced fibrinolysis reduces clotting.
In the same way patients taking the combined Oral Contraceptive pill or
hormone replacement Therapy who experience a withdrawal bleed during their
pill free week each month.
Vaginal bleeding will cease after 5–10 days as arterioles vasoconstrict and the
endometrium begins to regenerate.
Haemostasis in the uterine endometrium is different from haemostasis elsewhere
in the body as it does not involve the processes of clot formation and fibrosis.
In rare cases, the tissue breakdown and vasoconstriction does not occur correctly
and the endometrium may develop scarring which goes on to inhibit its function.
This is known as ‘Asherman’s syndrome’.
The endocrine influences in menstruation are clear. However, the paracrine
mediators less so. Prostaglandin F2a, endothelin-1 and plateletactivating factor
(PAF) are vasoconstrictors which Are produced within the endometrium and are
Thought likely to be involved in vessel constriction, Both initiating and
controlling menstruation.
They may be balanced by the effect of vasodilator agents, such as prostaglandin
E2, prostacyclin (PGI) and nitric oxide (NO), which are also produced by the
endometrium.
Progesterone withdrawal increases endometrial prostaglandin (PG) synthesis and
decreases PG metabolism. The COX-2 enzyme and chemokines are involved in
PG synthesis and this is likely to be the target of non-steroidal anti-inflammatory
agents used for the treatment of heavy and painful periods.

Endometrial repair involves both glandular and stromal regeneration and
angiogenesis.
VEGF and fibroblast growth factor (FGF) are found within The endometrium and
both are powerful angiogenic agents. Epidermal growth factor (EGF) appears tobe
responsible for mediation of oestrogen-induced glandular and stromal
regeneration. Other growth factors, such as transforming growth factors (TGFs)
and IGFs, and the interleukins may also be important.
The proliferative phase
Menstruation will normally cease after 5–7 days, once endometrial repair is
complete. After this time, the endometrium enters the proliferative phase, when
glandular and stromal growth occur. The epithelium lining the endometrial glands
changes from a single layer of columnar cells to a pseudostratified epithelium
with frequent mitoses.
The stroma is infiltrated by cells derived from the bone marrow.
Endometrial thickness increases rapidly, from 0.5 mm at menstruation to 3.5–5
mm at the end of the proliferative phase
The secretory phase
After ovulation (generally around day 14), there is a period of endometrial
glandular secretory activity.
Following the progesterone surge, the oestrogen Induced cellular proliferation is
inhibited and the endometrial thickness does not increase any further.
However, the endometrial glands will become more tortuous, spiral arteries will
grow, and fluid is secreted into glandular cells and into the uterine lumen. Later in
the secretory phase, progesterone induces the formation of a temporary layer,
known as the decidua, in the endometrial stroma.
Histologically, this is seen as occurring around blood vessels. Stromal cells show
increased mitotic activity, nuclear enlargement and generation of a basement
membrane.
Recent research into infertility has identified apical membrane projections of the
endometrial epithelial cells known as pinopodes, which appear after day 21–22
and appear to be a progesterone-dependent stage in making the endometrium
receptive for embryo implantation
Immediately prior to menstruation, three distinct layers of endometrium can be
seen. The basalis is the lower 25 per cent of the endometrium, which will remain
throughout menstruation and shows few changes during the menstrual cycle.
The mid-portion is the stratum spongiosum with oedematous stroma and
exhausted glands. The superficial portion (upper 25 per cent) is the stratum
compactum with prominent decidualized stromal cells.
On the withdrawal of both oestrogen and progesterone, the decidua will collapse,
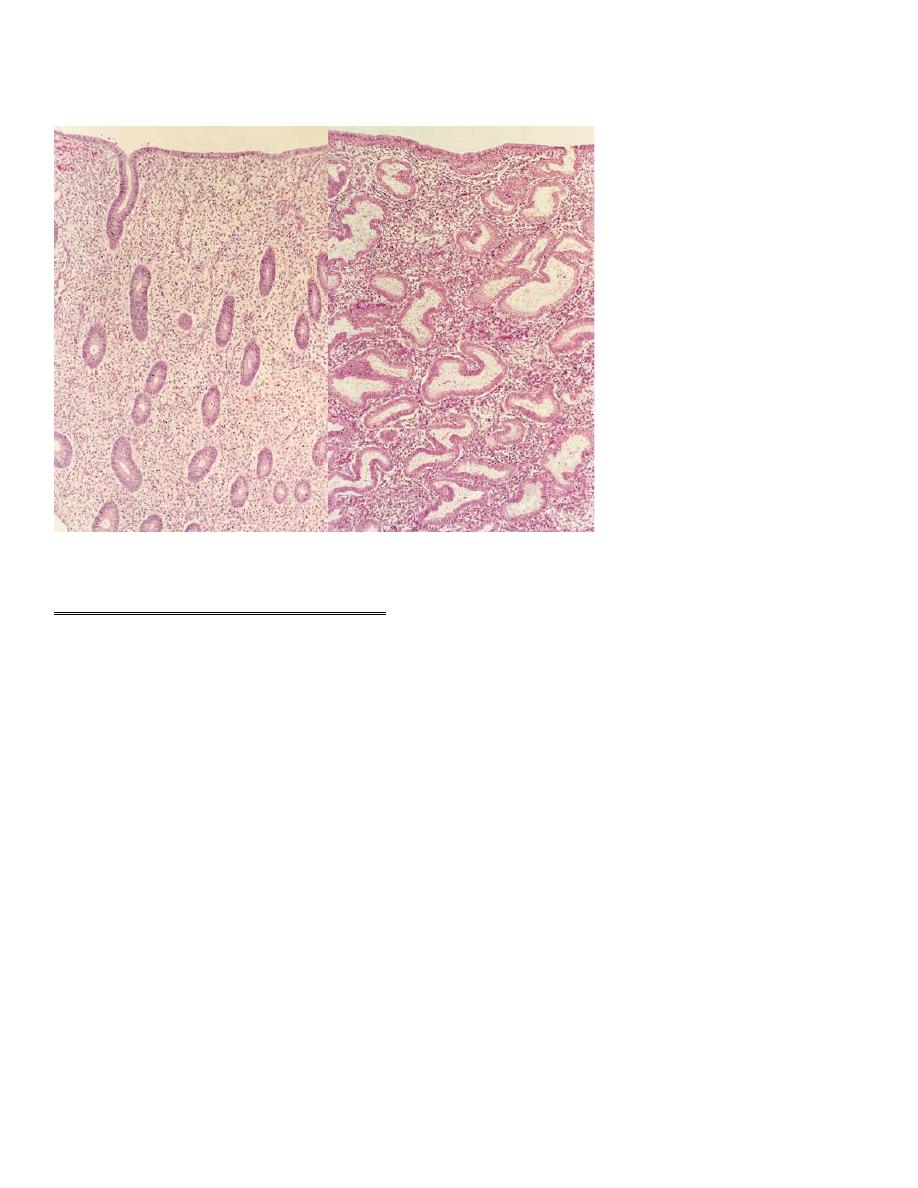
with vasoconstriction and relaxation of spiral arteries and shedding of the outer
layers of the endometrium.
Measurement of ovarian reserve
Female reproductive potential is directly proportionate to the remaining number
of oocytes in the ovaries.
This number decreases from birth onwards, and the rate of loss Accelerates after
the age of 37 in an average healthy woman, or at an earlier age following
longterm gonadotrophin deficit or exposure to toxins, e.g.chemotherapy. It is
desirable to be able to quantify the residual ovarian capacity of women of older
age or after undergoing treatment in order to give Prognostic information and
management advice to patients,and also to compare different forms of treatment.
Research using ultrasound markers has looked at measurements Of ovarian
volume, mean ovarian diameter and antral follicle count to calculate ovarian
reserve.
Biochemical markers include FSH,oestradiol, inhibin B, anti-Mullerian hormone
(AMH). AMH is produced in the granulosa cells of ovarian Follicles and does
not change in response to gonadotrophins during the menstrual cycle. As a result,
it can be measured and compared from any point in the cycle.
