
1
Tricarboxylic acid cycle (TCA cycle, also called the Krebs
cycle or the citric acid cycle)
It is the final pathway where the oxidative metabolism of carbohydrates,
amino acids, and fatty acids converge, their carbon skeletons being
converted to CO2 and H2O. This oxidation provides energy for the
production of the majority of ATP in most animals, including humans.
The cycle occurs totally in the mitochondria.
Intermediates of the TCA cycle can also be synthesized by the catabolism
of some amino acids. Therefore, this cycle should not be viewed as a
closed circle, but instead as a traffic circle with compounds entering and
leaving as required.
Oxidative decarboxylation of pyruvate
Pyruvate, the end-product of aerobic glycolysis, must be transported into
the mitochondrion before it can enter the TCA cycle. This is
accomplished by a specific pyruvate transporter that helps pyruvate cross
the inner mitochondrial membrane. Once in the matrix, pyruvate is
converted to acetyl CoA by the pyruvate dehydrogenase complex, which
is a multienzyme complex. The pyruvate dehydrogenase complex is not
part of the TCA cycle proper, but is a major source of acetyl CoA— the
two-carbon substrate for the cycle
[Note: The irreversibility of the reaction precludes the formation of
pyruvate from acetyl CoA, and explains why glucose cannot be formed
from acetyl CoA via gluconeogenesis.].The Pyruvate Dehydrogenase
Complex Requires Five Coenzymes—thiamine pyrophosphate (TPP),
flavin adenine dinucleotide (FAD), coenzyme A (CoA, sometimes
denoted CoA-SH), nicotinamide adenine dinucleotide (NAD), and
lipoate. Four different vitamins required
in human nutrition are vital
components of this system: thiamine (in TPP), riboflavin (in FAD), niacin
(in NAD), and pantothenate (in CoA).
2
Clinical application:
Pyruvate dehydrogenase deficiency: A deficiency in the pyruvate
dehydrogenase complex is the most common biochemical cause of
congenital lactic acidosis. This enzyme deficiency results in an inability
to convert pyruvate to acetyl CoA, causing pyruvate to be shunted to
lactic acid via lactate dehydrogenase .This causes particular problems for
the brain, which relies on the TCA cycle for most of its energy, and is
particularly sensitive to acidosis.
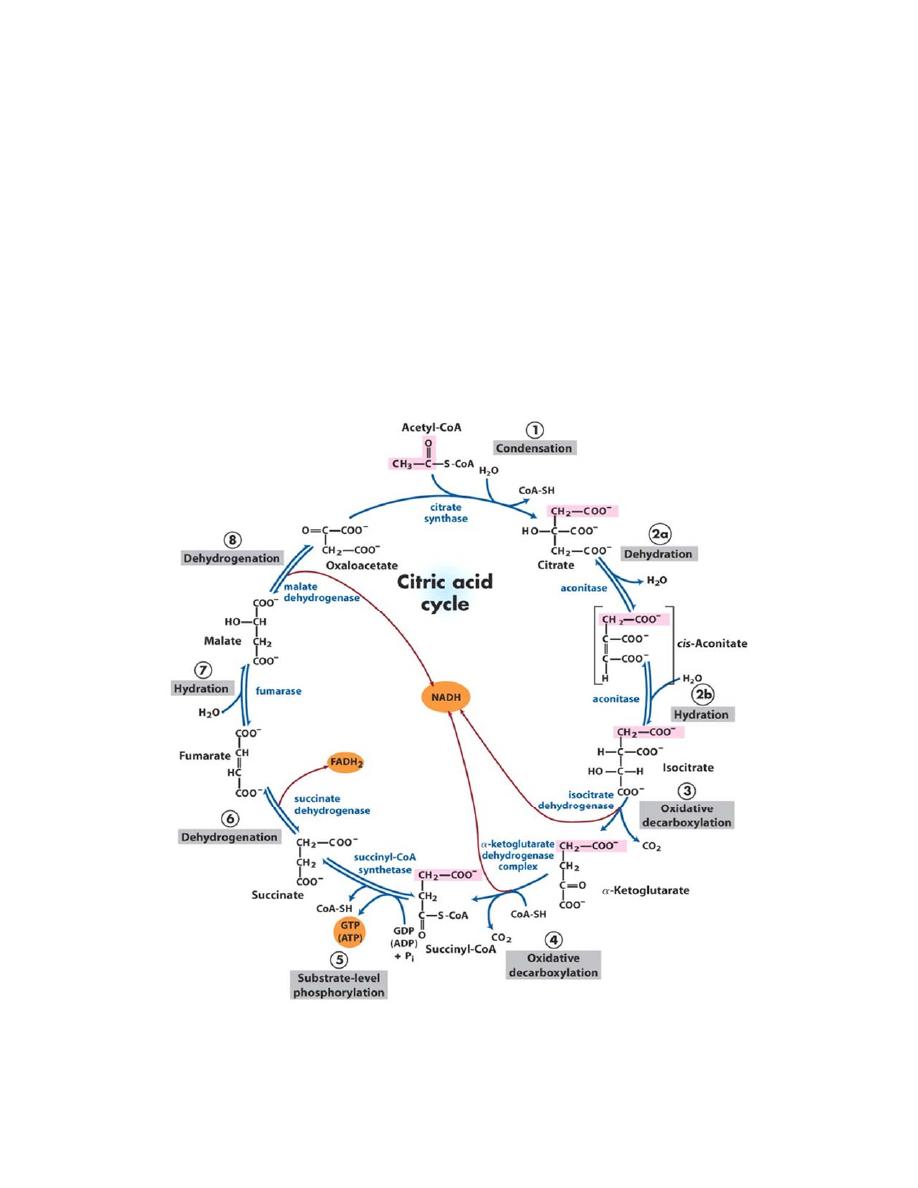
Reactions of the citric acid cycle
.
3
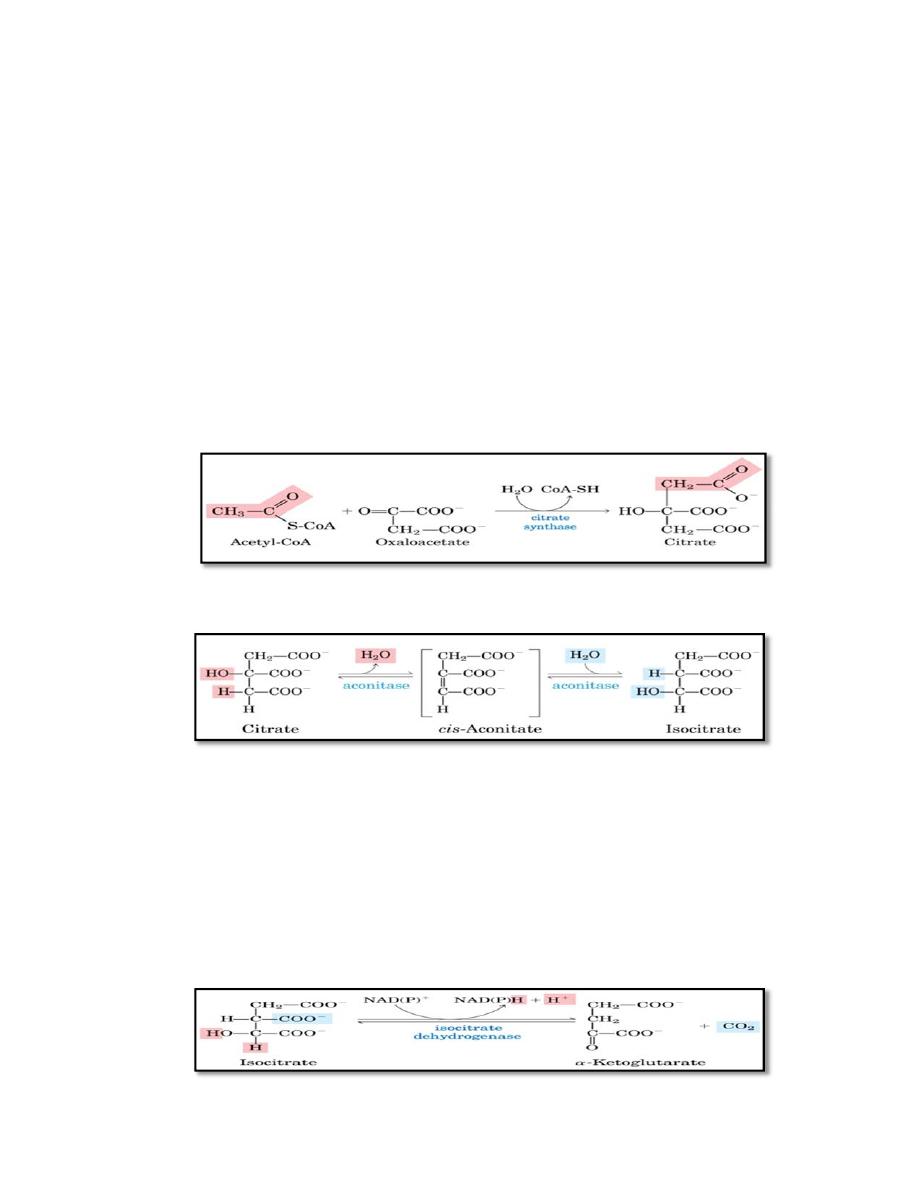
1. Condensation (Synthesis of citrate from acetyl CoA and
oxaloacetate )
The condensation of acetyl CoA and oxaloacetate to form citrate is
catalyzed by citrate synthase.
Citrate synthase is allosterically activated by Ca
2 +
and ADP, and
inhibited by ATP, NADH, succinyl CoA, and fatty acyl CoA derivatives
However, the primary mode of regulation is also determined by the
availability of its substrates, acetyl CoA and oxaloacetate. [Note: Citrate,
in addition to being an intermediate in the TCA cycle, provides a source
of acetyl CoA for the cytosolic synthesis of fatty acids. Citrate also
inhibits phosphofructokinase (PFK), the rate-limiting enzyme of
glycolysis, and activates acetyl CoA carboxylase (the rate-limiting
enzyme of fatty acid synthesis)
2. Isomerization of citrate
Citrate is isomerized to isocitrate by aconitase
3. Oxidation and decarboxylation of isocitrate
Isocitrate dehydrogenase catalyzes the irreversible oxidative
decarboxylation of isocitrate, yielding the first of three NADH
molecules produced by the cycle, and the first release of CO2. This is
one of the rate-limiting steps of the TCA cycle. The enzyme is
allosterically activated by ADP (a low-energy signal) and Ca
++
, and is
inhibited by ATP and NADH, whose levels are elevated when the cell
has abundant energy stores.
4
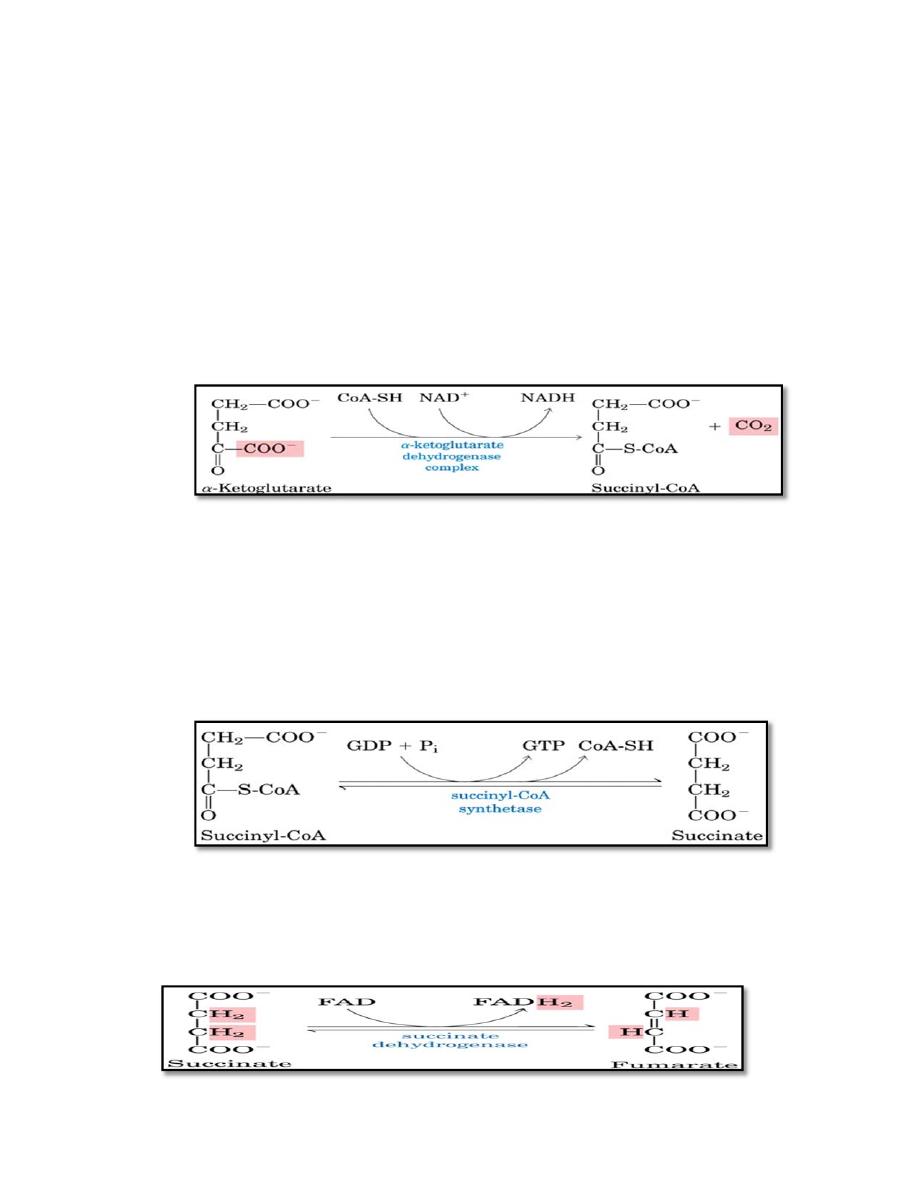
4. Oxidative decarboxylation of α-ketoglutarate
The conversion of α-ketoglutarate to succinyl CoA is catalyzed by the
α-ketoglutarate dehydrogenase complex. The mechanism of this
oxidative decarboxylation is very similar to that used for the
conversion of pyruvate to acetyl CoA. The reaction releases the
second CO2 and produces the second NADH of the cycle. The
coenzymes required are thiamine pyrophosphate, lipoic acid, FAD,
NAD+, and coenzyme A. a-Ketoglutarate dehydrogenase complex is
inhibited by ATP, GTP, NADH, and succinyl CoA, and activated by
Ca
++
.
.
5. Cleavage of succinyl CoA
Succinate thiokinase (also called succinyl CoA synthetase) cleaves the
high-energy thioester bond of succinyl CoA(C-SCoA). This reaction is
coupled to phosphorylation of GDP to GTP. (GTP and ATP are
energetically interconvertible by the nucleoside diphosphate kinase
reaction) .The generation of GTP by succinate thiokinase is another
example of substrate-level phosphorylation.
6. Oxidation of succinate
Succinate is oxidized to fumarate by succinate dehydrogenase, producing
the reduced coenzyme FADH .Succinate dehydrogenase is inhibited by
oxaloacetate.
5
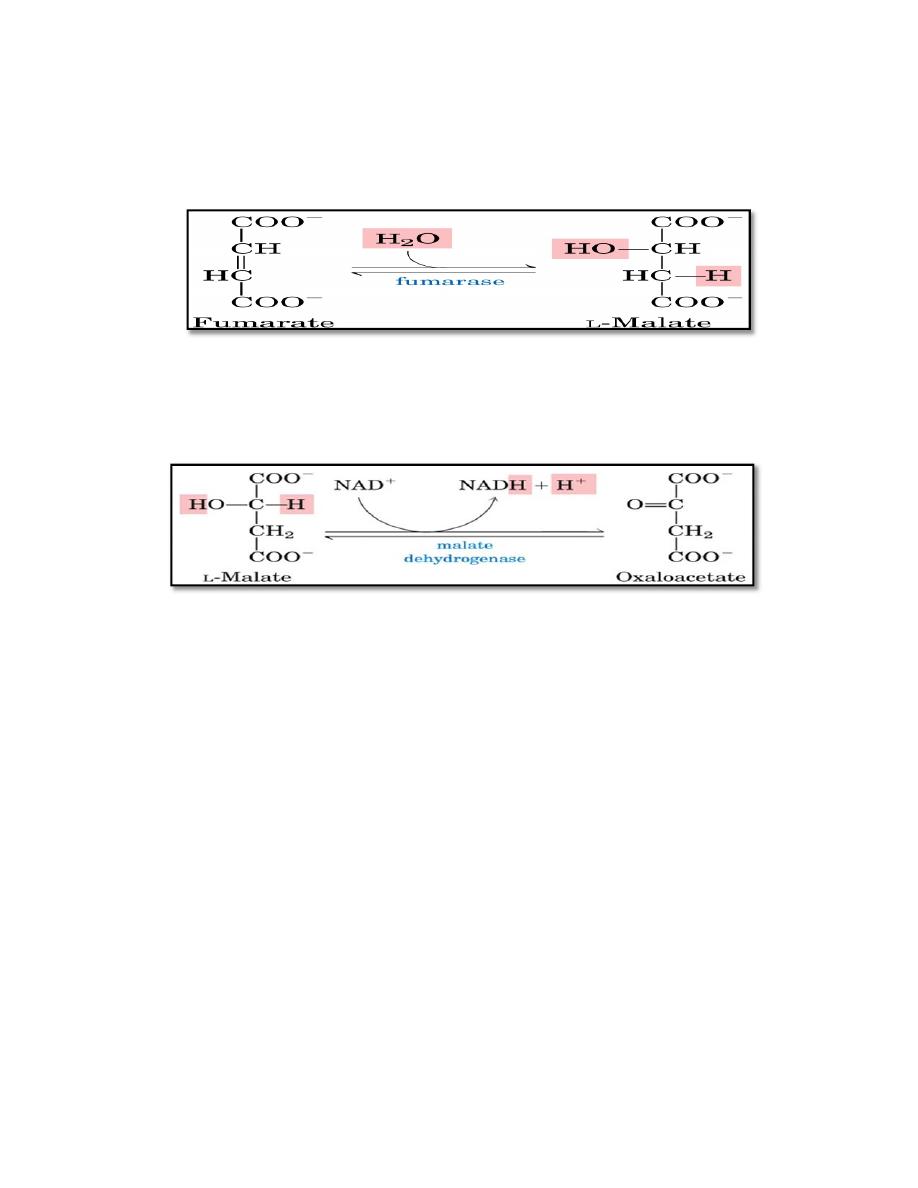
7. Hydration of fumarate
Fumarate is hydrated to malate in a freely reversible reaction catalyzed
by fumarase (also called fumarate hydratase).
8. Oxidation of malate
Malate is oxidized to oxaloacetate by malate dehydrogenase. This
reaction produces the third and final NADH of the cycle.
REGULATION OF THE TCA CYCLE
A. Regulation by activation and inhibition of enzyme activities
TCA cycle is controlled by the regulation of several enzyme activities .
The most important of these regulated enzymes are citrate synthase,
isocitrate dehydrogenase, and ketoglutarate dehydrogenase complex.
B. Regulation by the availability of ADP
1. Effects of elevated ADP: Energy consumption as a result of
muscular contraction, biosynthetic reactions, or other processes
results in the hydrolysis of ATP to ADP and the resulting increase in
the concentration of ADP accelerates the rate of reactions that use
ADP to generate ATP, most important of which is oxidative
phosphorylation. Production of ATP increases until it matches the
rate of ATP consumption by energy-requiring reactions which mean
that ADP activate TCA cycle

6
2. Effects of low ADP:
ADP (or Pi) is present in limiting concentration, the formation of ATP by
oxidative phosphorylation decreases as a result of the lack of phosphate
acceptor (ADP) or inorganic phosphate.
The rate of oxidative phosphorylation is proportional to
[ADP][Pi]/[ATP]; this is known as respiratory control of energy
production. The oxidation of NADH and FADH
2
by the electron transport
chain also stops if ADP is limiting. This is because the processes of
oxidation and phosphorylation are tightly coupled and occur
simultaneously .So as NADH and FADH
2
accumulate, their oxidized
forms become depleted, causing inhibition of TCA cycle.
AMPHIBOLIC PATHWAY
All other pathways such as beta oxidation of fat or glycogen synthesis are
either catabolic or anabolic. But TCA cycle is truly amphibolic (both
catabolic and anabolic) in nature.
Citric Acid Cycle components are
important biosynthetic intermediates in aerobic organisms. Besides its
role in the oxidative catabolism of carbohydrates, fatty acids, and amino
acids, the cycle provides precursors for many biosynthetic pathways,
Ketoglutarate and oxaloacetate can, for example, serve as precursors of
the amino acids aspartate and glutamate by simple transamination
,through aspartate and glutamate, the carbons of oxaloacetate and
ketoglutarate are then used to build other amino acids, as well as purine
and pyrimidine nucleotides. Oxaloacetate is converted to glucose in
gluconeogenesis. SuccinylCoA is a central intermediate in the synthesis
of the porphyrin ring of heme groups, which serve as oxygen carriers (in
hemoglobin and myoglobin) and electron carriers (in cytochromes).
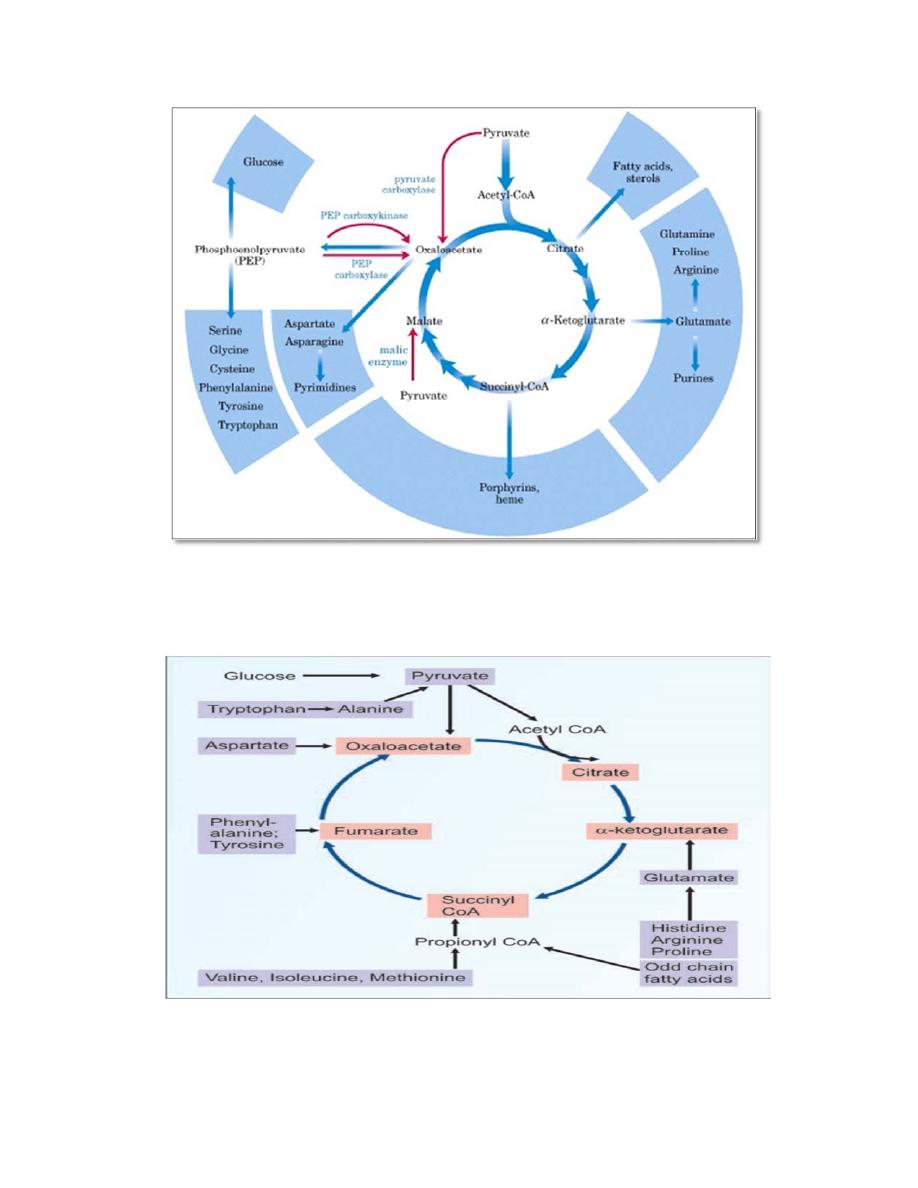
7
Amphibolic pathway of the citric acid cycle
Influx of TCA cycle intermediates
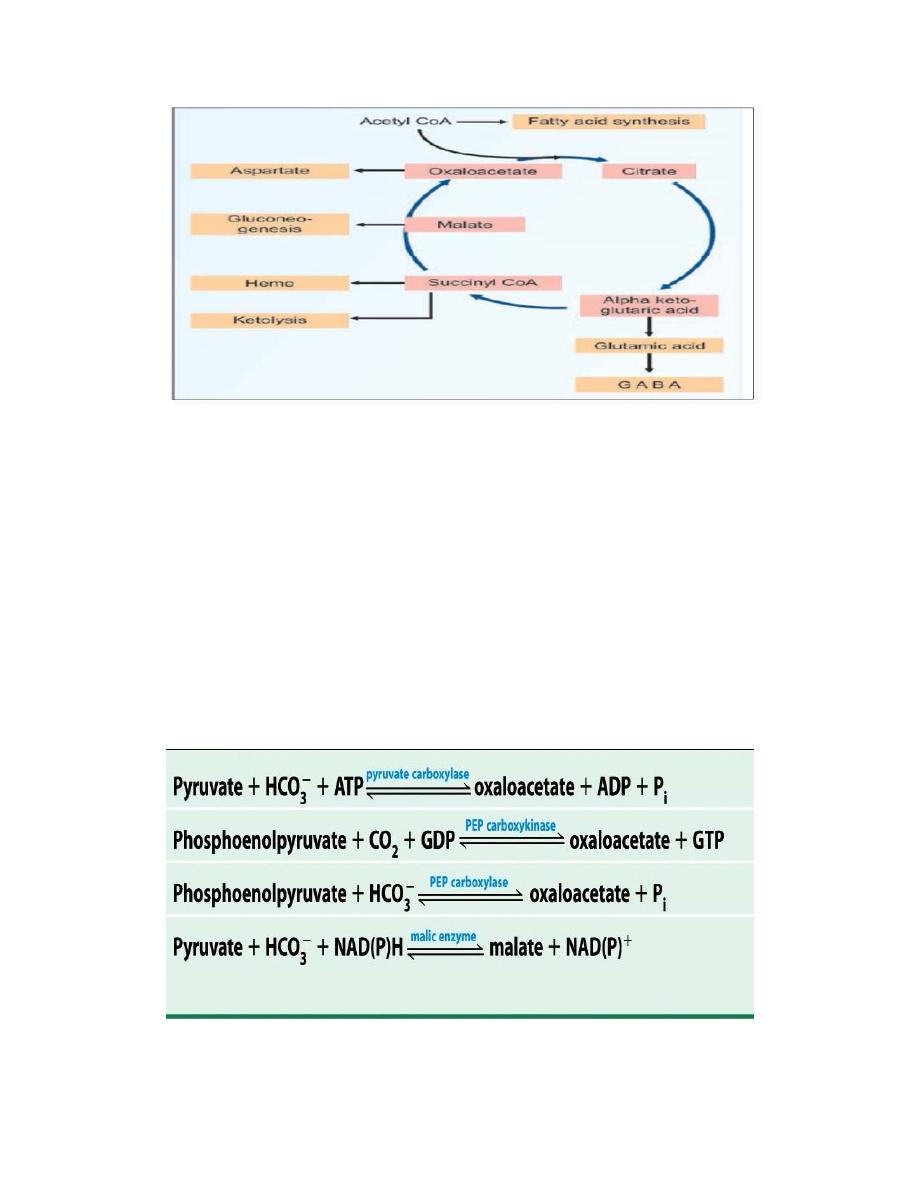
8
Efflux of TCA cycle intermediates
Anaplerotic Reactions
Anaplerotic Reactions replenish Citric Acid Cycle Intermediates as
intermediates of the citric acid cycle are removed to serve as biosynthetic
precursors; they are replenished by anaplerotic reactions. Under normal
circumstances, the reactions by which cycle intermediates are siphoned
off into other pathways and those by which they are replenished are in
dynamic balance, so that the concentrations of the citric acid cycle
intermediates remain almost constant.
Anaplerotic Reactions are:
