Clinical biochemistry second stage lecture 3 Dr.Thana Alsewedy
1
Nitrogen Excretion and the Urea Cycle:
Excess amino Nitrogen from amino acids is removed as ammonia, which
is toxic to the human body. Some ammonia is excreted in urine, but
nearly 90% of it is utilized by the liver to form urea, which is highly
soluble and is passed in to circulation for being excreted by the kidneys.
Daily excretion of urea amounts to about 30g with a protein intake of
nearly 100g in the food.
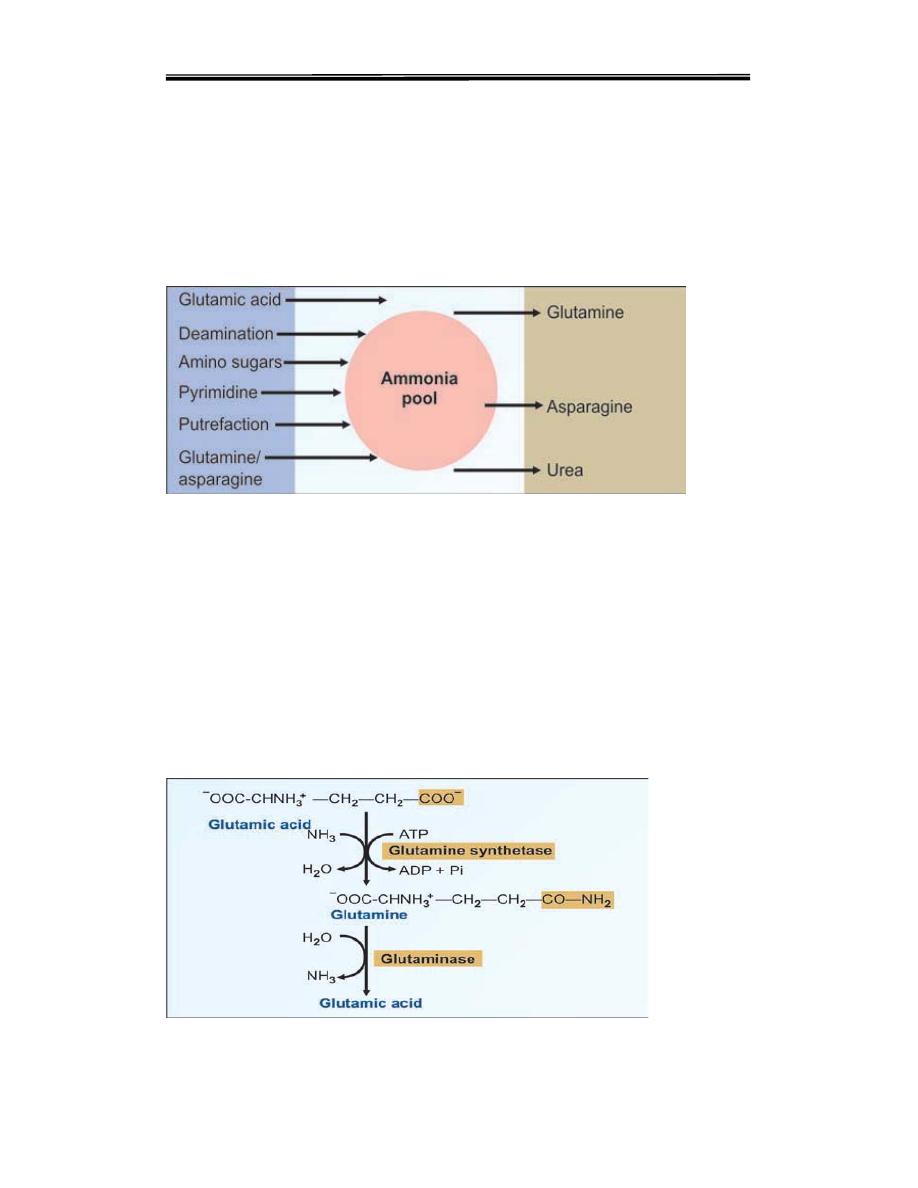
Figure 1.
Sources and fate of ammonia
DISPOSAL/DETOXIFICATION OF AMMONIA
1. First line of Defense (Trapping of ammonia)
Being highly toxic, ammonia should be eliminated or detoxified, as and when
it is formed. Even very minute quantity of ammonia may produce toxicity in
central nervous system. But, ammonia is always produced by almost all cells,
including neurons. The intracellular ammonia is immediately trapped by
glutamic acid to form glutamine, especially in brain cells (Fig. 2). The
glutamine is then transported to liver, where the reaction is reversed by the
enzyme glutaminase (Fig. 2). The ammonia thus generated is immediately
detoxified into urea .Aspartic acid may also undergo similar reaction to form
asparagine.
Figure 2.Ammonia trapping as glutamine
Clinical biochemistry second stage lecture 3 Dr.Thana Alsewedy
2
2. Transportation of Ammonia
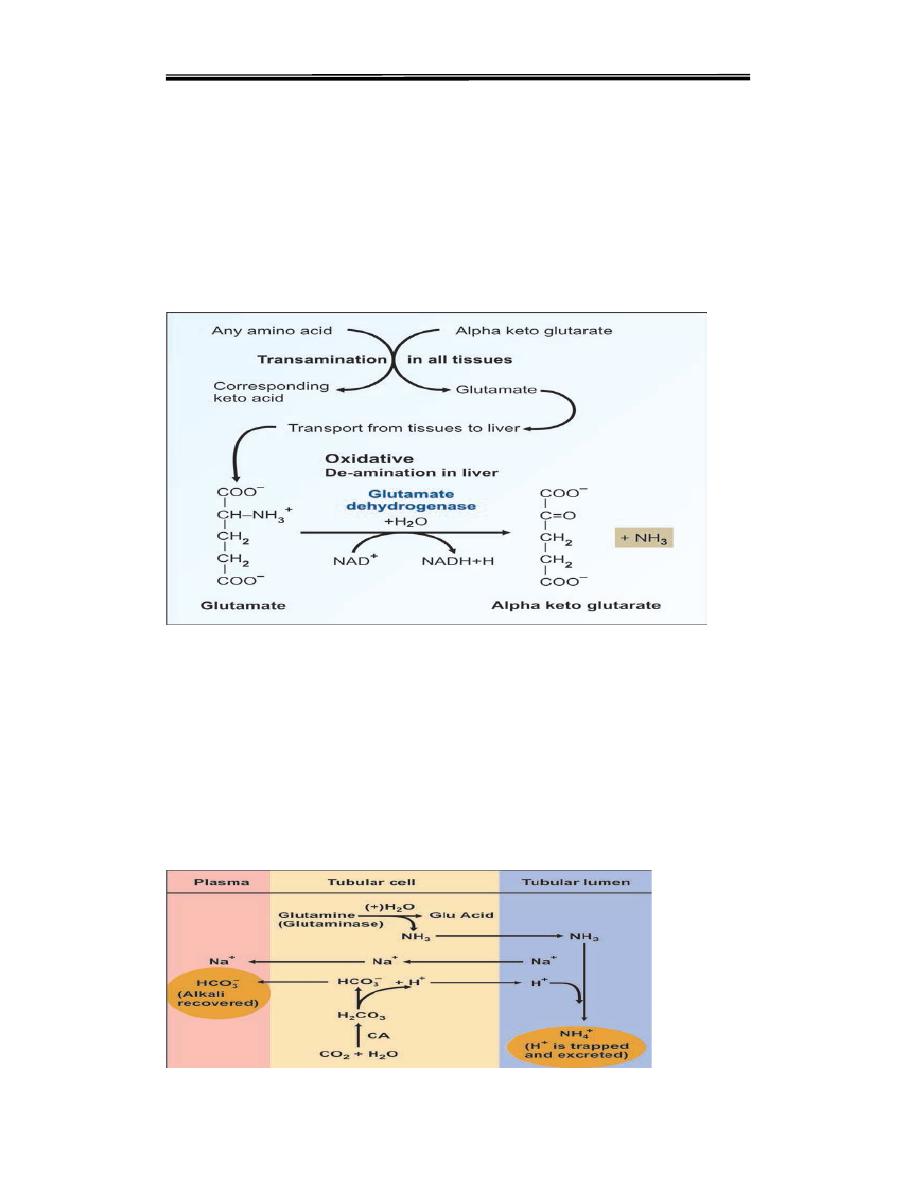
Inside the cells of almost all tissues, the transamination of amino acids
produce glutamic acid. However, glutamate dehydrogenase is available
only in the liver. Therefore, the final deamination and production of
ammonia is taking place in the liver (Fig. 3). Thus, glutamic acid acts as
the link between amino groups of amino acids and ammonia. The
concentration of glutamic acid in blood is 10 times more than other amino
acids.Glutamine is the transport forms of ammonia from brain and
intestine to liver; while alanine is the transport form from muscle
Fig. 3
oxidative deamination
3. Final disposal
The ammonia from all over the body thus reaches liver. It is then
detoxified to urea by liver cells,and then excreted through kidneys.
Urea is the endproduct of protein metabolism.
Although Ammonia is toxic and has to be immediately detoxified, in kidney
cells, ammonia is purposely generated from glutamine with the help of
glutaminase. This is for buffering the acids, and maintaining acid-base
balance (see Fig. 4).
Figure 4. Ammonia as buffer
Clinical biochemistry second stage lecture 3 Dr.Thana Alsewedy
3
UREA CYCLE
The two nitrogen atoms of urea are derived from two different sources,
one from ammonia and the other directly from the alpha amino group of
aspartic acid. Steps of urea cycle are the following
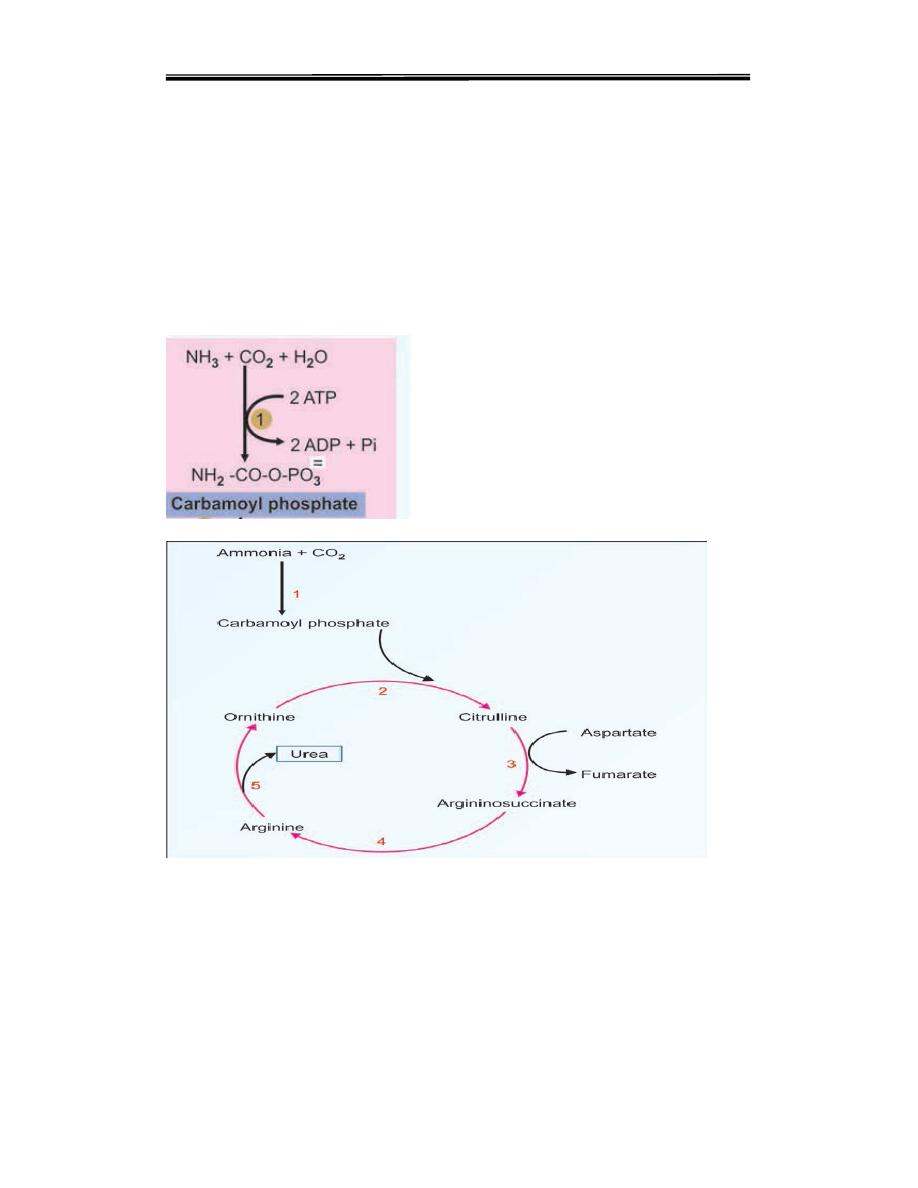
Step 1. Formation of Carbamoyl Phosphate
One molecule of ammonia condenses with CO2 in the presence of two
molecules of ATP to form carbamoyl phosphate. The reaction is
catalysed by the mitochondrial enzyme carbamoyl phosphate
synthetase-I (CPS-I).. CPS-I reaction is the rate-limiting step in urea
formation. It is irreversible and allosterically regulated.
Figure 5 .Urea cycle, summary. Note that aspartate enters and fumarate leaves at
different steps.
Step 2. Formation of Citrulline
The second reaction is also mitochondrial. The carbamoyl group is
transferred to the NH2 group of ornithine by ornithin transcarbamoylase
(OTC) and produce citrulline The citrulline leaves the mitochondria and
further reactions are taking place in cytoplasm. Citrulline is neither present
in tissue proteins nor in blood; but it is present in milk.
Clinical biochemistry second stage lecture 3 Dr.Thana Alsewedy
4
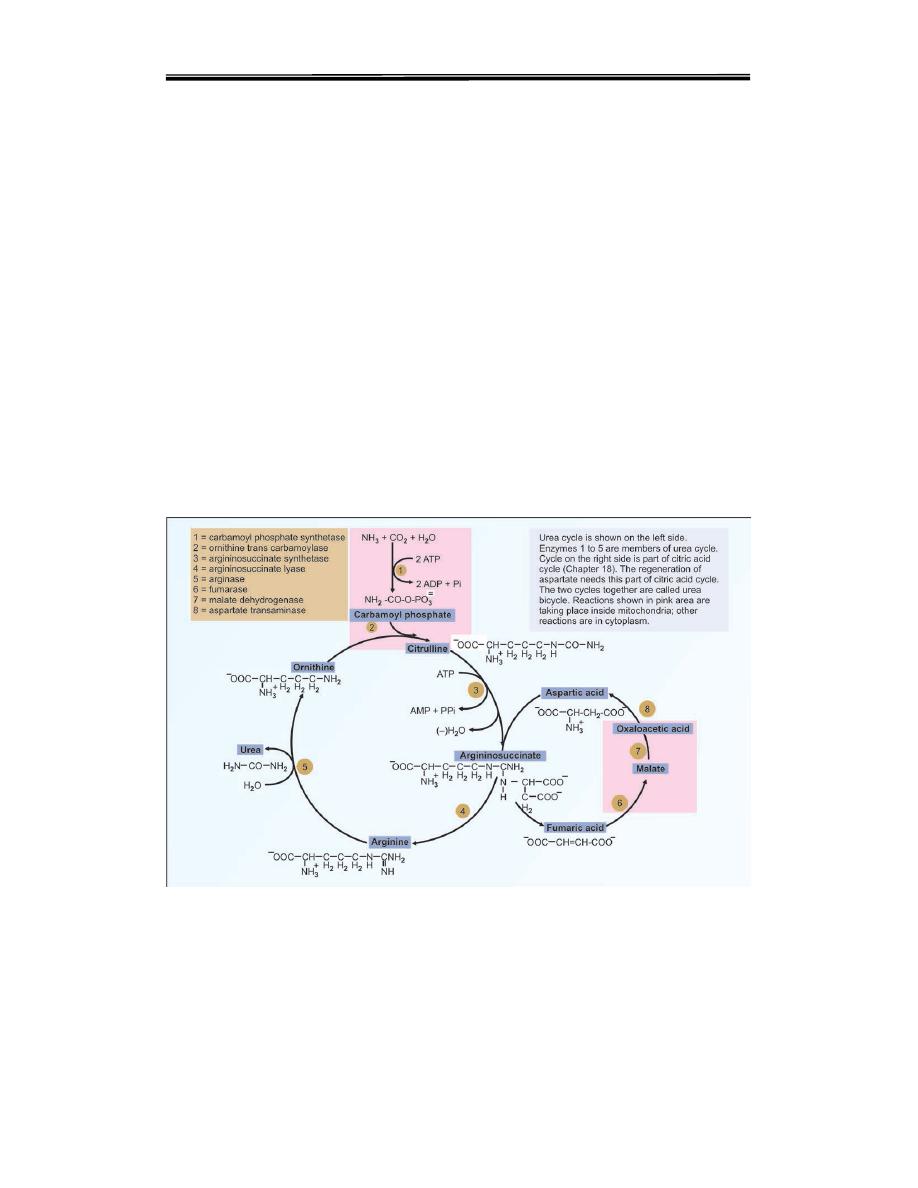
Step 3. Formation of Argininosuccinate
One molecule of aspartic acid adds to citrulline forming a carbon to
nitrogen bond which provides the 2nd nitrogen atom of urea.
Argininosuccinate synthetase catalyses the reaction (Figs 6 step 3). This
needs hydrolysis of ATP to AMP level, so two high energy phosphate
bonds are utilized. The PPi is an inhibitor of this step.
Step 4. Formation of Arginine
Argininosuccinate
is
cleaved
by
argininosuccinatelyase
(argininosuccinase) to arginine and fumarate(Figs 6, step 4). The enzyme
is inhibited by fumarate. But this is avoided by the cytoplasmic
localization of the enzyme. The fumarate formed may be funnelled into
TCA cycle to be converted to malate and then to oxaloacetate to be
transaminated to aspartate (Fig. 6). Thus the urea cycle is linked to TCA
cycle through fumarate. The 3rd and 4th steps taken together maybe
summarized as:
Citrulline + aspartate → Arginine + fumarate
Figure 6 .Urea cycle and its relation with citric acid cycle
Step 5. Formation of Urea
The final reaction of the cycle is the hydrolysis of arginine to urea and
ornithine by arginase (Fig. 6 .step 5). The ornithine returns to the

Clinical biochemistry second stage lecture 3 Dr.Thana Alsewedy
5
mitochondria to react with another molecule of carbamoyl phosphate so
that the cycle will proceed.Thus, ornithine may be considered as a
catalyst which enters the reaction and is regenerated.
Energetics of Urea Cycle
The overall reaction may be summarized as:
NH3 + CO2 + Aspartate → Urea + fumarate
During these reactions, 2 ATPs are used in the1st reaction. Another ATP
is converted to AMP +PPi in the 3rd step, which is equivalent to 2
ATPs.The urea cycle consumes 4 high energy phosphatebonds.
However, fumarate formed in the4th step may be converted to malate.
Malate when oxidised to oxaloacetate produces 1 NADH equivalent to
2.5 ATP. So net energy expenditureis only 1.5 high energy
phosphates. The ureacycle and TCA cycle are interlinked, and so, it is
called as "urea bicycle"
.
Regulation of the Urea Cycle
1. Coarse Regulation
The enzyme levels change with the protein content of diet. During
starvation, the activity of urea cycle enzymes is elevated to meet the
increased rate of protein catabolism.
2. Fine Regulation
The major regulatory step is catalyzed by CPS-I where the positive
effector is N-acetyl glutamate(NAG). It is formed from glutamate and
acetyl CoA(Fig. 7). Arginine is an activator of NAG synthase.
Fig. 7
NAG synthesis and breakdown
3. Compartmentalization
The urea cycle enzymes are located in such a way that the first two
enzymes are in the mitochondria matrix. The inhibitory effect of
fumarate
on
its
own
formation
is
minimized
because
argininosuccinatelyase is in the cytoplasm, while fumarase is
mitochondria .

Clinical biochemistry second stage lecture 3 Dr.Thana Alsewedy
6
Disorders of Urea Cycle
A urea cycle disorder is a genetic disorder caused by a mutation that
results in a deficiency of one of the enzymes in the urea cycle. These
enzymes are responsible for removing ammonia from the blood stream.
Severe
deficiency or total absence of activity of any of the first four
enzymes (CPS1, OTC, ASS, ASL) in the urea cycle or the cofactor
producer (NAGS) results in the accumulation of ammonia
(hyperammonemia) and other precursor metabolites during the first few
days of life. When the block is in one of the earlier steps, the condition is
more severe ,since ammonia itself accumulates. Deficiencies of later
enzymes result in the accumulation of other intermediates which are less
toxic and hence symptoms are less. As a general description,disorders of
urea cycle are characterized by hyperammonemia, encephalopathy and
respiratory alkalosis. Clinical symptoms include vomiting, irritability,
lethargy and severe mental retardation. Infants appear normal at birth, but
within days progressive lethargy sets in. Metabolic stress ors -- viruses,
high protein intake, excessive exercise or dieting, surgery, or a drug as
prednisone or other corticosteroid -- can create excessive ammonia in the
body resulting in severe neurological symptoms. Treatment is more or
less similar in the different types of disorders. Low protein diet with
sufficient arginine and energy by frequent feeding can minimize brain
damage since ammonia levels do not increase very high results in toxic
symptoms.
Brain is very sensitive to ammonia. glutamate and γ-
aminobutyrateGABA play a role in ammonia-induced toxicity .ammonia
entering the brain by diffusion across the blood-brain barrier and to
incorporate this ammonia into glutamine. production of glutamine
producing an osmotic stress in brain cell and also decrease the availability
of
ketoglutaratre for citric acid cycle so decrease the level of ATP as
sourse of energy in brain. Different urea cycle disorders are shown in
following Table
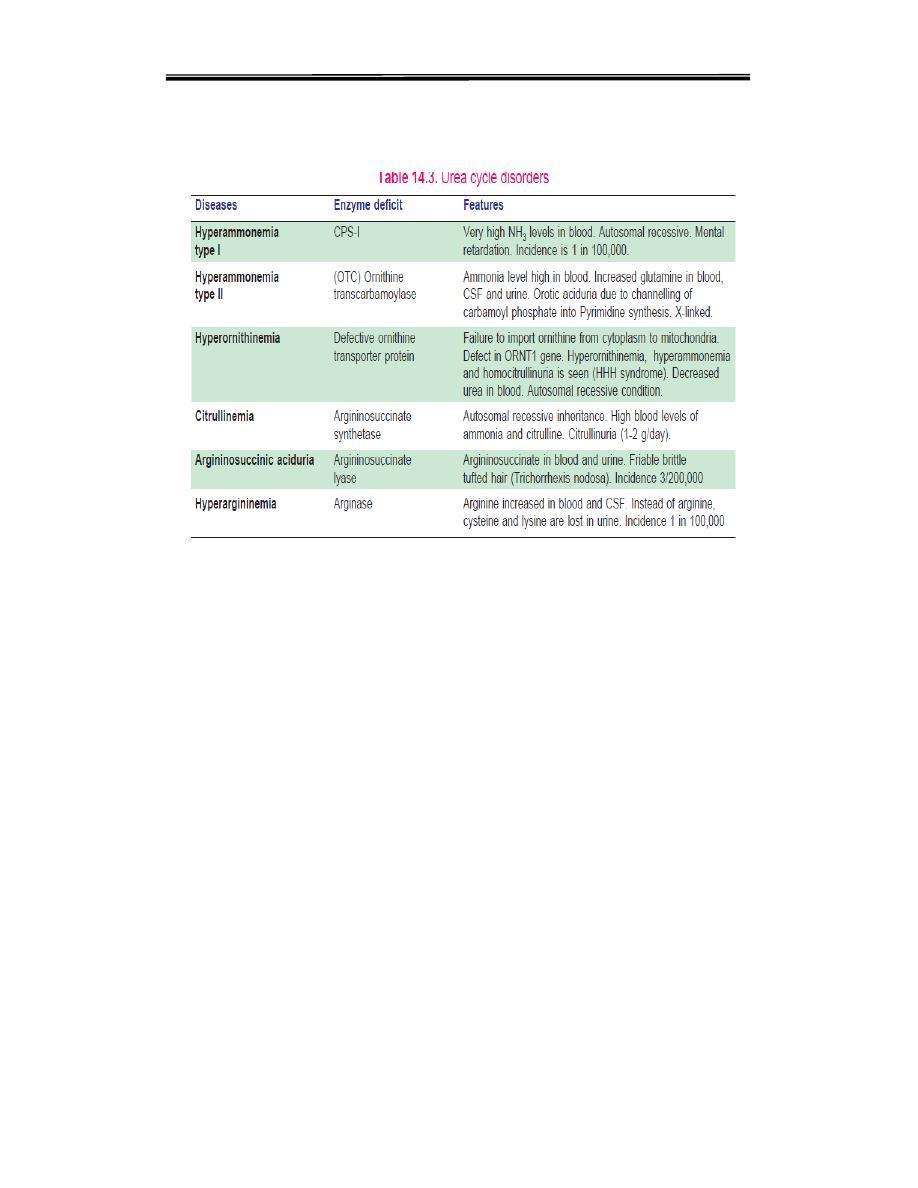
Clinical biochemistry second stage lecture 3 Dr.Thana Alsewedy
7
.
Urea Cycle Disorders:
Since Citrulline is present in significant quantities in milk, breast milk is
to be avoided in citrullinemia
Hepatic Coma (Acquired Hyperammonemia)
In diseases of the liver, hepatic failure can finally lead to hepatic coma
and death. Hyperammonemia is the characteristic feature of liver failure.
The condition is also known as portal systemic encephalopathy. Normally
the ammonia and other toxic compounds produced by intestinal bacterial
metabolism are transported to liver by portal circulation and detoxified by
the liver. But when there is portal systemic shunting of blood, the toxins
bypass the liver and their concentration in systemic circulation rises.The
signs and symptoms are mainly pertaining to CNS dysfunction (altered
sensorium, convulsions), withholding hepatotoxic drugs and maintenance
of electrolyte and acid base balance are the main lines of management.
