
10/3/2012
1
Atoms, Molecules and Ions
Chapter 2
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Dalton’s Atomic Theory (1808)
1. Elements are composed of extremely small particles
called atoms.
2. All atoms of a given element are identical, having the
same size, mass and chemical properties. The atoms of
one element are different from the atoms of all other
elements.
3. Compounds are composed of atoms of more than one
element. In any compound, the ratio of the numbers of
atoms of any two of the elements present is either an
integer or a simple fraction.
4. A chemical reaction involves only the separation,
combination, or rearrangement of atoms; it does not
result in their creation or destruction.
2.1
2
2.1
Dalton’s Atomic Theory
8 X
2
Y
16 X
8 Y
+
2.1
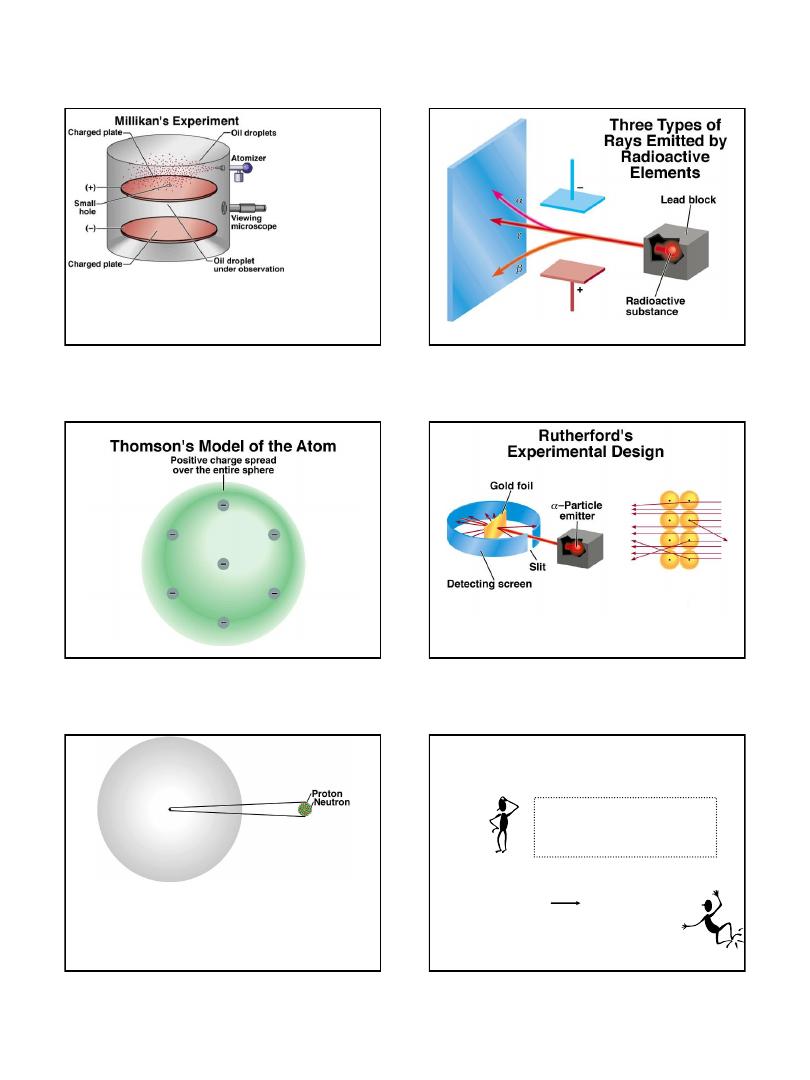
J.J. Thomson,
measured mass/charge of e
-
(1906 Nobel Prize in Physics)
2.2
Cathode Ray Tube
2.2
10/3/2012
2
e
-
charge = -1.60 x 10
-19
C
Thomson’s charge/mass of e
-
= -1.76 x 10
8
C/g
e
-
mass = 9.10 x 10
-28
g
Measured mass of e
-
(1923 Nobel Prize in Physics)
2.2
(Uranium compound)
2.2
2.2
1. atoms positive charge is concentrated in the nucleus
2. proton (p) has opposite (+) charge of electron (-)
3. mass of p is 1840 x mass of e
-
(1.67 x 10
-24
g)
particle velocity ~ 1.4 x 10
7
m/s
(~5% speed of light)
(1908 Nobel Prize in Chemistry)
2.2
atomic radius ~ 100 pm = 1 x 10
-10
m
nuclear radius ~ 5 x 10
-3
pm = 5 x 10
-15
m
Rutherford’s Model of
the Atom
2.2
“If the atom is the Houston Astrodome, then
the nucleus is a marble on the 50-
yard line.”
Chadwick’s Experiment (1932)
(1935 Noble Prize in Physics)
H atoms - 1 p; He atoms - 2 p
mass He/mass H should = 2
measured mass He/mass H = 4
+
9
Be
1
n +
12
C + energy
neutron (n) is neutral (charge = 0)
n mass ~ p mass = 1.67 x 10
-24
g
2.2

10/3/2012
3
mass p = mass n = 1840 x mass e
-
2.2
Atomic number (Z) = number of protons in nucleus
Mass number (A) = number of protons + number of neutrons
= atomic number (Z) + number of neutrons
Isotopes are atoms of the same element (X) with different
numbers of neutrons in their nuclei
X
A
Z
H
1
1
H (D)
2
1
H (T)
3
1
U
235
92
U
238
92
Mass Number
Atomic Number
Element Symbol
2.3
Atomic number, Mass number and Isotopes
2.3
The Isotopes of Hydrogen
6 protons, 8 (14 - 6) neutrons, 6 electrons
6 protons, 5 (11 - 6) neutrons, 6 electrons
Do You Understand Isotopes?
2.3
How many protons, neutrons, and electrons are in C
14
6
?
How many protons, neutrons, and electrons are in C
11
6
?
Period
Gr
o
u
p
A
lk
a
li
Met
a
l
N
o
b
le
Ga
s
H
a
log
e
n
A
lk
a
li
E
a
rth
Met
a
l
2.4
Chemistry In Action
Natural abundance of elements in Earth’s crust
Natural abundance of elements in human body
2.4

10/3/2012
4
A molecule is an aggregate of two or more atoms in a
definite arrangement held together by chemical forces
H
2
H
2
O
NH
3
CH
4
A diatomic molecule contains only two atoms
H
2
, N
2
, O
2
, Br
2
, HCl, CO
A polyatomic molecule contains more than two atoms
O
3
, H
2
O, NH
3
, CH
4
2.5
An ion is an atom, or group of atoms, that has a net
positive or negative charge.
cation
– ion with a positive charge
If a neutral atom loses one or more electrons
it becomes a cation.
anion
– ion with a negative charge
If a neutral atom gains one or more electrons
it becomes an anion.
Na
11 protons
11 electrons
Na
+
11 protons
10 electrons
Cl
17 protons
17 electrons
Cl
-
17 protons
18 electrons
2.5
A monatomic ion contains only one atom
A polyatomic ion contains more than one atom
2.5
Na
+
, Cl
-
, Ca
2+
, O
2-
, Al
3+
, N
3-
OH
-
, CN
-
, NH
4
+
, NO
3
-
13 protons, 10 (13
– 3) electrons
34 protons, 36 (34 + 2) electrons
Do You Understand Ions?
2.5
How many protons and electrons are in ?
Al
27
13
3+
How many protons and electrons are in ?
Se
78
34
2-
2.5
2.6

10/3/2012
5
A molecular formula shows the exact number of
atoms of each element in the smallest unit of a
substance
An empirical formula shows the simplest
whole-number ratio of the atoms in a substance
H
2
O
H
2
O
molecular
empirical
C
6
H
12
O
6
CH
2
O
O
3
O
N
2
H
4
NH
2
2.6
ionic compounds consist of a combination of cations
and an anions
• the formula is always the same as the empirical formula
• the sum of the charges on the cation(s) and anion(s) in each
formula unit must equal zero
The ionic compound NaCl
2.6
Formula of Ionic Compounds
Al
2
O
3
2.6
2 x +3 = +6
3 x -2 = -6
Al
3+
O
2-
CaBr
2
1 x +2 = +2
2 x -1 = -2
Ca
2+
Br
-
Na
2
CO
3
1 x +2 = +2
1 x -2 = -2
Na
+
CO
3
2-
2.7
2.7
Chemical Nomenclature
• Ionic Compounds
– often a metal + nonmetal
– anion (nonmetal), add “ide” to element name
BaCl
2
barium chloride
K
2
O
potassium oxide
Mg(OH)
2
magnesium hydroxide
KNO
3
potassium nitrate
2.7

10/3/2012
6
• Transition metal ionic compounds
– indicate charge on metal with Roman numerals
FeCl
2
2 Cl
-
-2 so Fe is +2
iron(II) chloride
FeCl
3
3 Cl
-
-3 so Fe is +3
iron(III) chloride
Cr
2
S
3
3 S
-2
-6 so Cr is +3 (6/2) chromium(III) sulfide
2.7
• Molecular compounds
• nonmetals or nonmetals + metalloids
• common names
• H
2
O, NH
3
, CH
4
, C
60
• element further left in periodic table
is 1
st
• element closest to bottom of group is
1
st
• if more than one compound can be
formed from the same elements, use
prefixes to indicate number of each
kind of atom
• last element ends in ide
2.7
HI
hydrogen iodide
NF
3
nitrogen trifluoride
SO
2
sulfur dioxide
N
2
Cl
4
dinitrogen tetrachloride
NO
2
nitrogen dioxide
N
2
O
dinitrogen monoxide
Molecular Compounds
2.7
TOXIC!
Laughing Gas
2.7
An acid can be defined as a substance that yields
hydrogen ions (H
+
) when dissolved in water.
HCl
•Pure substance, hydrogen chloride
•Dissolved in water (H
+
Cl
-
), hydrochloric acid
An oxoacid is an acid that contains hydrogen,
oxygen, and another element.
HNO
3
nitric acid
H
2
CO
3
carbonic acid
H
2
SO
4
sulfuric acid
2.7
HNO
3
2.7

10/3/2012
7
2.7
2.7
A base can be defined as a substance that yields
hydroxide ions (OH
-
) when dissolved in water.
NaOH
sodium hydroxide
KOH
potassium hydroxide
Ba(OH)
2
barium hydroxide
2.7
Hydrates are compounds that have a specific
number of water molecules attached to them.
BaCl
2
•2H
2
O
2.7
LiCl
•H
2
O
MgSO
4
•7H
2
O
Sr(NO
3
)
2
•4H
2
O
barium chloride dihydrate
lithium chloride monohydrate
magnesium sulfate heptahydrate
strontium nitrate tetrahydrate
CuSO
4
•5H2O
CuSO4
2.7
Organic chemistry is the branch of chemistry that
deals with carbon compounds
C
H
H
H
OH
C
H
H
H
NH
2
C
H
H
H
C
OH
O
methanol
methylamine
acetic acid
2.7
Functional Groups
