
10/31/2012
1
Mass Relationships in
Chemical Reactions
Chapter 3
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
By definition:
1 atom
12
C “weighs” 12 amu
On this scale
1
H = 1.008 amu
16
O = 16.00 amu
Atomic mass is the mass of an atom in
atomic mass units (amu)
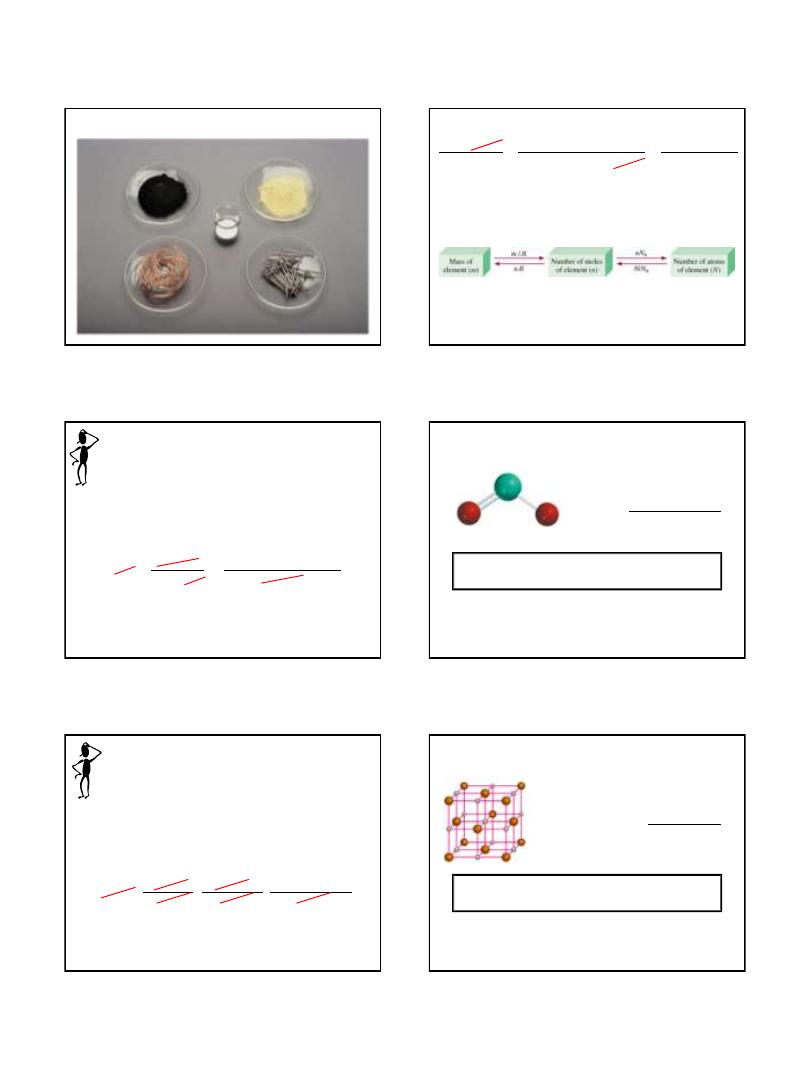
Micro World
atoms & molecules
Macro World
grams
3.1
Natural lithium is:
7.42%
6
Li (6.015 amu)
92.58%
7
Li (7.016 amu)
7.42 x 6.015 + 92.58 x 7.016
100
= 6.941 amu
3.1
Average atomic mass of lithium:
Average atomic mass (6.941)
The mole (mol) is the amount of a substance that
contains as many elementary entities as there
are atoms in exactly 12.00 grams of
12
C
3.2
1 mol = N
A
= 6.0221367 x 10
23
Avogadro’s number (N
A
)
Molar mass is the mass of 1 mole of in grams
eggs
shoes
marbles
atoms
1 mole
12
C atoms = 6.022 x 10
23
atoms = 12.00 g
1
12
C atom = 12.00 amu
1 mole
12
C atoms = 12.00 g
12
C
1 mole lithium atoms = 6.941 g of Li
For any element
atomic mass (amu) = molar mass (grams)
3.2
10/31/2012
2
One Mole of:
C
S
Cu
Fe
Hg
3.2
1 amu = 1.66 x 10
-24
g or 1 g = 6.022 x 10
23
amu
1
12
C atom
12.00 amu
x
12.00 g
6.022 x 10
23
12
C atoms
=
1.66 x 10
-24
g
1 amu
3.2
M = molar mass in g/mol
N
A
= Avogadro’s number
x
6.022 x 10
23
atoms K
1 mol K
=
Do You Understand Molar Mass?
How many atoms are in 0.551 g of potassium (K) ?
1 mol K = 39.10 g K
1 mol K = 6.022 x 10
23
atoms K
0.551 g K
1 mol K
39.10 g K
x
8.49 x 10
21
atoms K
3.2
Molecular mass (or molecular weight) is the sum of
the atomic masses (in amu) in a molecule.
SO
2
1S
32.07 amu
2O
+ 2 x 16.00 amu
SO
2
64.07 amu
For any molecule
molecular mass (amu) = molar mass (grams)
1 molecule SO
2
= 64.07 amu
1 mole SO
2
= 64.07 g SO
2
3.3
Do You Understand Molecular Mass?
How many H atoms are in 72.5 g of C
3
H
8
O ?
1 mol C
3
H
8
O = (3 x 12) + (8 x 1) + 16 = 60 g C
3
H
8
O
1 mol H = 6.022 x 10
23
atoms H
5.82 x 10
24
atoms H
3.3
1 mol C
3
H
8
O molecules = 8 mol H atoms
72.5 g C
3
H
8
O
1 mol C
3
H
8
O
60 g C
3
H
8
O
x
8 mol H atoms
1 mol C
3
H
8
O
x
6.022 x 10
23
H atoms
1 mol H atoms
x
=
Formula mass is the sum of the atomic masses
(in amu) in a formula unit of an ionic compound.
1Na
22.99 amu
1Cl
+ 35.45 amu
NaCl
58.44 amu
For any ionic compound
formula mass (amu) = molar mass (grams)
1 formula unit NaCl = 58.44 amu
1 mole NaCl = 58.44 g NaCl
3.3
NaCl
10/31/2012
3
Do You Understand Formula Mass?
What is the formula mass of Ca
3
(PO
4
)
2
?
3.3
1 formula unit of Ca
3
(PO
4
)
2
3 Ca
3 x 40.08
2 P
2 x 30.97
8 O
+ 8 x 16.00
310.18 amu
KE = 1/2 x m x v
2
v = (2 x KE/m)
1/2
F = q x v x B
3.4
Lig
ht
Lig
ht
Hea
v
y
Hea
v
y
Percent composition of an element in a compound =
n
x molar mass of element
molar mass of compound
x 100%
n
is the number of moles of the element in
1 mole
of the compound
C
2
H
6
O
%C =
2
x (12.01 g)
46.07 g
x 100% = 52.14%
%H =
6
x (1.008 g)
46.07 g
x 100% = 13.13%
%O =
1
x (16.00 g)
46.07 g
x 100% = 34.73%
52.14% + 13.13% + 34.73% = 100.0%
3.5
3.5
Percent Composition and Empirical Formulas
Determine the empirical formula of a
compound that has the following
percent composition by mass:
K 24.75, Mn 34.77, O 40.51 percent.
n
K
= 24.75 g K x
= 0.6330 mol K
1 mol K
39.10 g K
n
Mn
= 34.77 g Mn x
= 0.6329 mol Mn
1 mol Mn
54.94 g Mn
n
O
= 40.51 g O x
= 2.532 mol O
1 mol O
16.00 g O
3.5
Percent Composition and Empirical Formulas
K :
~
~ 1.0
0.6330
0.6329
Mn :
0.6329
0.6329
= 1.0
O :
~
~ 4.0
2.532
0.6329
n
K
= 0.6330, n
Mn
= 0.6329, n
O
= 2.532
KMnO
4
3.6
g CO
2
mol CO
2
mol C
g C
g H
2
O
mol H
2
O
mol H
g H
g of O = g of sample
– (g of C + g of H)
Combust 11.5 g ethanol
Collect 22.0 g CO
2
and 13.5 g H
2
O
6.0 g C = 0.5 mol C
1.5 g H = 1.5 mol H
4.0 g O = 0.25 mol O
Empirical formula C
0.5
H
1.5
O
0.25
Divide by smallest subscript (0.25)
Empirical formula C
2
H
6
O

10/31/2012
4
3.7
3 ways of representing the reaction of H
2
with O
2
to form H
2
O
A process in which one or more substances is changed into one
or more new substances is a chemical reaction
A chemical equation uses chemical symbols to show what
happens during a chemical reaction
reactants
products
How to “Read” Chemical Equations
2 Mg + O
2
2 MgO
2 atoms Mg + 1 molecule O
2
makes 2 formula units MgO
2 moles Mg + 1 mole O
2
makes 2 moles MgO
48.6 grams Mg + 32.0 grams O
2
makes 80.6 g MgO
IS NOT
2 grams Mg + 1 gram O
2
makes 2 g MgO
3.7
Balancing Chemical Equations
1. Write the correct formula(s) for the reactants on
the left side and the correct formula(s) for the
product(s) on the right side of the equation.
Ethane reacts with oxygen to form carbon dioxide and water
C
2
H
6
+ O
2
CO
2
+ H
2
O
2. Change the numbers in front of the formulas
(coefficients) to make the number of atoms of
each element the same on both sides of the
equation. Do not change the subscripts.
3.7
2C
2
H
6
NOT
C
4
H
12
Balancing Chemical Equations
3. Start by balancing those elements that appear in
only one reactant and one product.
C
2
H
6
+ O
2
CO
2
+ H
2
O
3.7
start with C or H but not O
2 carbon
on left
1 carbon
on right
multiply CO
2
by
2
C
2
H
6
+ O
2
2
CO
2
+ H
2
O
6 hydrogen
on left
2 hydrogen
on right
multiply H
2
O by
3
C
2
H
6
+ O
2
2
CO
2
+
3
H
2
O
Balancing Chemical Equations
4. Balance those elements that appear in two or
more reactants or products.
3.7
2 oxygen
on left
4 oxygen
(2x2)
C
2
H
6
+ O
2
2
CO
2
+
3
H
2
O
+ 3 oxygen
(3x1)
multiply O
2
by
7
2
= 7 oxygen
on right
C
2
H
6
+ O
2
2
CO
2
+
3
H
2
O
7
2
remove fraction
multiply both sides by
2
2
C
2
H
6
+
7
O
2
4
CO
2
+
6
H
2
O
Balancing Chemical Equations
5. Check to make sure that you have the same
number of each type of atom on both sides of the
equation.
3.7
2
C
2
H
6
+
7
O
2
4
CO
2
+
6
H
2
O
Reactants
Products
4 C
12 H
14 O
4 C
12 H
14 O
4 C (
2
x 2)
4 C
12 H (
2
x 6)
12 H (
6
x 2)
14 O (
7
x 2)
14 O (
4
x 2 +
6
)

10/31/2012
5
1. Write balanced chemical equation
2. Convert quantities of known substances into moles
3. Use coefficients in balanced equation to calculate the
number of moles of the sought quantity
4. Convert moles of sought quantity into desired units
Amounts of Reactants and Products
3.8
Methanol burns in air according to the equation
2CH
3
OH + 3O
2
2CO
2
+ 4H
2
O
If 209 g of methanol are used up in the combustion,
what mass of water is produced?
grams CH
3
OH
moles CH
3
OH
moles H
2
O
grams H
2
O
molar mass
CH
3
OH
coefficients
chemical equation
molar mass
H
2
O
209 g CH
3
OH
1 mol CH
3
OH
32.0 g CH
3
OH
x
4 mol H
2
O
2 mol CH
3
OH
x
18.0 g H
2
O
1 mol H
2
O
x
=
235 g H
2
O
3.8
Limiting Reagents
3.9
2NO + 2O
2
2NO
2
NO is the limiting reagent
O
2
is the excess reagent
Do You Understand Limiting Reagents?
In one process, 124 g of Al are reacted with 601 g of Fe
2
O
3
2Al + Fe
2
O
3
Al
2
O
3
+ 2Fe
Calculate the mass of Al
2
O
3
formed.
g Al
mol Al
mol Fe
2
O
3
needed
g Fe
2
O
3
needed
OR
g Fe
2
O
3
mol Fe
2
O
3
mol Al needed
g Al needed
124 g Al
1 mol Al
27.0 g Al
x
1 mol Fe
2
O
3
2 mol Al
x
160. g Fe
2
O
3
1 mol Fe
2
O
3
x
= 367 g Fe
2
O
3
Start with 124 g Al
need 367 g Fe
2
O
3
Have more Fe
2
O
3
(601 g) so Al is limiting reagent
3.9
Use limiting reagent (Al) to calculate amount of product that
can be formed.
g Al
mol Al
mol Al
2
O
3
g Al
2
O
3
124 g Al
1 mol Al
27.0 g Al
x
1 mol Al
2
O
3
2 mol Al
x
102. g Al
2
O
3
1 mol Al
2
O
3
x
= 234 g Al
2
O
3
2Al + Fe
2
O
3
Al
2
O
3
+ 2Fe
3.9
Theoretical Yield is the amount of product that would
result if all the limiting reagent reacted.
Actual Yield is the amount of product actually obtained
from a reaction.
% Yield =
Actual Yield
Theoretical Yield
x 100
3.10
Reaction Yield

10/31/2012
6
Chemistry In Action: Chemical Fertilizers
Plants need: N, P, K, Ca, S, & Mg
3H
2
(g) + N
2
(g) 2NH
3
(g)
NH
3
(aq) + HNO
3
(aq) NH
4
NO
3
(aq)
2Ca
5
(PO
4
)
3
F (s) + 7H
2
SO
4
(aq)
3Ca(H
2
PO
4
)
2
(aq) + 7CaSO
4
(aq) + 2HF (g)
fluorapatite
