
م
إ إ ي ط د أ
م. ةا م م ح
2015
لمحقول
J j S
>i (j
f

م ا ح
ا إل ب د ا ع
س مي ا ء
ة
ص ل ب ل
ا
*
j
ل« ل
(
The Millimol (mmole
mol = 10* mmol
١
كما
م ز
معنا
س ا ب ق أ
ف ي
مادة
كيمياء
101
فإ ن
و حدة
ا ل
؛(
m ill
)
ت س ت خ د م
للتعبير
عن
(
1/1000
)
من
المادة
لت سهيل
التعامل
م ع
ا أل ر ق ا م
ا ل م غ ي ر ة
ئلموالت
.
Exam ple
:
122.1
=
H ow m any m©les and m illim oles o f benzoic acid
(M
g/m o) are contained in 2.00 g o f the pure a c id
?
كم
عدن
مو ال ت
و
مل
مو ال ت
م ذ
.
ال ب ن ز و ي ك
)<؛
آأآ/ ج
ا
.
122
=
"
M w
م و ج ود
ف ي
(
2
g
)
م ن
هذا
الحم ض
التقي
؟
:
Solution
ش ة
م
(
P u re
)
تدل
ط ى
ان
الوزن
المعطى
ف ي
هذا
السؤال
(
2
g
)
يتق و ن
ص
حم ض
البنزويك
فق ط
.
m = 2 g
Mw = 122.1 g/mol
ع ق ت ا ح
ا إل ب د ا ع
ء
ه ا
س
ا ل ت ع ل ه ل م ة
ولتحويله
إلى
س ص
0.0164 m p l 'x '10
irtm0l=16.4 mmol
ر'
I mol
هذه
الطريقة
مر ت
معنا
بالتف صيل
ف ي
كتا ب
مفتا ح
اإلبداع
ل ك ي م ي ا
.
الوحدة
األولى
يمي
—
ا
ء
101
ا ل ن س ة
ال ط و ي ة
ل م
محات
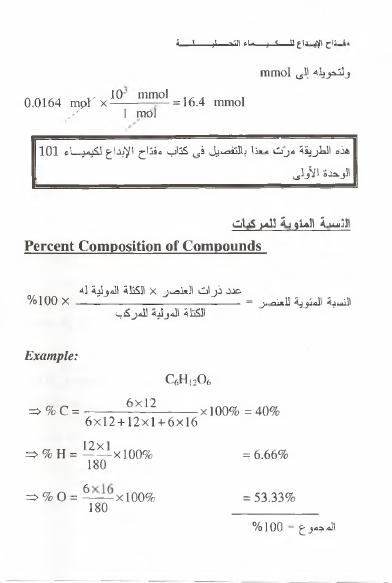
Percent Composition of Compounds
الكتلة
المولية
ل ه
X
عدد
ذرا ت
العنصر
ه ه ا
0
ا
° X
=
ال شب ة
الموئية
ل ل ض م
الكظة
المولية
للمركب
'
'
Example:
م صا ال ه ء
= > % c = -
- 6x12
Xl00% = 40%
6x12 + 12x1 + 6x16
6.66%
=
0%
ع%
^ = ه ا ة ق
180
53.33%
=
v
؛
%
0
=
6
—
-
xl009
=<
180
المجموع
“
100
%

س ا ح
اإلبداع
مس ا ء
ل
ة
غ
ص ي
٠
إذا
لم
يكن
م ج م و ع
ا ك ب
الموئية
ث ن م ن م ر
ال م ك و ن ة
ل ل م ن ك ب
ت س ا و ي
100
،%
ف ه ذا
يدل
عل ى
وجون
خ طأ
بال حد
.
Example:
Calculate the mass percent o f oxygen in N a3P 0 4
(M .m = 164g/m ol)
a) 38.1
b) 52.6
c) 45.1
ر
ت
م. و
ره
e) 32.4
Solution:
mass percent o f O = ق ي ث يx l0 0 %
164
Example:
Calculate the mass percent of oxygen in nitrobenzene,
(At.wts. C = 12.0, H = 1.00, N = 14.0, 16.0 = ) ه
|a)26.0%|
11.4 (
٠
%
إ
.
32
(
ط
%
d) 4.07%
e)
58.5%
Solution:
% 0 _ (6 x l2 + 5 x l + lx l 4 + 2 x l 6 ) ><100/c
26%
=
100
%
ة
=
123

٠
ن سن طي ع
ي جاد
كتلة
أي
عن صر
بالمرك ب
إذا
ت و ف ر ت
ل د ي ن ا
ك ت ل ة
ذ ل ك
ال م ر ك ب
و ا ل م ي ع ة
الكيميائية
له
.
كنثة
العن ص ر
=
النسبة
المثوبة
للعنتصر
X
كتل ة
المر
ك ب
م ف ت ا ح
ا إل ب د ا ع
مي ا ء
ل ل ق
ح ل ه ل ة
ا ل ت
Example:
Calculate mass o f carbon in 0 .1 7 6 g o f C2H60 i?
احسب
كتلة
الكربون
الموجودة
ف ي
ج
0.176
عن
ت م
6
ي أ
2
ء
؟
Solution:
% c =
2 x 1 2
Xl00% = 38.7%
2 x 1 2 + 6x1 + 2 x 1 6
ء
0.068
=
0.176
ح ت ق ق
=
؛?،,.
=<
'
100
Example:
What mass o f chromium (Mr 52.00) is required to
prepare lOO.Og
0f K 2Cr2O7 (Mr 294.0)?
|a) 35.37 I
b) 70.70
c) 106.1
53.03
(ه
e) 17.68

Solution:
M ass percent o f Cr in K 2Cr2C l7
35.37%
=
100%
ق
ة
=
Mass ofC r in 100s ©f
= —
x l0 0 = 3 5 .3 7 s
ب
٥٥١
‘
"
Exam ple:
How many grams o f Na+ (22.99 g/mol) are contained in
25.0 g o f N a2S 0 4 (142.0 g/mol)?
25.0) م نg)
م و ج و د
ف ي
(M w=22.99 g/mol) N a+
كم
غ را م
من
؟ (M w=142.0 g/mol) Na2S 0 4
Solution:
بما
أن
السؤال
طل ب
ش ا
ح سا ب
و ز ن
ع ن م ر
دا خ ل
م ر ك ب
،
ف ي ج ب
ع ل ي ن ا
ح سا ب
ن سبة
هذه
ال ع ص ر
ف ى
المرك ب
.
%Na+ = 2XMWNa- x l0 0 %
M wNa2S 0 4
%Na+ = 2- 22' — Xl00% = 32.38%
142
م ن ه
ح
ا إل ب د ا ع
مي ا ء
ل ل خ
ة
ح ل ي ل
ا ل ت
يت> m Na+ = % N a+ X m Na SQ

م ف ت ا ح
ا إل ب د ا ع
ء
مب ا
ل ل ت
ة
ح ل ي ل
ا ل ت
المحلول
”
المذيب
+
المذاب
(solute)
(s©lvent)
(solution)
Exam ple:
NaCl(s)
H2° ►
NaCl(aq)
i
م حلول
يتك و ن
م ن
N،iCl
مذاب
بالماء
(:
Hydration
)
هي
عملية
اإلذابة
بواسطة
الماء
كمذيب
(
(.
Solvent
معظم
المواد
ا أليونية
نذو ب
بالماء
.
روغا
€
+
(
N aC l{s) -> N a^q
للوئامعق
مع
المؤلف
0795306216
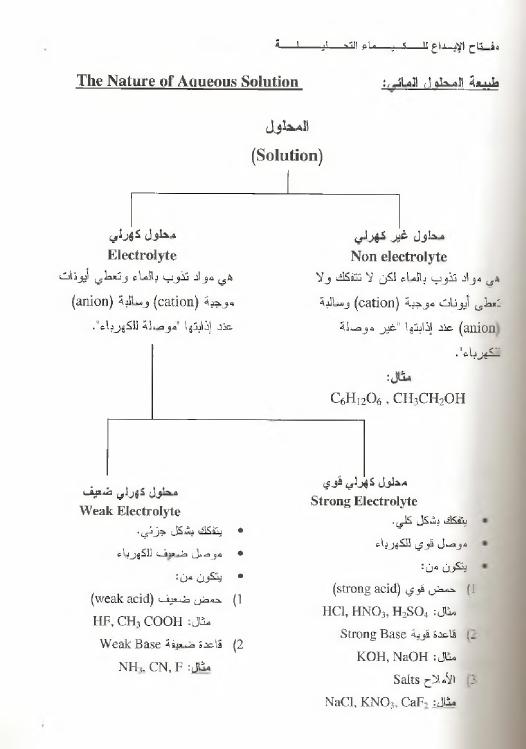
س ة
ا ل ذ ل
ال ما ر
:
The Nature of Aqueous Solution
م ف ت ا ح
اإلبداع
ء
مب ا
ق
ل ل
ة
مل ه ل
ح
ا ل ت
المحلول
(Solution)
I
م حل و ل
غ ي د
ك ه رل ي
N on electrolyte
ي ى
صواب
تذ و ب
بال ما ء
لكن
ال
تتفكك
و ال
نعطى
أيونا ت
مو جبة
ي
catio n
)
و سالبه
anion
)
عند
إذابتها
غب ر"
مو صلة
ص ال
.
آل م ه م ا أ ط ة
)(
ت ه ة
€
م ط ي ل
ك ه ر ل ي
E lectrolyte
هي
مواد
نذو ب
بالماء
وت ع ط ي
أيونات
مو جبة
(
c a tio n
)
و سالب ه
(
a n io n
)
عند
إذابتها
م و'
معلمة
لل ك ه ربا ء
."
م حل ول
ئ ف د ل ي
قو ي
Strong Electrolyte
يقك ك
بشكل
ص
.
مو ص ل
فوي
لقه رباء
يتكون
من
؛
)؛
ح ض
قوي
(
strong acid
)
شا ل
؛
HC1, H N 0 3, H2S 0 4
I
ا
ق ا د ة
قوبة
Strong Base
ء
:
KOH, NaOH
؛:-
األمالح
Salts
.
N aC l.K N O j, CaF, :J li
م ط و ل
كهرلي
ضعي ف
W eak Electrolyte
٠
ينقكك
بشكل
جزئي
،
٠
م و ص ل
ضعل ف
للك ه ربا
ء
٠
يتكون
من
؛
1
)
حم ض
ض ي ق
(
w eak acid
)
ط
'
ل
:
C O O H
-؛
HF, CH
2
)
قا عدة
ضعيفة
W eak Base
ث ل
:
CN, F
.
؛
H
\

م ف ت ا ح
ا إل ب د ا ع
ل ل ث ب ع ا ء
مل ة
ا ل ت ح ل ه
Composition of Solution
انموالرية
(
M) (Molarity
:)
عدد
مو ال ت
المذاب
الموالرية
=
=
M olaritv
حجم
المحلول
(
م
)
'
m oles o f solute
M olarity = ----------------------------
volum e o f solution (L)
ي
و حدة
الموالرية
=
m ol/L
أو
M olar
وكما
نتذكر
سابقأ
٠
،< > =
m
؛
n
ص
M
ي
"
Example:
C alculate the m olarity o f a solution prepared by dissolving
11.5 g o f solid N aO H (M w = 40 g/m ol) in enough w ater to
m ake 1.5 L o f solution?

م ف ت ا ح
ا إل ب د ا ع
س مي ا ء
ة
ح ل ي ل
ا ل ت
احسب
الموالرية
لمحلول
ح ف ز
بإذابة
11.5
g
من
مادة
N aO H
(
ك
.
م
=
40
غم/موال
ال صلبة
ف ي
كمية
كافية
من
الماء
لعمل
محلول
ح ج م ه
1.5
L
؟
Solution
:
m = 1 1 . 5 g
L = 1 .5 L
M w = 40 g/m ol
0.288
m o
]
=
تلي
=
ي
=
n
M = n = a 2 8 8 = a i 9 2 M
1.5
٧
Exam ple
:
a solution prepared by dissolving
’
اد
)
C alculate the M olarity
1.56
g o f gaseous HC1 enough w ater to m ake 26.8 ml o f
?
solution
ا ص ب
الموالرية
ل ط و ل
ح ف ز
بإذابة
56
g
.
١
من
قا ن
HC1
ف ي
ش ب ة
ك ا ف ة
من
الماء
نمل
محلول
ح جمه
26.8
ml
؟
Solution
:
ا
ا
0 .0 2 6 8
اقغث=
=
m = l -5 6 g
v = 26.8 ml
1000
M w = 1 + 35.45 = 36.45 g/m ol

ح، ت ث
ا إل ب د ا ع
»
>
;
-
I
-
ة
ح ل ب ل
ا ل ت
= 0.0428 mol
1.56
36.45
m
ءر
1 .5
=
ع ئ
» =
V
0.0286
Example:
Typical blood serum is about 0.14 M NaCl, what volume of
blood contains 1.0 mg NaCl?
-1x10
١
g-x
؛
m=1.0rr
Solution:
M = 0.14 M
10
'3
mg
'
w = 2 3 + 35.45 = 58.45 g/mol
n = —
= l x l ° 3 = 1 .7 x l0 - 5 mol
= <
؟
عم
<
ء
,
58.45
Mw
ى
ب
M = ^ = » 0 . 1 4 = L 7 x 1 ° 5
V =
1.2 x lO “4 L
ب م<
Example
:
١١
؛
s dissolved
؛
(
A 8.40 g sam ple o f H F (M .m = ^0.0 g/m ol
in give 2 .0 x l0 2 m L o f solution. T he concentration
o f the soiution i s
:
7.4
(
a) 5.9
b) 2.1
c) 8.3
d)
3.7
e

Solution:
n = —
= — = 0.42
Mm
0ت
M = ^
V = 2 . 0 x K f m L x ^
ذ ت ت„ .
Example
:
350
in
ا
')
ااء
؛
ل
؛
اال
(
م
'
ا
(
The mass o f ^aCI (M .m = 58.5 g/m ol
mL o f a (1-250 M solution o f sodium chloride is
:
|
a) 5.12 g
I
b) 12.7
c) 6.93 g
،1) 18.8
e) 9.1 0 g
:
Solutions
س
:
ث ة
: :
= > n = 0.25 X 0.35 = 0.0875 mol
=>m = n x M m
= 0.0875 X 58.5 = 5.12 g
م ف ت ا ح
ا إل ب دا ع
ب
ل ل
ء
ة
مل ب ل
ص

Example
:
21.4
g of CaCI2 (M.m = 111.0 g/mol) is
؛
٠
A sample
dissolved in 450.0 ir،L of aqueous solution. Calculate the
molarity of CaCl2 in solution
:
70.4
(
a) 0.124
b )0 .7 ? 8
|c) 0.428 [
d) 2.46
e
م ف ت ا ح
ا إلب دا ع
مي ا ء
ل ل غ
ح ل ي ل ة
ا ل ت
Solution:
ا س
3
ا
"
0
ء
آ آ آ
ء
ق
، ■
“
”
V = 450 nil = 0.45L
M = ^ = 0 . 4 2 8 M
Example■.
Calculate the mass (g) of K NO
3 (molar mass = 101.1
g/mol) which is needed to prepare 250. ml of 2.00 M
KNCh solution.
,
— - )
a) 202
b) 75.8
c) 303
d) 25 ل
|e)
50.6 [
Solution:
٧= 250 0.25 = ك L
N = M xV

N = 2
X
0.25 = 0.5 mol
M = n x Mw
=
0.5
X
101.1 = 5 0 .5 5 g
Exam ple
How m uch solid K2C r20 7 m ust be w eighed out to make 1 L
?
o f 0.2 M solution
ما
هي
كمية
المادة
المعلبة
من
0 7
?
K2Cr
الالزمة
لعمل
محلول
ح ج م ه
1
ا ون ز كي ره
0.2
M
؟
Solution
n = M
X
V = 0.2
X
1 = 0.2 mol
> =
m = n x M w = 0.2
X
(294.19) = 58.8 g
م ف ت ا ح
ا إل ب د ا ع
مي ا ء
ل ل ك
مل ة
ح ل ي
ا ل ت
