
موكضجهجوص
1
ك ص
م. ةا م م ح
2015
ل م ح ق و ل
J jS
>i(j
f
(
إ
)
ك
1
وطأ|
^ j ^ J L j y ,

يو جد
عدة
تعاري ف
للحمو ض
والقواعد
سأذكرها
حس ب
التسلسل
التاريخي
.
A r r h e n iu s C o n c e p t
ض
ط
a) acid = produce hydrogen ions in aqueous solution
بالمحاليل
المائية
(H+)
يعط ي
أيون
الهيدروجين
Example:
HC1
H;Q>
H++ c r
رط Base = produce hydroxide ions in aqueous
بالمحاليل
المائية
(OH
ي ع ط ي
أيون
الهيدروكسيد
ر
Example:
NaOH
ظ
ج
N a + + OH~
٠٠٠
ن ال ح ظ
أن
تعري ف
أرهينيو س
كان
مبس طأ
و ي ف ت ح ع ر
ع ل ى
األحم
—
الض
والقواعد
القوية
فق ط
.
B r o n s t e d - L o w r y M o d e l
مان ح
البورتون
Acid = proton (H+) donor
مستقبل
البروتو ن
Base = proton (H+) acceptor
٠
^
٠
ويكون
هذا
التعري ف
أشمل
وأو ضح
،
ومع
أنه
ال
يشمل
ك ل
ال ح م و ض
والقواعد
ولكنه
سيكون
أساس
درا ستنا
بهذه
الوحدة
.

Conjugate pair (
زوج
مرافق
)
Example:
H"
n h
:
+
conjugate
conjugate
+
H20
acid
٠٠٠٠
دائما
الحمض
(
acid
)
ي ع ط ي
قا عدة
مرافقة
(
conjugate base
)
والقا عدة
(
base
)
ت ع ش
حم ض
مرافق
(
conjugate acid
.)
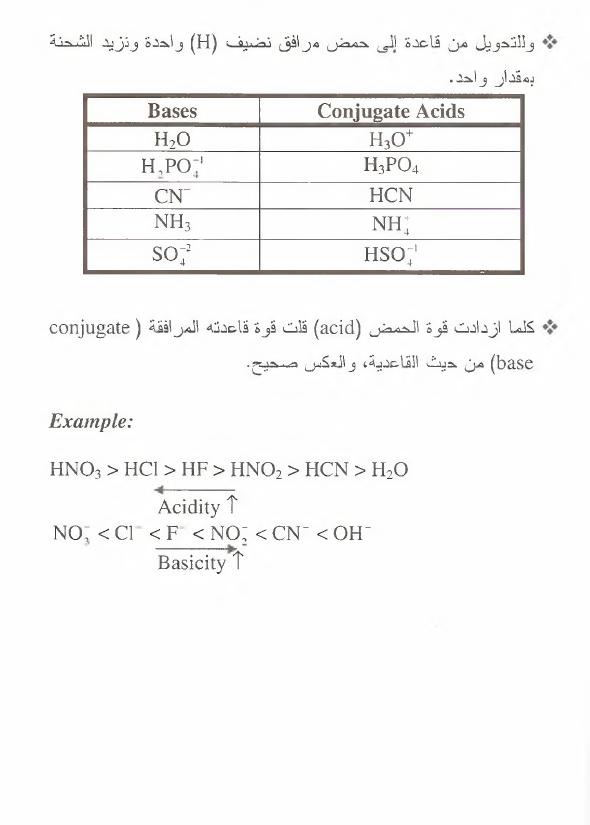
للتحويل
من
حم ض
إلى
قا عدة
مرافقة
فإننا
نزيل
(
H
)
و ا ح د ة
و ن ت ف ص
الشحنة
بمقدار
واحد
.
A cids
C onjugate Bases
h 20
OH-
n h
;
،؟
N H
h p o ;2
P 0 4
“3
h s o
;
s o ; 2
n h 3
؛
N H
وللمتحويل
من
قا عدة
إلى
حمحض
م راف ق
ن ضي ف
ز م
وا حدة
ونزيل
ال ش حنة
بمقدار
واحد
.
Bases
C onjugate A cids
0
ةتء
h
30 +
H .P O ;1
H
3
PO
4
CN”
HCN
n h
3
n h
;
s o ; 2
h s o
;;'
co n ju g ate)
قل ت
ق وة
قا عدته
المرافقة
(acid)
كلما
ازدادت
ق وة
الحم ض
من
حي ث
الفا علية
،
والعك س
صمحيح
. (base
Example:
H N 0 3 > HC1 > HF > H N 0 2 > HCN > H20
Acidity
آ
n o : < Cl < F < n o ; < c ^ " < O H “
Basicity
T

هي
ا ل ح ا ل ة
التي
تكون
فيها
تراكيز
المواد
المتفاعلة
و
النات جة
ثابتة
م ع
الوقت
.
The state where the concentrations o f all reactants and
^ d u c t s remain constant with time.
وهذا
ال
يعني
أن
التفاعل
قد
توق ف
،
التفاعل
يبق ى
مستمر
،
لكن
سر عة
التفاعل
األمامي
(
Forward reaction
)
تكون
م ساوية
ل س ر ع ة
ال ت ف ا ع ل
ال ع ك س ي
(
Reverse reaction
)
لكننا
ال
نشعر
بأ ي
تغيي ر
عل ى
حالة
التفاعل
.
Example:
س ب م ء
2
ه م م
+ *
ر ه ه
3
The equilibrium constant
\
ن زاكيز
النواتج
\
concentrations o f Products
< —
concentration o f Re ac tants
K =
ك أ ب ت
زان؛نلاا
لو
أخذنا
التفاعل
العام
التالي
:
K = equilibrium constant
ه ك
+
ط
م م ئ
+
ص
^ K = [c]c[D]d
،
[
a
]”[
b
]
يدخل
في
تعبير
ثاب ت
االتزان
المواد
الغازية
(
ج
)
والمحاليل
(
aq
)
فق ط
.

Example:
أ
3
„
آت
)؛(
2 N H 5
؛ ;
)؛(
N 2
+
)؟(
3H 2
[
h
2]’ [
n
J
K
Example:
Write the equilibrium expressi©n for the follow ing reaction:
4NH3(g) + 702(g) 4 يN 0 2(g) + 6
ج
)
2 0
آ أ
)
Example:
أكتب
تعبي ر
ثاب ت
االتزان
للنفاعل
التالي
:
اةا
20
ي إ
6
+
)؟(
0 2
ي م
4
ت ث
(
ء
)
7 0 2
+
ا ة
)
3
س
4
Solution:
[ N 0 2]4 [H20 f
[
n h
5]4 [
o
:
K
Example:
ا ا ه
+
ر م ء ه ء ص ء ه ء ر
،
,
5
C u S 0 4|V|+ 5 H 20
؛
(
b) C u S 0 4 -5 H 20 (s
K = [H20 ]5
,
0
+
) (
2H 2
؛
:
؛
)،(
2H 20
(
٥
ل ه
]
2
[
K = [ H 2
).';،)
ة
-).')<
d) C';iO

Example:
At high tem ^ratures, elemental nitrogen and oxygen react
with each other to form nitrogen monoxide:
(
ة
)
ال ق م
م
)؛
2
م
( +
ج)ئ ال
Suppose the system is analyzed at a a rticu la r '
'
and the equilibrium concentrations are found to be [N2] =
0.041 M, [ 0 2] = 0.0078 M, and [NO] = 4 .7 x l0 '4 M.
Calculate the value o f K for the reaction.
عند
در جة
حرارة
مرتفعة
فإن
ج زيائ ت
النيتروجين
واألوكسجي ن
نتفاعل
معا
مكونة
أكسيد
النيتروجين
حس ب
التفاعل
التالي
؛
>.<
ص ا
ه
*
ا ه ه+ م
تم
ت طي ل
النظام
عند
در جة
حرارة
معينة
وو جد ت
ال ت را ك ي ز
ف
ا ال ت ز ا ن
'
٧
ا ه
0.0
=
[
0.0078
M, [N2
=
لت
0
]
,
NO] = 4 .? x l0 “* M
]
احسب
قيمة
عأ
لهذا
التفاعل
؟
Solution:
بما
أن
السؤال
قد
ذكر
بأننا
ف ي
و ضع
االتزان
فإننا
ن ست طيع
التعوي ض
مباشرة
بالقانون
:

ه
ال
تو جد
ل
خ
1
و حدة
ف ي
هذا
ا ل س ؤ ا ل
ألن
ال و ح دا ت
أ ل غ ي ث
ب ع ض ه ا
البعتض
.
^ —- = unit less
M.M
ه
دائما
و حدة
خأ
تعتمد
على
القانون
ولي س ت
ثابتة
.
ه
ه
٠
ء
-
؛؛؛
؛؛؛-
و؛
ه
-
؛؛؛-
ي
؛؛؛
تو-
*
•؛؛؛
ي:ه
ءه
؛؛؛
ج
-
بج
ت
نه
-
ء
-
-
ت
:
ي
؛؛؛
ه
;
ي
-<:؛
ه
-
و:-
ص
*
إذا
كان
لدينا
التفاعل
العام
التالي
:
aA +
b B ^ c C + dD
K
= x
ه
إذا
قمنا
بعك س
المعادلة
فإننا
نعك س
قيمة
K
5 a A + bB
K = (x)~' = i
؛
cC + d D
ه
إذا
ق شا
ب ض ر ب
المعادلة
بعدد
فإننا
ن رفع
K
لنف س
العدد
mcC + mdD
K = (x )ni
ج
maA + mbB
Example
:
K = 3 . 8 x l 0 4
؟)؛؛(
N 2(g)^ 2 N H
+
)؟؛(
3H 2
Calculate (K) for these reactions
:
??
=
3 H ,(s)
K
+
)؟(
,
N
؛«
)،(
a) 2 N H 3
??
=
K
رة
)
ل
س ت
؛
(
ء
)
2
م
) ؟ ا
ط
ه
a
)
بما
أ ن ا
ش ن ا
التفاعل
األساسي
؛
-،
1
Solution:

b
)
بما
أننا
ضربنا
التفاعل
ا أل سا س ي
ب
—
V k = V 3 .8 x 1 0 4
= 1 .9 x 1 0 2
=
(؛
>=
K , = (
k
Example
:
the reaction
٢٠
؛'
At a given temperature, K = 1.3xlCT2
Calculate values o f K for the follow ing reactions at this
temperature
.
؛(
5NH30
؛
a. i N 2(،) + i H 2W
(
3H 2(g
+
)؟(
N
2
ة
(
2N H 3(g
.ظ
)؛(
,
j H
+-
)؟(
2
بمأت
؛-؛
)هال؟<
ء•
5
4 N H
3
(g
)
؛
(
2N
2
(g)+ 6 H 2(g
. ه
Solution
:
0.114
=
(؛
2
~
a) K, =(K)= = ( l . 3 x l 0
76.92
=
—
=
~
("'
2
“
b) K , = ( k )_1 = ( l . 3 x l 0
1 .3 x 1 0
4
'
d) K 4 = ( k )2 = ( l.3 x l( T 2)2 = 1 .6 9 x 1 0

أن ؤا ع
ث واب ت
س ن.ا ت
ال ؤا ق ع ة
ر
ا ل س ا ء
ا ل ت ط ب م ة
Types of Equilibrium constants Encountered in
analytical chemistry
عزيزي
الطالب
مز
معنا
العديد
من
ثواب ت
االتزان
ع ن د
د ر ا س ت ن ا
ل ك ي م ي ا ء
(
102
)
لذلك
سو ف
أذكرها
ف ي
الجدول
التالي
بشكل
مخت صر
للتنكي ر
بها
ث م
سأشر ح
كل
وا حدة
ش ها
بالتف صيل
ث
مح-حت
ءا.هإمإ
i c ، il C h e m i s t r y
؛
E q u i l i b r i a a n d E q u i l i b r i u m C o n s t a n t s I m p o r t a n t i n A n a ! y
T f .ijiiiU b r iu m
؛'
T y p e o
S y m b o l
،|
اااإ
،
N a m
o f E q u i i i b r i u m C o u s u i i i t
E x a m p le
اا
.
ت
:
ا
؛
<
'را
’
آ
E q n i l i b r i m n - C o n s t a i i ،
E x p r e s s io n
o f w a te r
و
:؛؛;
ههئه،نه
U b r iu r a
،،؛؛،؛
تسههءهمدء<
؛،■
s o lu b
•
إ
؛؛
لمح!وأت
ة
ءا؛'حمتءو
و
؛
o ils
؛
it s
صر
ه
)ثلةااة؛،وءة
n
؛؛،؛
u
؛
s o
،؛
سي!ءئهة
ه
K w
أ ا
.؛
تءةأإ
0
ت
r o a - p M d u c t
,؟؛؛,
؛:؛,
lu
>؛،
S o lu b ii it y p r
-
بمه
+
( مأ ء ت'ء ء مبم م
~
S O z
ب
؛؛■<-'■'
كء
ر
'
ا
'.
رآآلاتو;ا
ل
-"
م م* ؛ م بء م باام ه
ب
ث ه ة إ ب م- ل
س
ه
o f
أ
><>
آ
!
م؛ةحملاءئه
ء
؛،ت
ز
ء
o r
؛
i c k
؛
؛,
t o n s a n
ا
;
ز
؛
ة
'؛؛،
ا
،<
ئ
(؛;؛ه
ع'وهءمبإ
ء ه ب م ب
( ؛ ' )
آرله:؛.لا
"■
C O G
؛
O R
•؛■
م م
1
؛
0
] -
f C H , C 0 0 - j
؛
.
l H
..
••
[
C H j C O O H j
تي
0
ل
؛
أ
-
4
؛ ( ؛ (
c : ir . ، c
C O O H
؛؟
C i
ب
ئ
؛
ر
'
اا
.
ل و و
،';
آ آ ه
:
أا ه أ'ر ا
ا د
)
ت
ه
،
إء
)،:؛•
آ،أآا
س»لإاص
؛ا
ث
؛'
f- 'o r n w iim
ة
.
.
c o n s Q f ii
؛؛
u n u a t io
؛•'•'
-
س؛ ء ت م ئ
•
ش ه
٠
ء
•؛
N i f C N j j
]
„
‘
C N " - j
؛
r ; i
؛
lN
ء"
اا
;
مةآه*ئهإئأخلأءص
؛
a n
؛
iU » r
؛؛
q
»
ع'.مم
محمءأأب
؛
م آ
-
ا
.؟
صارال؛د
م ء م ج م م ح أ و
+
متمت
س ا؛ م ا ا ة م م ا ء
...
،■
ه
ل
-
؛
ا إ
؛
أل
نث
ء ماأ
:
0
الأ،أ
س
ت
ا
؛;><؛•
لسي
،
امحبمء؛ف
•:.؛؛
r ib u r j
؛؛ ;
D
•.
اأ
؛;<
ن؛؛ئتلآنأآ
ءة؛'.'.ءمس
ث
م؛اااه
ه
س
صم
)
ي
،
ب م م آ؛ أ ء
ح ه
ح م
م
؛
Water as ai* Acid a;*d Base
ه
يمكن
للماء
أن
يتفاعل
كحمتض
أو
ك ق ا ع د ة
ل ذ ل ك
ن ط ل ق
ع ل ي ه
ا س م
.(amphoteric substance)
h
2
o
+
h
2
o
^
h
3
o
+ +
o h
“

م ث ل
ا أل م و ن ي ا
(AMPHOTERIC)
ه
ويمكن
لمواد
أخرى
أن
ت ك و ن
n h
3 +
n h
3 ^
n h
; +
n h
;
ه
ومن
هذا
التفاعل
لل م ا ء
2H20(D تث H30 +(0q) + OH
((ورء
نم
التو صل
إل ى
هذا
القانون
ت
ل
'
ث ءه
]
م ء= ] م بمم ل
Kw = Dissociation constant for water
ثاب ت
تفك ك
الماء
ويمتل ك
قيمة
را
'
1x10
)
عند
در جة
ح رارة
.
25
°
c
أيون
الهيد ر ونيوم
H 30 +] = hydronium ion
]
و ه و
نفسه
*[
H
.]
أيون
الهيدروكسبد
OH-] = Hydroxide ion
.]
*
إذأ
من
خالل
هذا
القانون
ن س ت ط ي ع
إ ي ج ا د
[
+
H30
]
أو
[
-
OH
]
ب د ال ل ة
م< لآ ا
Example:
Calculate the [OH- ] and [H+] of each o f the following
solutions at
25 °c.
a) [H+] = 3.2 x i o M
b) [OH“] = 4.67X10‘8 M
Solution:
a) KW= [ H +] [OH- ]
1 x 1 0 ' I4 = (3.2x10'5) [OH']
=> [OH~] = 3.125
X
10
M.
b) 1x10 14 = [ H +] [4.67 XIO'8]
^ [ H +] = 2 . 1 4 x l 0 7 M
204

The (P) Functions
jlogjcJ
Px
نستخدم
(
P-function
)
لتسهيل
التعامل
م ع
األرقام
.
مثأل
:
استيعاب
وفهم
(
4
)
أسهل
بكثير
من
(
l x i o 4
. )
3) PH = - log [H+]
4) POH = - log [OH■
Example:
1) [H+] = 2 .1 6 x lO ~ 4 M
=> PH = - log (2.16 XlO'4) = 3.67
2 ) [OH- ] = 5 .3 4 x 1 0
ع POH = - log (5.34 xlO “7) = 6.27
كالتال ي
ت
(Px) من (x)
ون مت طب ع
عمل
عكس
العملية
السابقة
ب ح سا ب
x = anti 1 ج م (—Px)

Example:
ع [H+] = anti log (-8.67) = 2.14 X l0 ‘9 M
2 ) P©H = 3.42
=> [OH“] = anti log (-3.42) = 3.8 xlO '4
بهذا
القانون
ن ست طيع
إيجاد
PH
من
POH
والعك س
ص حي ح
.
a) PH = - log [H
+
]
3.58
=
(
=
-
log (2.66x10
14
=
PH + POH
=؛<
10.42
=
14
=
3.58
+
POH => POH
b)
POH = - log [OH
]■
7.23
=
'؟(
=
-
log (5 .8 6 x 1 0
14
=
PH + POH
د
6.77
=
14
=
PH + 7.23 => PH
PH 4 — .> POH
Example:
Calculate PH and POH for
:
M
[H
"
؛
]
*
a ) 2 .6 6 x l O
b ) 5 . 8 6 x l O M
[OH
Solution:

٢ ٢
scale:
تتراوح
قيم
PH
من
1
—
>
14
ون ست طي ع
تق سيمها
إلى
ث الثة
أقسام
.
(
ح ا ض ي
)
acidic
ت<
7
>
a)
PH
(
متعادل
)
b)
PH = 7 => neutral
(
قاعد ي
)
basic
بم<
7
<
c)
PH
Example
:
The
PH o f a sample o f human blood was measured to be
7.41
at 2 5 ° c . Calculate
POH, [H*], and [OH“] for the
.
sam ple
يتم
قيا س
PH
لعينة
من
الدم
البشري
وكان ت
تساو ي
7.41
عند
در جة
حرارة
2 5 ° c
،
احسب
H+J
،POH
،]
[
ال ه
]
لهذه
العينة
.
Solution:
1) 14 = PH + POH
14 = 7.41 + POH ص POH = 6.59
2) [H+] = anti log - PH
= ant] log - 7.41 = 3.89 xlO ' 8 M
3) [O H -] = anti log - POH
= anti log - 6.59 = 2.57 XlO’’ M
أو
توجد
طريقة
أخر ى
للمحل
.
Kw = [H+] [OH~]
l x l O ' l4 = ( 3 . 8 9 x 1 ( °
^ [© H ~ ] = 2 .5 7 x 1 0 ' ’ m
x 1 0 ‘14 = ( 3 .8 9 x 1 0 '8) [OH-
