
ص
موكضجهجو
1
ك ص
م.ةاممح
2015
لمحقول
J j S
>i (j
f
إكإقصو
ajffesisJLJiJ,

م ف ت ا ح
ا إل ب د ا ع
ء
م ا
س
ل ل
ة
ي ل
ص ل
سو ف
نقوم
بحراسة
عدد
من
الطرق
التقليدية
ف ي
التحليل
الكيميائي
وف ى
ه ذ ه
الوحدة
سو ف
نقوم
بدرا سة
طرق
التحليل
الوزني
.
G ra v im e tric M eth o d s o f A nalysis /_«—i.iafl J -
هي
طرق
كمية
تعتمد
عل ى
تحديد
كتلة
المركب
النقي
والذ ي
ت رتب ط
فيه
المادة
المراد
معرفتها
كيميائيأ
.
Quntitative methods that are based on determining the mass
of a pure compound to which the anaiyte is chemicaliy
related.
وذل ك
عن
طري ق
معادلة
كيميائية
مو زونة
والحسابا ت
الكيميائية
التى
م ر ت
معنا
سابقأ
.
P re c ip ita tio n G ra v im e try (
1
—
Ui—udM.jSfl
إ
إلى
مرك ب
ش ح ي ح
analyte)
س و ف ا
نقوم
هنا
بتحويل
المادة
المراد
ت حليلها
ثم
نقوم
بف صل
الراسب
عن
طري ق
تر سبيه
(Sparingly soluble) الذوبان
(washed free of impurities)
ثم
غسل
هذا
ال را س ب
م ن
ال ش وا ئ ب
J^nown )
و ت ح و ي ل
ه ذ ا
ال را س ب
إ ل ى
م ر ك ب
ذو
ت ر ك ي ب ة
م ع ر و ف ة
ع ن
طري ق
معال جته
بال ح رارة
ب ش ك ل
م ن ا س ب
(composition

ووزنه
ومن
خ الل
و زنه
ن ست طيع
معرفة
(by suitable heat treatment)
.(analyte)
وزن
المادة
المراد
ت طيل ها
Example:
2 N H 3 + H 2C 20 4 —^ 2 N H 4+ + C 20 4
C a +2(aq) + c 20 4 (aq) >
C aC 20 4(s)
C aC 20 4(s) —-~->CaO(s) + C 0 (g) + C 0 2(g)
الناتج
ن سن طي ع
م ع ر ف ة
ك ظ ة
(CaO)
من
خالل
معرفة
كتلة
أكسيد
الكال سيوم
(C a^)
وتركيز
أيون
الكالسيوم
صفا ت
الزلكجب
وعوامل
الزت
سب ب
Properties of precipitates and precipitating reagents
ال م س ت خ د م
م ح د د
"?reeipitating agent"
يح ب
أن
يكون
عامل
الترسي ب
أ ي
يتفاعل
مع
مادة
وا حدة
فق ط
)
أو
ع ل ى
ا ه ل
ي ك و ن
) ( ^ c i t i c a l l y )
."
يتفاعل
مع
عدد
م حدود
من
المواد
" (seleeti¥ely) اختياري
A gravemtric R eeipitating agent should reaet speeitically or
at least seleetively with the analyte.
م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
ج ا
ب ل
ت
ا ل

م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
اد
:مثال
،A g N 0 3 ( و ه وselectively)
سو ف
أعطي
مثال
عن
م ط و ل
ا خ ت ي ا ر ي
acidic
بحي ث
ي ر س ب
عدد
م حدود
م ن
ا أل ي و ن ا ت
ف ي
و س ط
ح ا م ث ي
ر
(Dimethylglymoxine, CN", I", B r‘,
cr)
و ه ي
(medium
سو ف
ند ر سه
الحقأ
بالتف صيل
والراس ب
الناتج
من
عملية
الترسي ب
يج ب
أن
يمتل ك
عدة
صفا ت
مهمة
وه ي
:
آ
.
سه ل
الفلمترة
والغ س ل
من
الشوائ ب
Easily filtered and washed free of containants
2
•
له
ذائبية
قليلة
،
بحي ث
ال
يفقد
كمية
مؤثرة
أثناء
عملية
الفلترة
O f sufficiently low N u b ility
3
•
ال
يتفاعل
مع
العنا صر
الموجودة
بالهوا ء
ر
مستق"
Unceactive with constituents of the atm osphere (stable)
4
.
له
تركي ب
كيميائ ي
مع ر و ف
بعد
عملية
ت جفيفه
أو
ح رقه
إذا
ل زم
known chemical composition after it is dried or if necessary
ignited

م ف ت ا ح
ا إل ب د ا ع
ء
خ ي م ا
ل ل
ه
ي ل
ص ل
ح ج ج
ا ل ه ج م ا ت
و ف ئ ت ز
ة
الؤ
ا س ه
Particles size and fllterabilitv of precipitate
ف ي
عملية
التر سي ب
نعم ل
إلى
جع ل
ج سيما ت
الراسب
ب ح جم
ك ا ف
ل ف ل ت ر ت ه ا
وخلوها
من
الشوائب
ع وا م ل
ن م د د
ه ج م
ج س ي ما ت
الت ر س ه ب
Factors that determing the particle size of precipitate.
نتق سم
ال ج سيما ت
الناتجة
عن
عملية
التر سي ب
إلى
ن و عي ن
رئي سيي ن
ت
1
)
معل ق
ر غ و ي
(
Colloidal suspension
)
وهي
جسيما ت
صغي رة
ج د أ
(
tiny particles
)
ال
ت ر ى
ب ا ل ع ي ن
ال م ج ر د ة
(
invisible to the nacked eye
)
و ي ك و ن
ق ط ر ه ا
Diam eter
)
)
من
(
4
'
10
-
°
ل
"
10
cm
)
و ال
ن ث ل ت ر
ب س ه و ل ة
(
n o t
(.
easily filtered
2
)
معل ق
بل ور ي
(
(
Crystalline suspension
هي
ج سيما ت
أكبر
من
المعلق
ال ر غو ي
بحي ث
ي م ل
ق ط ر ه ا
إ ل ى
أعشار
الميليمترا ت
ويسهل
ف صلها
وفلترتها
(
easily filtered
)
و ه ي
ما
ن حتآ ج
إليه
ف ي
عملية
الترسي ب
.

م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ف ي
ة
ح ل ي ئ
ا ل ت
قام
العلماء
بدراسة
تكون
الراس ب
لعدة
سنوا ت
،
لكن
عملية
الترسي ب
ل آلن
غير
مفهومة
بشكل
كامل
،
لكن
الحظوا
أن
حجم
الراسب
يتأثر
عدة
أمور
ت
ا
ل
.
ذائبية
الراسب
Precipitate N u b ility
2
.
در جة
الحرارة
T e ^ r e t a tu r e
3
.
نزكيز
المنفاعص
Reactants c©ncentration
4
.
معدل
س ر عة
خل ط
ال مت فا ع ال ت
ب ع ض ه ا
ا ل ب ع ض
rate at which
reactants are mixed
لكننا
ن ست طيع
تب سي ط
األمور
أكثر
وذلك
ب رب ط
حجم
جسيما ت
الراسب
ب ح ي ف ة
وا حدة
وه ي
ما
نطلق
طي ه
اسم
فو ق
ا إل ش ب ا ع
ا ل ن س ب ي
(
Relative super
saturation
.)
~
إل
~
=
ReaJtivesuper saturation
Q = concentration of solubie at any instant
تركيز
المذاب
ف ي
أي
من طقة
من
المحلول
s = Equilibrium Solubility
ذائبية
اإلنزان
ل
للمحلمو"
بشكل
كامل
"
عل ى
أنه
محلول
(super saturation)
ونست طيع
تعري ف
محلول
فوق
اإلشباع
غير
مستقر
ي حت و ي
كمية
من
المذاب
فو ق
قدرته
عل ى
اإلشباع
و م ع
م ر و ر

م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ث
ة
ا ل ت ب ل ب ل
الوقت
يعود
هذا
المحلول
لو ضع
االستقرار
وهو
ال م حل و ل
ا ل م ش ب ع
و ذ ل ك
بترسي ب
كمية
من
المذاب
على
فبكل
راس ب
.
Unstable solution that can contains a higher solute
concentration than a saturated solution, with time super
saturation is relieved by precipitation of the excess solute.
ومن
خ الل
القانون
السابق
إذا
كان ت
قيمة
ع
ر
)
كبيرة
فهذا
ي ؤ د ي
إ ل ى
S
تكوين
راس ب
ر غو ي
(
C ollidal
)
أما
إذا
كان ت
قيمة
(
^
)
ص غي رة
فهذا
يؤد ي
إلى
تكوين
راس ب
بلور ي
(
Crystalline solid
.)
ولتقليل
قيمة
إل ع طا ء
ح جم
ج زئيا ت
را س ب
أكبر
يك و ن
ذ ل ك
ع ن
طريق
زيادة
قيمة
(
S
)
وتقلي ل
قيمة
إ و
)
باتبا ع
الطرق
التالية
؛
1
)
ا رتفا ع
د ر جة
ح را رة
المحلول
ل زيادة
ذائبية
المحلول
(
S
)
Elevated tem perature to increase the solubility of the
(.
precipitate (S
"Q 2)
تخفي ف
المحلول
لتقل ي ل''
قيمة
Dilute solution (to minimize Q)

3
إ
إ ضافة
عامل
الترسي ب
بثمكل
ب طي ئ
م ع
ت ج ري ك
جيد
ل
لتقلي"
قيمة
Q
Slow addition of the precipitating agent with good stirring
"
to minimize Q
"
*:
Lalfe
الراسب
الذي
يمتل ك
ذائبية
قليلة
جدأ
"
p
^ ^
صعغيرة
جدأ
حال
بع ض
ر و ا س ب
الكبريتيد
واألكاسيد
المائية
،
فإنها
عادة
تكون
راس ب
ر غو ي
.
?ricipetates that have very low solubilities, such as many
sulfides and hydrous oxides, generally form as xolloids.
م ي ك ا ن ي ك ب ة
تكؤ
بسؤم
،
الز
ا س س ى
M ech an ism of p re c ip ita te fo rm a tio n
ي حد ث
تك وي ن
الراس ب
بميكانيكيتي ن
م ختلفتي ن
و هما
:
ل
)
هي
عملية
يق وم
فيها
أقل
عدد
من
ا ل ذ ر ا ت
أو
ا أل ي و ن ا ت
أو
ال ج ز ئ يا ت
بالت جم ع
م ع
بع ضها
البعحض
إلع طاء
را س ب
م ستق ر
.
A process in which a m inimum num ber of atoms, ions or
molecules join togther to give a stable solid.
ف ي
عملية
التر سي ب
فهذا
(Predominate)
وإذا
كان
هذا
النوع
هو
السائد
(Collides)
يؤد ي
إلى
تكوين
جسيما ت
صغيرة
من
الراسب
م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ف ي
ة
ح ل ي ل
ا ل ت
( N u cleatio n ) ا ك و ي

م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
ة
ح ل ب ل
ا ل ت
( Particle g ro w th ) 2)
نم و
الجسيم
يت ج م ع
الرواسب
ال صغيرة
الناتجة
لتع ط ي
ج سيم
أكبر
Competition between additional neucleation and growth
on existing neuclie.
عندما
يكون
نمو
الجسيم
(
Particle grow th
)
هو
السائد
ف ه ذ ا
ي ع ط ي ن ا
جسثما ت
بحجم
أكبر
وقابلة
للفلترهء
و ه ى
األف ضل
ف ى
عملية
الترسي ب
.
ز ب ج ب
ا ث م ط ق ا ت
CoMidal Precipitates
إذا
نت ج
خ الل
عملية
التر سي ب
أج سام
م ع ل ق ة
(
C ollids
)
ف إ ن ن ا
ال
ن س ت ط ي ع
ت ر سيبها
كما
مز
معنا
سابقأ
وبهذا
عملية
التر سي ب
ال
ت ؤ د ي
ع م ل ه ا
ب ش ك ل
صمحيح
،
لذل ك
البد
م ن
ت ر سي ب
لهذه
المعلقا ت
عن
ط ري ق
عملية
ن طل ق
ط ي ه ا
اسم
ت خ ي
المعلقات
(
Coagulation of colloids
.)
—
Cagulation of Colloids)
j
)
السبب
الذي
يجعل
المعلقات
(
colloids
)
بعيدة
عن
بع ضها
البعحض
هو
و جود
طبقة
م ش حونة
حول
هذه
الجسيما ت
تعمل
تنافر
فيما
بينها
م م ا
ي ش ع ه ا
م ن
التجمع
مع
بع ضها
البع ض
.
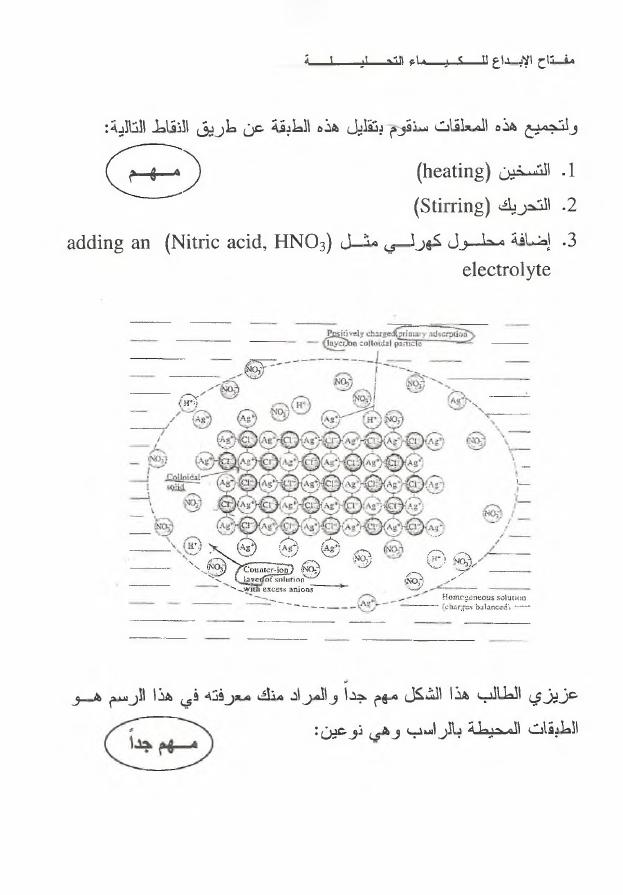
ف ت ا ح
ا إل ب د ا ع
ء
ب ا
ل ل
ة
ح ل ي ئ
ا ل ت
ولت جمي ع
هذه
المعلقات
ستق وم
بتقلي د
هذه
الطبقة
عن
طري ق
النقا ط
التائية
؛
1
■
س ي ن
(
heating
)
2
•
ا ك ر ه
(
Stirring
)
3
.
إ ضافة
ل
د
ك ه ر ل ي
م ث ل
(
adding an (Nitric acid, HNO3
electrolyte
(ج
م
جة
ء
؛
أ
neoM5 s o l u t i o n
؛؛
H o m c g
—
•••
>؛';
هاده^ءء
5
؟؛؛
r
؛؛
ca
؛'
ءةم
ءة
ءسأ
إلت
■
*
excess anions
؛
i3
؟
Z
'"•
عزيزي
الطالب
هذا
الشكل
مهم
جدآ
والمراد
مت ك
م ع رفته
ف ي
هذا
الر سم
ه و
الطبقات
طة؛بحملا
بالر
١
س ب
و ه ى
ن و عي ن
;
'
'
'

م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
ا ل ن م س ط ي س س ل س ا
ال
1
)
طبقة
اإلدم صا ص
األولية
(
Primary adsorption layer
)
وهي
أول
طبقة
من
ا أليونا ت
ت حي ط
ب ا ل ر ا س ب
ا ل م ع ل ق
(
C ollide
)
وتتكون
من
األيون
الموجب
(
Positive ion
)
الذي
يدخل
ف ي
تكوين
الراسب
وهو
هنا
^■(
A g
)
2
)
الطبقة
األيونية
المحيطة
(
Counter ions layer
)
و ه ي
الطبقة
الثانية
التي
تأت ي
بعد
طبقة
اإلدم صا صن
ا أل و ل ي ة
و ه ي
نتكون
من
أيونات
سالبة
(
negative ions
)
ف ي
ال م حل و ل
ل ك ن ه ا
ال
تد خ ل
ف ي
ت ركي ب
الراس ب
و ه ي
هنا
ف ي
هذه
الر سمة
(
؛؟
N O
.)
٠
^
٠
و
ن طل ق
عل ى
هاتين
ال طبقتي ن
معأ
ا س م
ا ل ط ب ق ة
ا ل ك ه ر ب ا ئ ي ة
ا ل م ز د و ج ة
.(Eleetrie double layer)
وكما
قلنا
سابقأ
البد
م ن
تقلي ل
ح ج م
ه ذ ه
ا ل ط ب ق ة
ل ت ج م ي ع
ال ر و ا س ب
ال ضرورية
(
collids
)
حس ب
الثالث
نقا ط
السابقة
،
وهذه
الرسمة
تبي ن
هذه
النقاط
.
I '< '
>—
I

Peptization ofcollids 4—*k-all c-
1
—J
\ fV-
4
j&s
هذه
العملية
هي
عكس
العملية
السابقة
ر
(التخث
(.
Coagulation
وف ي
هذه
العملية
يتم
إ عادة
الروا س ب
المعلقة
المت خث رة
إلى
و ض ع
الت شت ت
م ن
جديد
وذل ك
عن
ط ري ق
إزالة
المحلول
الكهرل ي
بغ س ل
الراس ب
بالما ء
.
The proeess by whieh a eoagulated collid revers to its
original dispers state by removal the eleetrolyte.
:4-
a
IA uAA-.Uflu.tfu
(Digestion) 1
م
اله ضم
و ه ي
عملية
ي س خ ن
فيها
الراس ب
ل مدة
سا ع ة
أو
أكثر
ف ي
المحلول
ا ل ذ ي
تكون
منه
المائ ل
ل
(المحلو
األم
) •
A process in which a ^ e c ip ita te is heated from an hour
or more in the solution from which it was formed (the
mother liquor)
ب حي ث
تع طينا
هذه
العملية
را س ب
أنقى
وأ سه ل
للفلمترة
.
Purer and more filtratble product.
م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ك ب
ل
ة
ح ئ ي ن
ا ل ت
2
.
المحلول
األم
(
the mother liquor
)
وهو
المحلول
الذي
تكو ن
ش ه
الراسب
.
The solution from which a precipitate was formed.

3
.
الترسي ب
المرافق
(
C oprecipitation
)
هي
ظا ه رة
يتم
فيها
إزالة
أيونا ت
أ خر ى
غير
ا أليون
المطلو ب
،
ت ك و ن
ذائبة
ف ى
المحلول
أثناء
عملية
التر سي ب
.
A phenomenon in which other wise soluble compounds
are removed from solution during precipitate formation.
ويوجد
أربعة
أنواع
للترسي ب
المرافق
وه ي
؛
1
)
اإلدم صا ص
السطحي
(
Surface A dsorption
)
2
)
تكوين
البلورة
المختلطة
(
m i d - c r y s ta l form ation
)
3
)
ا إلن حبا س
(
occlusion
)
4
)
الم صيدة
الميكانيكية
(
chanical Entrapm ent
) ^
وسو ف
أبدأ
بذكرها
بالترتي ب
.
1
)
ا إلدم صا ص
ال س ط ح ي
(
Surface adsorption
)
ويتم
ب ا ل س ا ق
ا أليونا ت
ا أل خر ى
أو
ما
ن طل ق
ط ي ه ا
ا س م
ال مل و ث ا ت
(
im purities
)
ط ى
س ط ح
الراسب
.
وتكو ن
هذه
العملية
هي
الم صدر
ا أل سا س ي
للملوثا ت
أو
ال ش وا ئ ب
ز
عملية
تختر
الرواسب
المعلقة
لكن
ال
يكون
لها
أي
تأثير
ف ي
عملي
—
ت
الترسيب
البلوري
•
is often the major source of contam ination
ال م ل إل
!
0
ه
ن
_
n coagulated colluids but of no significant in
,
.^ :
stalline precipitate
م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
ة
ح ل ي ل
ا ل ت

ولتقليل
كمية
الشوائ ب
الملت صقة
ب ا ل م ل ح
"
Minimizing adsorbed
impurities on eolioids
:"
ل
.
نق وم
بغ س ل
الراس ب
بم حلو ل
كه رل ي
ي حت و ي
مادة
ك ه رلية
مت طاي رة
.
W ashing
eoagulated
colloid
with
a solution
containing a volatile electrolyte
.
2
.
عملية
إعادة
ترسي ب
الراسب
الناتج
(
^ ^ (
ecipitation
وللط ال ب
الذين
درسوا
مختبر
الكيمياء
الع ضوية
فهي
ما
نطل ق
طي ه
اسم
إعادة
البلور
(
crytalization
. ) ^
2
)
تك وي ن
البلورة
الم ختل طة
(
Mixed-crystal formation
)
في
هذا
النوع
،
يحتل
األيون
ال غ ر ي ب
"
im purities
"
م ك ا ن
ا أل ي و ن
ا أل صل ي
(
analyt
)
ف ي
داخل
البلورة
.
A contanm inant ion replaces an ion in the lattice of
-
crystal
ول ح ل
هذه
المشكلة
ن ست طي ع
ا ست خدام
عوامل
ت ر سي ب
م حددة
أو
ا ختيا رية
.(Selective precipitating agents)
►
و ي ح د ث
م ق ل
ه ذ ا
ا ل ن و ع
ع ا د ة
ف ي
ا ل ت ر س ي ب
ا ل ب ل و ر ي
crystalline
^ e c ip ita te s
)
)
ب
و ا ل ت ر س ي
ق
ا ل م ع ل
(
(.
collidals precipitate
م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
ح ل م ي ن ة
ا ل ت

3
)
ا ص ب ا س
(
O cclusion
)
في
هذا
النوع
فإن
األيون
الغري ب
(
im purities
)
ي ص طاد
ف ي
د ا خ ل
جي ب
يتكون
أثناء
التكوين
البلور ي
ال سريع
.
A compound or ion is trapped within a pocket formed
during rapid crystal growth.
ويمك ن
الت خلم ن
م ن
مثل
هذا
النوع
م ن
الشوائب
ع ن
ط ر ي ق
إ ع ا د ة
وي حد ث
هذا
النوع
ف ي
التر سي ب
البلور ي
(reprecipitation) الئرسيب
"crystalline precipitate" فق ط
4
)
ال م صي دة
الميكانيكية
(
M echanical Entrapm ent
)
ي حد ث
مغل
هذا
النو ع
عندما
تكو ن
البلورا ت
ق ريبة
م ن
بع ضها
البع ض
أثناء
عملية
النمو
،
و عند
نمو
هذه
البلورا ت
ا ل م ت ق ا ر ب ة
م ع
ب ع ض ه ا
البع ض
ي حد ث
بينها
إ صطياد
ج زء
م ن
المحلول
ف ى
جي ب
صغي ر
بينها
.
M echanical entrapment occurs when crystals lie close
togther during growth, several crystals grow togther
and in so doing trap apportion of the solutioin in a
tiny pocket.
(r ^ e c ip ita tio n )
ون ست طي ع
التحلمص
منها
اي ضأ
بإ عادة
ا ل ت ر س ي ب
crystalline )
ويحد ث
هذا
النوع
ف ي
ال ت ر س ي ب
ا ل ب ل و ر ي
ف ق ط
.(precipitates

UaA^La
:>
األخطاء
الناتجة
عن
الترسي ب
المرافق
(
Coprecipitaion errors
)
ق د
تكون
مو جبة
(
positive errors
)
بحي ث
تزيد
كمية
الناتج
ع ن
ق ي م ت ه
الحقيقية
أو
سالبة
(
Negative errors
)
بحي ث
تقلله
.
4
-
iLag
■
Calculation of result from gravemtric Data
س و ف
أقوم
بع ر ض
ب عت س
ا أل سئلة
لت و ضي ح
عملية
التحليل
الوزن ي
و ه ي
ما
مر
معنا
سابقأ
ف ي
بداية
هذه
المادة
والمواد
السابقة
.
Example
:
The calcium in a 200.0 mL sample of a natural water was
the
.
ه£م
ه
determined by precipitating the cation
precipitate was filtered, washed and ignited in a crucible
with an empty mass of 26.6002 g. the mass of the crucible
plus CaO (56.077 g/mol) was 26.7134 g. calculate the
078
g/mol) in water in units of
.
ه
4
)
concentration of Ca
,
grams per 100 mL of the w ater
يتم
ت حديد
الكالسيوم
ف ي
عينة
من
الماء
ال طبي ع ي
ب ح جم
200.0
ml
عن
ط ري ق
ت ر سي ب
أيون
الكال سيوم
(
"؛
Ca
)
عل ى
شك ل
CaC20 4
،
الراس ب
يفلتر
ويغ س ل
وي ح ر ق
ف ي
و عاء
ف خا ر ي
و زنه
وهو
فا ر غ
(ج
26.6002
،)
و و ز ن
ا ل و ع ا ء
زائ د و ز ن
الو
اسب
،<
M w =56.077
g/mol) CaO
)
هو
(
34
g
ا
2 6 .7
)م
م ش ت ا ح
ا إل ب د ا ع
خ ي م ا ء
ل ل
ح ل م ي ل ة
ا ل ت

م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ف ي
ة
ح ل ي ئ
ا ل ت
.(g /1 0 0 m o l)
ف ي
هذا
الماء
بو حدة
(Mw=40.078) Ca
احسب
تركيز
Solution:
M Ca0=26.7134 - 26. 60. 1022 = 2 ل لg
ه ء ءه
" Mw
= M o 7 7
= L 8 2 X l 0 "3 mo1
Ca
ت حت و ي
ذ رة
وا حدة
من
CaO
ن ال ح ظ
أن
==> nCa = nCaO = 1.82
X
10'3 mol
=> mCa = n x Mw
- 1.82
X
10'3
X
40.078 = 0.073 ج
con. Ca/100 ml = ءX100
= —
Xl00 = 0.0365
س ه ها / ة
200
Example:
An iron ore was analyzed by dissolving a 1.1324
ج
sample
in concentrated HC1. The resulting solution was diluted with
water, and the iron
(II)
was precipitated as the hydrous oxid
Fe20 3 .XH20 by the addition of NH 3. after filtration and
Fe20 3 (159.69 g/mol). Calculate (a) the % Fe (55.847
g/mol) and (b) the % Fe30 4 (231.54 g/mol) in the sample.

خام
لل حديد
تم
ت طيل ه
بإذابة
عينة
م ن
هذا
الخام
و و ز ن ه ا
رج
1.1324
)
ف ي
م حلو ل
(
HC1
)
مركز
،
والم حل و ل
النات ج
تم
ت خفيفه
بالماء
،
و أ ي و ن
+
F e3
ت م
ترسيبه
عل ى
شكل
أوكسيد
م ا ئ ي
ة
ض ا ف
و ب إ
ه
(
NH3
)
ب ع د
فلترته
و غ سله
ثم
حرق
الراسب
عند
در جة
ح را رة
مرتفعة
ل ي ع ط ى
مرك ب
نق ى
من
(
M w=159.69 g/mol) (Fe20 3
)
وزنه
(
0.5394
g
)
احسب
:
a
)
)
التركيز
الموئي
ل
Mw=55.847 g/mol) %Fe
)
رم
التركيز
الموئي
ل
(
Mw=231.54 g/mol) %Fe30 4
:
Solution
عزيزي
الطالب
ال
ي ه شا
كثرة
المعطيا ت
بالسؤال
لكن
ما
يهمنا
ه و
ا ل ن ا ت ج
الن هائ ى
وال م طل و ب
.
م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
ة
ح ل ي ل
ا ل ت
m
n,
ت
-
Fe2°3
M
w
n„ „ = a 5 3 9 4 = 3 .3 7 7 x l O '3 mol
159.69
a
)
2
mol Fe
---«
؛
0 , 1
mo]
F e
3 .3 7 7 8 X 1 0 5
™©IFe20 3 —
* X m o lF e
nFc = 2
X
3.3772 x l O '3 = 6.7556
X
10‘3 m ol
m Fe = n x M w
= 6.7556
X
10'3
X
55.847 = 0.37728
g

100%
X
—
قل ت
!
—
=
Fe
%
ثت<
sample
١٢
؛
33.32%
=
=
7 2 8 X l0 0 %
1.1324
م ف ت ا ح
ا إل ب د ا ع
ء
م ا
ل ل ك ي
ا ل ت ح ل م ي ل م ة
b)
nFe= 6.7556
X
10‘3
mol
(
زمن
الفرع
السابق
3 mol Fe
> 1 mol FeX )4
6 .7 5 5 6 x 1 0 3 m olF e
ى
mol
= 6 J 5 5 ^ XlQ = 2 .2 5 1 8 x l0 ~ 3mol
m , t,x(>t= n x M w = 2 . 2 5 \ S x \ 0 ^ x 2 3 l . 5 4 = 5 2 l 4 g
% F e ,0 4 =
' ° ' x!00%
^sample
4%
م
46
=
%
00
ا
<>
5 2 1 4
ل
0
=
1.1324
Example:
A 0.2356 g sample containg only NaCI (58.44 g/mol) and
BaCl2 (208.23 g/mol) yielded 0.4637 g of dried AgCl
' 43. 32
ا
g/mol). Calculate the percent o f each halogen
compound in the sample.
