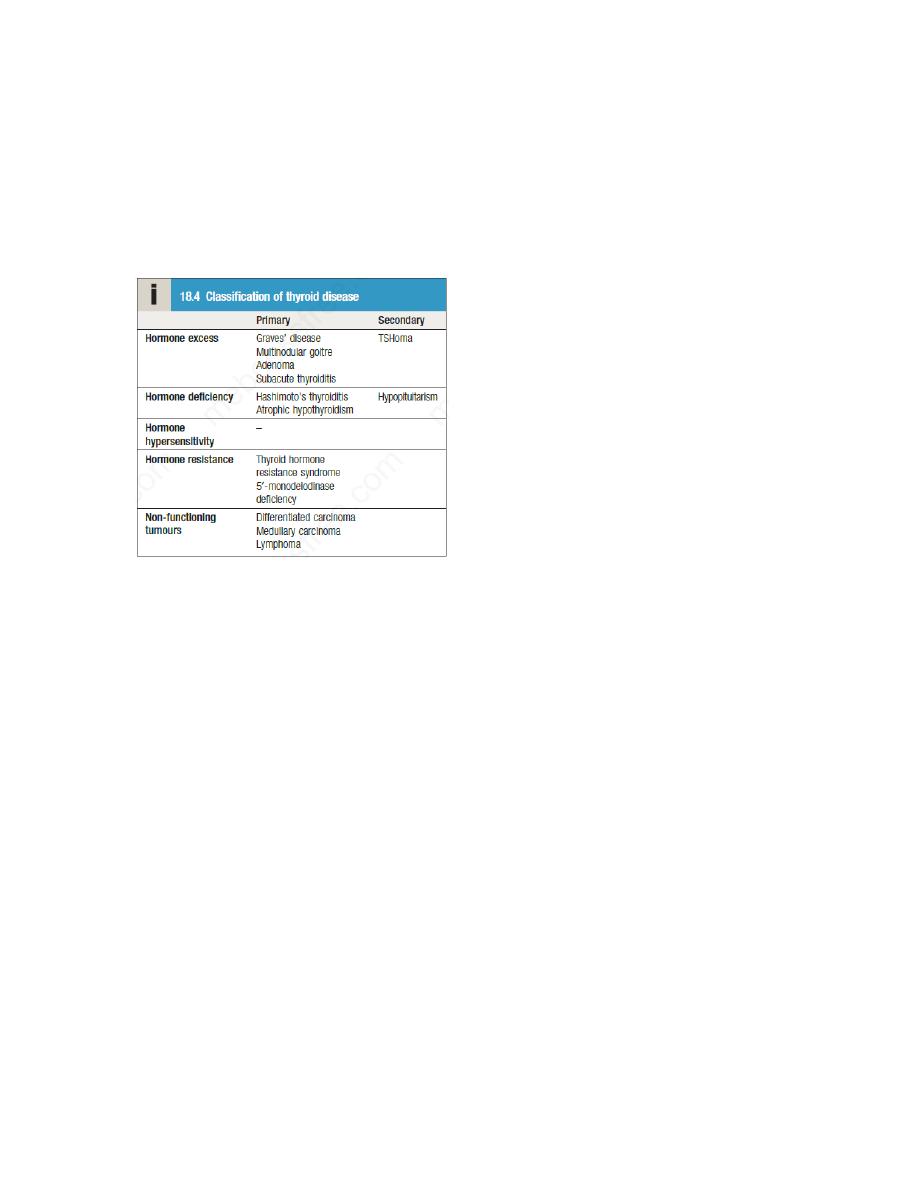
Thyroid gland
Diseases of the thyroid predominantly affect females and are common, occurring in about 5% of
the population. The thyroid axis is involved in the regulation of cellular differentiation and
metabolism in virtually all nucleated cells, so that disorders of thyroid function have diverse
manifestations. Structural diseases of the thyroid gland, such as goitre, commonly occur in
patients with normal thyroid function.
Functional anatomy, physiology
and investigations
The parafollicular C cells secrete calcitonin, which is of no apparent physiological significance in
humans. The follicular epithelial cells synthesise thyroid hormones by incorporating iodine into
the amino acid tyrosine on the surface of thyroglobulin (Tg), a protein secreted into the colloid
of the follicle. Iodide is a key substrate for thyroid hormone synthesis; a dietary intake in excess
of 100 μg/day is required to maintain thyroid function in adults. The thyroid secretes
predominantly thyroxine (T4) and only a small amount of triiodothyronine (T3); approximately
85% of T3 in blood is produced from T4 by a family of monodeiodinase enzymes which are
active in many tissues, including liver, muscle, heart and kidney.
T4 can be regarded as a pro-hormone, since it has a longer half-life in blood than T3
(approximately 1 week compared with approximately 18 hours), and binds and activates thyroid
hormone receptors less effectively than T3. T4 can also be converted to the inactive metabolite,
reverse T3. T3 and T4 circulate in plasma almost entirely (> 99%) bound to transport proteins,
mainly thyroxine-binding globulin (TBG). It is the unbound or free hormones which diffuse into
tissues and exert diverse metabolic actions.
Production of T3 and T4 in the thyroid is stimulated by thyrotrophin (thyroid-stimulating
hormone, TSH), a glycoprotein released from the thyrotroph cells of the anterior pituitary in
response to the hypothalamic tripeptide, thyrotrophin-releasing hormone (TRH).
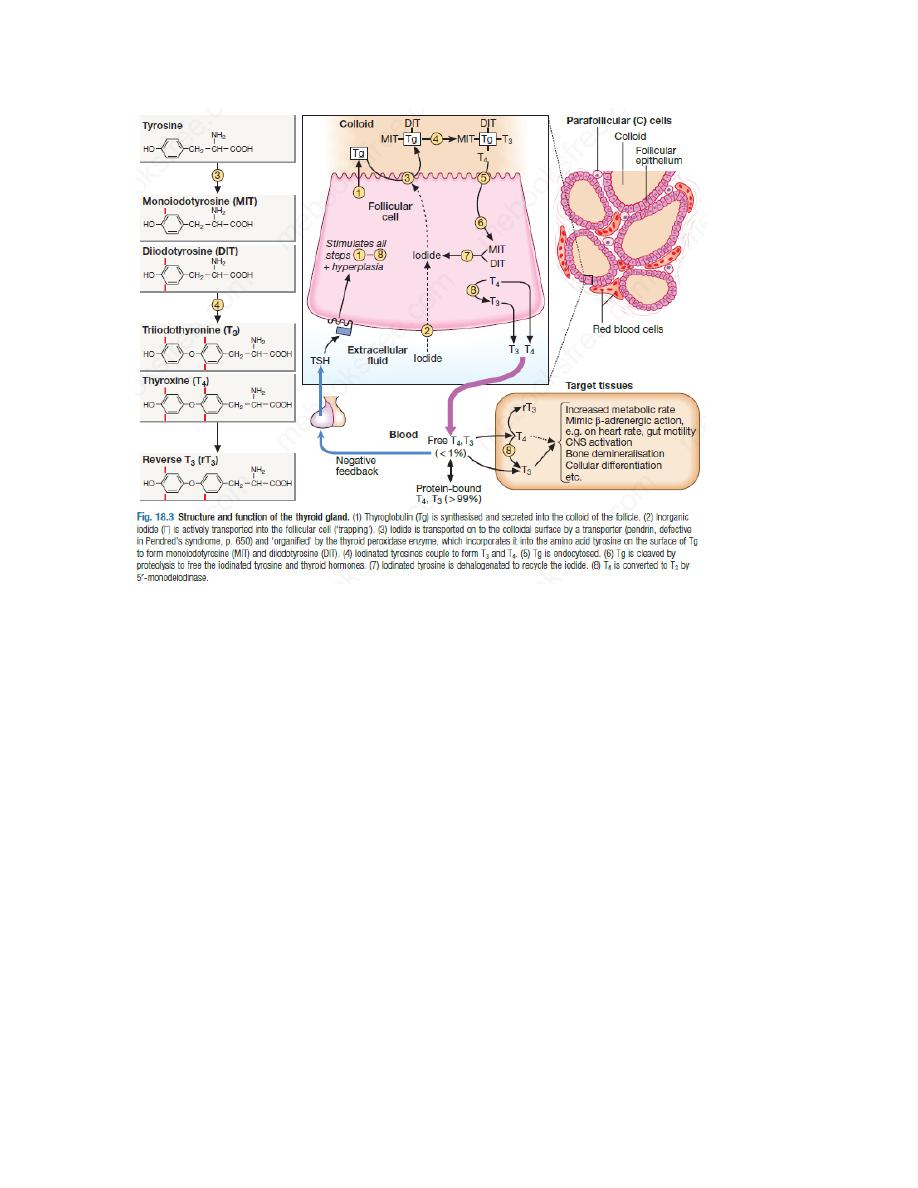
There is a negative feedback of thyroid hormones on the hypothalamus and pituitary such that
in thyrotoxicosis, when plasma concentrations of T3 and T4 are raised, TSH secretion is
suppressed. Conversely, in hypothyroidism due to disease of the thyroid gland, low T3 and T4
are associated with high circulating TSH levels.
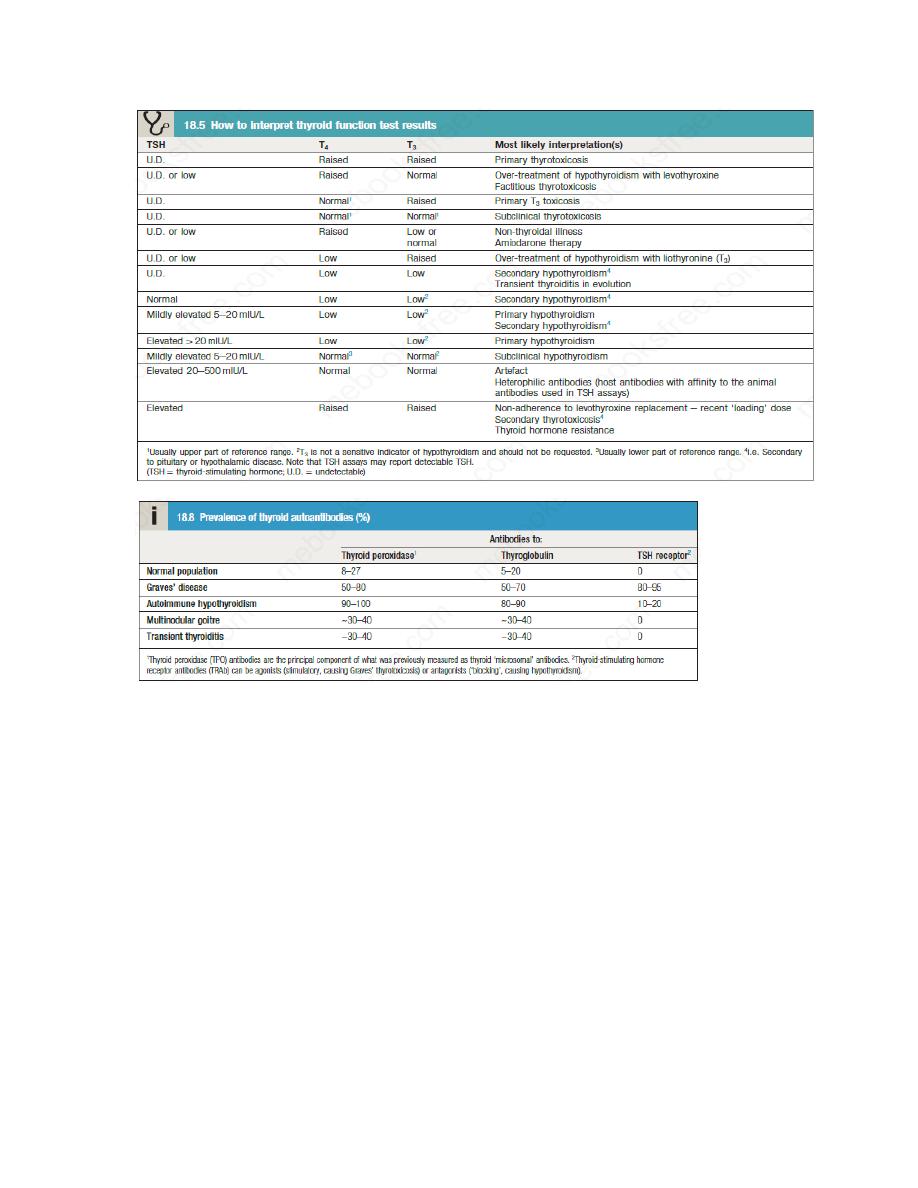
TSH is usually regarded as the most useful investigation of thyroid function. However,
interpretation of TSH values without considering thyroid hormone levels may be misleading in
patients with pituitary disease; for example, TSH is inappropriately low or ‘normal’ in secondary
hypothyroidism.
Other modalities commonly employed in the investigation of thyroid disease include
measurement of antibodies against the TSH receptor or other thyroid antigens, radioisotope
imaging, fine needle aspiration biopsy and ultrasound.
Presenting problems in thyroid disease
The most common presentations are hyperthyroidism(thyrotoxicosis), hypothyroidism and
enlargement of the thyroid(goitre or thyroid nodule). Widespread availability of thyroid function
tests has led to the increasingly frequent identification of patients with abnormal results who
either are asymptomatic or have non-specific complaints such as tiredness and weight gain.
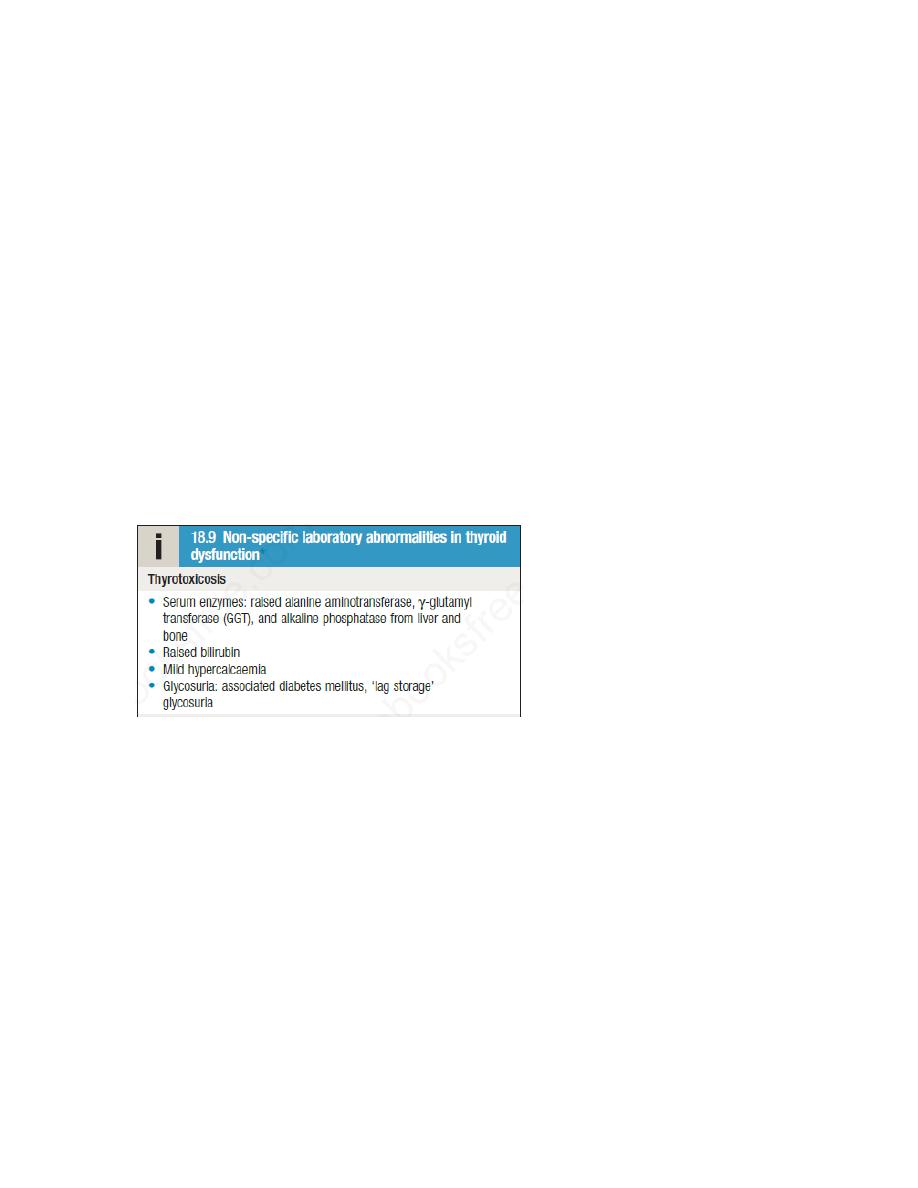
Thyrotoxicosis
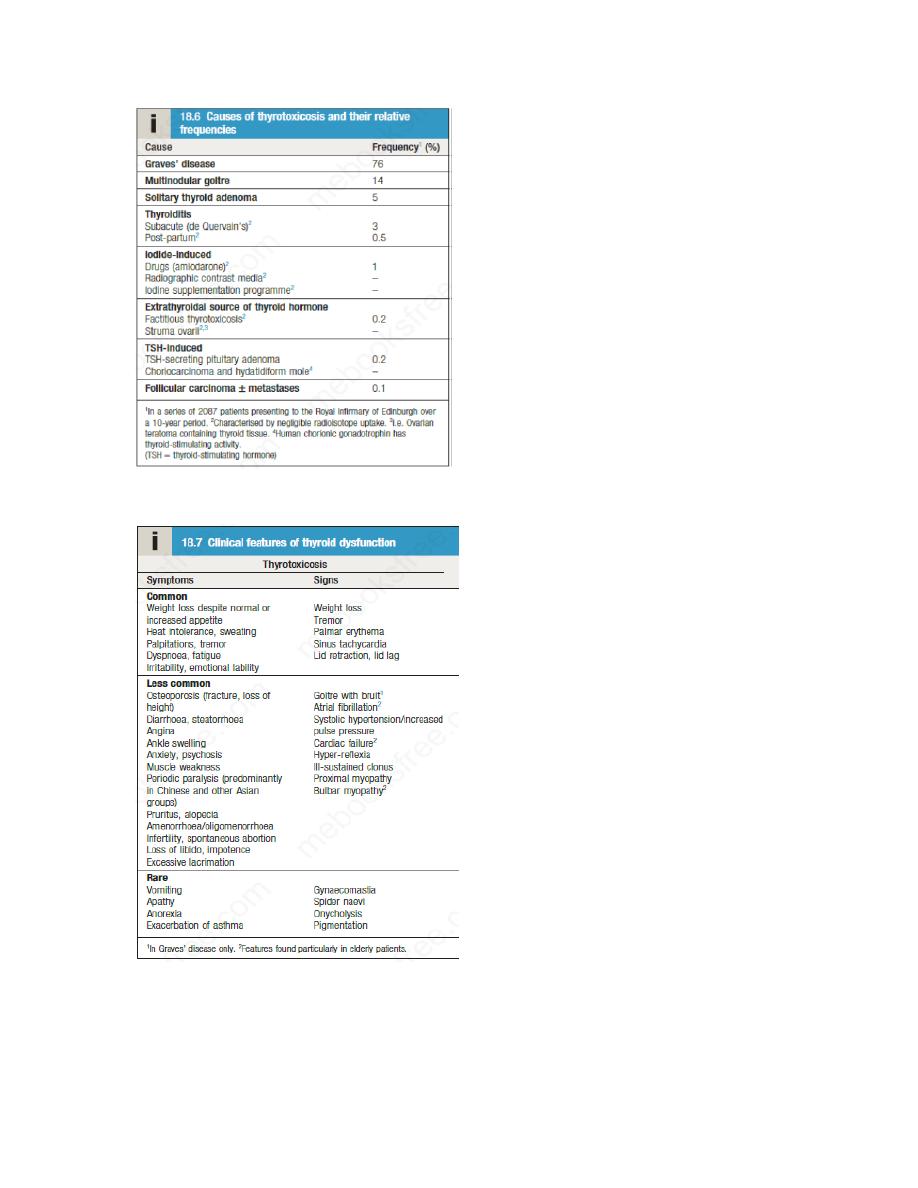
Thyrotoxicosis describes a constellation of clinical features arising from elevated circulating
levels of thyroid hormone. The most common causes are Graves’ disease, multinodular goitre
and autonomously functioning thyroid nodules (toxic adenoma) . Thyroiditis is more common in
parts of the world where relevant viral infections occur, such as North America.
Clinical assessment
The most common symptoms are weight loss with a normal or increased appetite, heat
intolerance, palpitations, tremor and irritability. Tachycardia, palmar erythema and lid lag are
common signs. Not all patients have a palpable goitre, but experienced clinicians can
discriminate the diffuse soft goitre of Graves’ disease from the irregular enlargement of a
multinodular goitre. All causes of thyrotoxicosis can cause lid retraction and lid lag, due to
potentiation of sympathetic innervation of the levator palpebrae muscles, but only Graves’
disease causes other features of ophthalmopathy, including periorbital oedema, conjunctival
irritation, exophthalmos and diplopia. Pretibial myxedema and the rare thyroid acropachy (a
periosteal hypertrophy, indistinguishable from finger clubbing) are also specific to
Graves’disease.
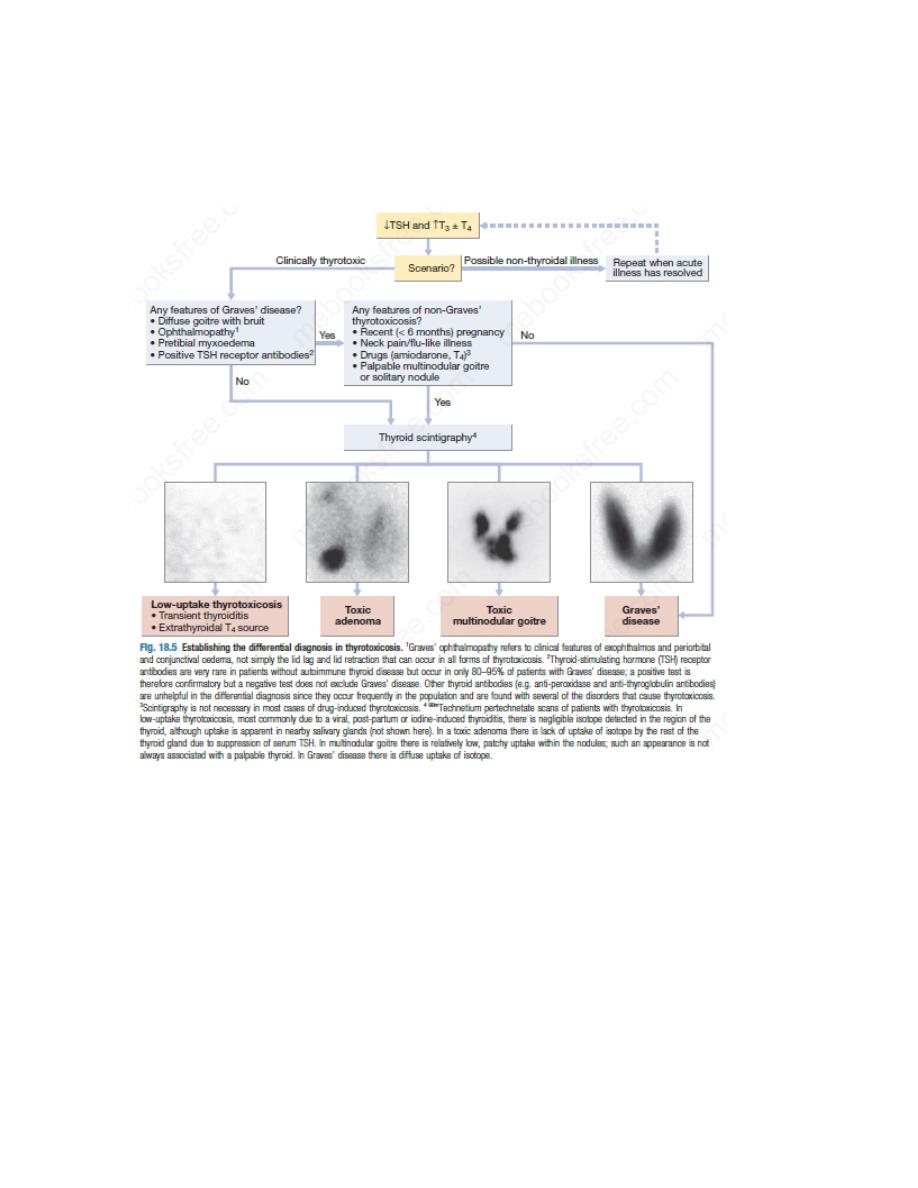
Investigations
The first-line investigations are serum T3, T4 and TSH. If abnormal values are found, the tests
should be repeated and the abnormality confirmed in view of the likely need for prolonged
medical treatment or destructive therapy. In most patients, serum T3 and T4 are both elevated,
but T4 is in the upper part of the reference range and T3 is raised (T3 toxicosis) in about 5%.
Serum TSH is undetectable in primary thyrotoxicosis, but values can be raised in the very rare
syndrome of secondary thyrotoxicosis caused by a TSH-producing pituitary adenoma. When
biochemical thyrotoxicosis has been confirmed, further investigations should be undertaken to
determine the underlying cause, including measurement of TSH receptor antibodies (TRAb,
elevated in Graves’ disease) and radioisotope scanning.
Other investigation like an electrocardiogram (ECG) may demonstrate sinus tachycardia or atrial
fibrillation.
Radio-iodine uptake tests measure the proportion of isotope that is trapped in the whole gland
but have been largely superseded by 99mtechnetium scintigraphy scans, which also indicate
trapping, are quicker to perform with a lower dose of radioactivity, and provide a higher-
resolution image. In low-uptake thyrotoxicosis, the cause is usually a transient thyroiditis.
Occasionally, patients induce ‘factitious thyrotoxicosis’ by consuming excessive amounts of a
thyroid hormone preparation, most often levothyroxine. The exogenous levothyroxine
suppresses pituitary TSH secretion and hence iodine uptake, serum thyroglobulin and release of
endogenous thyroid hormones. The T4:T3 ratio (typically 30 : 1 in conventional thyrotoxicosis) is
increased to above 70 : 1 because circulating T3 in factitious thyrotoxicosis is derived exclusively
from the peripheral monodeiodination of T4 and not from thyroid secretion. The combination of
negligible iodine uptake, high T4:T3 ratio and a low or undetectable thyroglobulin is diagnostic.

Management
Definitive treatment of thyrotoxicosis depends on the underlying cause and may include
antithyroid drugs, radioactive iodine or surgery. A non-selective β-adrenoceptor antagonist (β-
blocker), such as propranolol (160 mg daily) or nadolol (40–80 mg daily), will alleviate but not
abolish symptoms in most patients within 24–48 hours. Beta-blockers should not be used for
long-term treatment of thyrotoxicosis but are extremely useful in the short term, while patients
are awaiting hospital consultation or following 131I therapy. Verapamil may be used as an
alternative to β-blockers, e.g. in patients with asthma, but usually is only effective in improving
tachycardia and has little effect on the other systemic manifestations of thyrotoxicosis.
Atrial fibrillation in thyrotoxicosis
Atrial fibrillation occurs in about 10% of patients with thyrotoxicosis. The incidence increases
with age, so that almost half of all males with thyrotoxicosis over the age of 60 are affected.
Moreover, subclinical thyrotoxicosis is a risk factor for atrial fibrillation.
Characteristically, the ventricular rate is little influenced by digoxin but responds to the addition
of a β-blocker. Thromboembolic vascular complications are particularly common in thyrotoxic
atrial fibrillation so that anticoagulation is required, unless contraindicated. Once thyroid
hormone and TSH concentrations have been returned to normal, atrial fibrillation will
spontaneously revert to sinus rhythm in about 50% of patients but cardioversion may be
required in the remainder.
Thyrotoxic crisis (‘thyroid storm’)
This is a rare but life-threatening complication of thyrotoxicosis. The most prominent signs are
fever, agitation, delirium, tachycardia or atrial fibrillation and, in the older patient, cardiac
failure. The thyrotoxic crisis is a medical emergency and has a mortality of 10% despite early
recognition and treatment. It is most commonly precipitated by infection in a patient with
previously unrecognised or inadequately treated thyrotoxicosis. It may also develop in known
thyrotoxicosis shortly after thyroidectomy in an ill-prepared patient or within a few days of 131I
therapy, when acute radiation damage may lead to a transient rise in serum thyroid hormone
levels.
Patients should be rehydrated and given propranolol, either orally (80 mg 4 times daily) or
intravenously (1–5 mg 4 times daily). Sodium ipodate (500 mg per day orally) will restore serum
T3 levels to normal in 48–72 hours. This is a radiographic contrast medium that not only inhibits
the release of thyroid hormones but also reduces the conversion of T4 to T3, and is therefore
more effective than potassium iodide or Lugol’s solution. Dexamethasone (2 mg 4 times daily)
and amiodarone have similar effects. Oral carbimazole 40–60 mg daily should be given to inhibit
the synthesis of new thyroid hormone.If the patient is unconscious or uncooperative,
carbimazole can be administered rectally with good effect but no preparation is available for
parenteral use. After 10–14 days the patient can usually be maintained on carbimazole alone.
