
Thi-Qar University
Dr Dhafer A. Alghezi
College of Medicine
Third Year
Medical Immunology Lecture 4&5
1
Antigen recognition molecules
2. T-cells receptor (TCR): It represents another antigen recognition molecule. TCR is a
molecule found on the surface of T cells, or T lymphocytes that are responsible for recognizing
fragments of the antigen as peptides bound to major histocompatibility complex (MHC)
molecules.
Structure of TCR:
TCR is a heterodimeric molecule comprising an alpha (α) chain and a beta (β) chain or gamma
and delta chains linked by a disulphide bond. In humans, the great majority of cells generate
an alpha (α) chain and a beta (β) chain TCR, whereas in 5% of T cells the TCR consists of
gamma and delta (γ/δ) chains. Each polypeptide chain consists of two extracellular Ig-like
domains anchored in the plasma membrane by a transmembrane peptide which has a short
cytoplasmic tail.
The overall feature of the structure shows that the α and β chains fold into a structure that
resembles the Fab-region of Ab. The N-terminal domains of the α and β polypeptides are
known as CDRs or hypervariable region. These are clustered together to form an MHC-Ag-
binding site which is analogous to the Ag-binding site on Ab.
TCR is associated physically with a series of polypeptides, called CD3. The CD3 component
shows no diversity. CD3 contains four invariant polypeptides, called gamma, delta, epsilon,
and sigma. The structure of the CD3-TCR complex is (alpha, beta) 2, gamma, delta, (epsilon)
2, (sigma) 2. The negatively charged CD3-chains are essential for the assembly of the TCR
complex with positively charged chains. The CD3 sigma gene is on a different chromosome
from the CD3 alpha, delta, and epsilon- gene complex.
The intracytoplasmic section of sigma chain is called immunoreceptor tyrosine activation
motifs (ITAM a) target for phosphorylation by specific protein kinases and it's essential for T-
cell activation. ITAM is also present in Ig-alpha and beta (CD79) which are involved in B-cell
activation and with CD16 which involved in the activation of macrophage and NK-cells.
The α, βTCR is present on more than 95% of the peripheral T-cells and on the majority of
TCR-expressing thymocytes. By contrast, T-cells expressing the gamma delta-TCR often have

Thi-Qar University
Dr Dhafer A. Alghezi
College of Medicine
Third Year
Medical Immunology Lecture 4&5
2
defined anatomical locations, they are abundant in various epithelia, such as the epidermis (in
mice) intestinal epithelium, uterus and tongue. They produce a lower level of some cytokines
than alpha-beta T-cells; they may be involved in the control and modulation of responses
mediated by alpha-beta T-cells.
B & T cell receptors have several similarities:
❖ Even though the TCR is a heterodimer, the TCR chains has constant and variable
regions
❖ TCR germ line DNA for each of the chains is organized into multigene families with
multiple V region segments (with rearrangement of V, J – for α& γ chains and V, D, J for β
& δ chains) with one or more C region gene segments.
❖ The mechanisms for T cell V region gene segment rearrangement are similar to B cells
rearranging Ig germline DNA
❖The mechanisms generating TCR diversity are similar to those seen in generating Ab
diversity.
❖ It's structurally related since both are folded into domains.
T cell receptor differs from the B cell receptor in different ways:
❖ The T cell does not secrete its receptor like the B cell does so any assessment of
receptor structure and specificity has to rely on complex cellular assays.
❖ TCR has one antigen binding site, whereas, Igs have at least two.
❖ T cell can recognize and bind antigens just when are presented by MHC,
whereas, Ig can recognize free antigens.
❖ TCR can be activated by protein antigens (not CHO antigens). In contrast, Ig can
recognize intact molecules proteins, carbohydrates, and lipids.

Thi-Qar University
Dr Dhafer A. Alghezi
College of Medicine
Third Year
Medical Immunology Lecture 4&5
3
Genes of TCR:
The alpha and gamma loci have sets of V and J-genes (like an Ig - light chain) and beta and
delta loci have set of V, D, and J-genes (like Ig-heavy chain). Diversification of the TCR gene
occurs by recombination between V, D, and J segments. Extensive diversity is generated in the
joining process, as not only are VDJ-arrangement possible, but also V-J and VDDJ-joins.
Major histocompatibility complex molecules (MHC) or Human Leukocyte Antigens
(HAL)
The human MHC, which is known as the human leukocyte Antigen (HLA) -system is a cluster
of genes that are located on a short arm of the chromosome 6. The molecules presented Ag to
T-cells are mostly encoded within the MHC. This gene complex containing more than 100
separate gene loci. MHC I&II are highly polymorphic cell- surface structures. The remaining
genes in the complex are very diverse. They including some that encode complement system
molecules (C4, C2, and factor-B), some cytokines (TNF), enzyme, heat-shock proteins and
some molecules involved in Ag processing, they have collectively been called MHC III gene
products.
A) MHC I
The HLA or H2 (MHC of mice) molecules are heterodimers formed by two nonidentical
polypeptide chains: an α chain and β chain. In MHC I, there are HLA-A, HLA-B and HLA-c
loci.
The class I heavy chain consists of three extracellular domains, designated alpha1, 2&3, a
transmembrane region and a cytoplasmic tail. The alpha 2&3 domains have intrachain
disulphide bonds. The alpha 3 domain is structurally homologous to Ig- constant domains, and
contains a site which interacts with CD8 on cytotoxic T-cells. β2-microglobulin is post
synthetically and noncovalently associated with the major polypeptide chain.
The most polymorphic areas of the molecule are located within and on the edges of a groove
formed at the junction of the helical α1 and β2 domains. This groove is usually occupied by a
Thi-Qar University
Dr Dhafer A. Alghezi
College of Medicine
Third Year
Medical Immunology Lecture 4&5
4
short peptide (10–11 residues), usually of endogenous origin. The α3 domain shows much less
genetic polymorphism and, together with β2-microglobulin, is like a frame supporting the
deployment in space of the more polymorphic α1 and α2 domains. In addition, the α3 domain
has a binding site for the CD8 molecule characteristic of cytotoxic T cells.
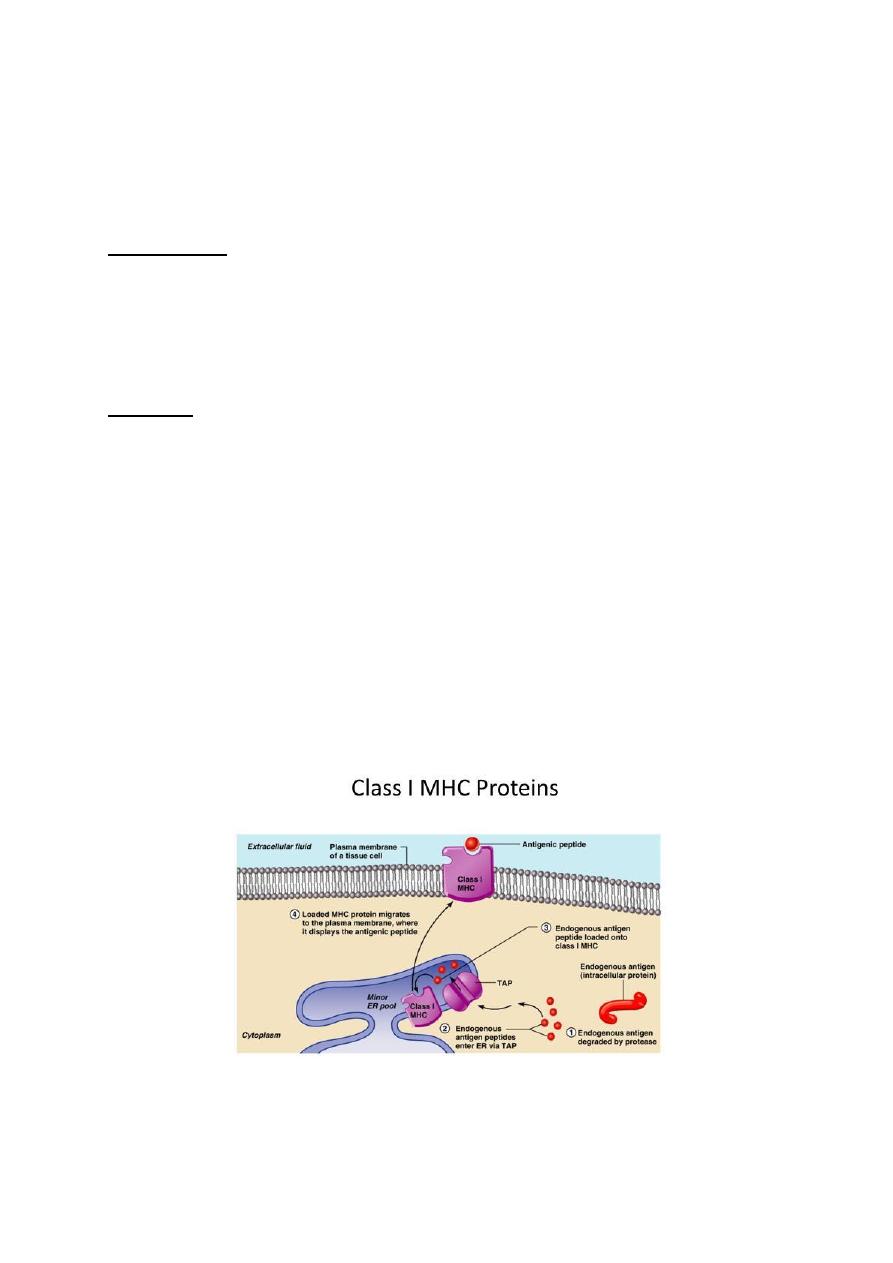
Class I protein:
It is a glycoprotein found on the surface of all nucleated cells. The peptides which bind to MHC
I molecules come from proteins synthesized within the cell, which are broken down and
transported via TAP (transporter associated with antigen processing) to the endoplasmic
reticulum, thus peptide of an appropriate size to occupy the MHC I-binding groove.
B) MHC II
The Class II genes in human are DP, DQ & DR. MHC II is a heterodimer of heavy α and light
(β) glycoprotein chains. The α and β chains have the same overall structures. An extracellular
portion comprising two domains (α1&2 or β1&2) is connected by a short sequence to a
transmembrane region and the cytoplasmic domain.
There are many differences between the primary structure of both MHC I& II. First, class II
gene products are not associated with β2-microglobulin. Each polypeptide chain has two
extracellular domains (α1 and α2; β1 and β2). The NH2 terminal ends of the α1 and β1 domains
contain hypervariable regions. Both chains are encoded by genes in the MHC region on
chromosome 6. The class II groove is more open than that of class I, so that longer peptides
can be accommodated. As the class II groove is not closed at the ends, peptides bound to MHC
II molecule extend out of the ends of the groove. The B2-domain does contain a binding site
for CD4.

Thi-Qar University
Dr Dhafer A. Alghezi
College of Medicine
Third Year
Medical Immunology Lecture 4&5
5
Class II protein:
It’s a glycoprotein found in certain cells such as macrophage, B cells, dendritic cells of spleen
and Langerhans cells of skin. It’s an exogenous protein that comes from outside the cells.
Peptides bind to MHC II come from proteins which have been internalized by the cell and then
degraded. These peptides are less uniform in size and may be trimmed once they have bound
to the MHCII-molecule.
Invariant Chain (Ii, CD74)
The invariant chain (Ii) is a polypeptide involved in the formation and transport of MHC class
II protein. The cell surface form of the invariant chain is known as CD74. In the endoplasmic
reticulum (ER), a region of Ii interacts with the binding groove to prevent binding of
endogenous peptides. This region acts as “chaperone” to allow the MHC class II molecule + Ii
to leave the ER. The Ii is cleaved by cathepsin S (cathepsin L in cortical thymic epithelial
cells), leaving only a small fragment called CLIP remaining bound to the groove of MHC class
II molecules. The rest of the Ii is degraded. CLIP blocks peptide binding until HLA-DM
interacts with MHC II, releasing CLIP and allowing other peptides to bind. The stable MHC
class-II with antigen complex is then presented on the cell surface. Without CLIP, MHC class
II aggregates, disassemble, and/or denature in the endosomes, and proper antigen presentation
is impaired.
Interaction of the TCR with MHC and antigen:
The first and second complementarity determining regions (CDRs) of the TCR α and β chains
are positioned over residues near the N and C-terminal of the presented polypeptide, and the

Thi-Qar University
Dr Dhafer A. Alghezi
College of Medicine
Third Year
Medical Immunology Lecture 4&5
6
third CDR, each chain lying at the center of the TCR-binding site, are positioned over the
central residues of the peptide which protrude from the groove. Residues from each of the CDR
are positioned to interact with residues from the MHC molecule.
Each T-cell may express 100000 receptors and each APCs has a similar number of MHC
molecules. CD4 or CD8 can help stabilize the interaction of the TCR and MHC- peptide. The
affinity of Ag-MHC for the TCR is very important because it determines the degree to which
that the T-cell becomes activated. Each lymphocyte binds to just one Ag using its TCR.
The biological importance of MHC
❖ Antigen recognition by T cells; CD8 T cells............... MHC I molecules whereas, CD4 T
cells..................MHC II molecules
❖ It’s also important in autoimmune diseases which occur in people who carry MHC genes
such as HLA- B27 in Ankylosing spondylitis.
❖ Success of organ transplantation is determined by the compatibility of MHC genes of donor
and recipient.

Thi-Qar University
Dr Dhafer A. Alghezi
College of Medicine
Third Year
Medical Immunology Lecture 4&5
7
Immunological effecter functions
There are numerous ways in which the immune system can destroy pathogens, each way being
suited to a given type of infection. In dealing with extra-cellular pathogens, the immune system
aims to destroy the pathogen itself and neutralize its products and in response to intracellular
pathogens, there are two options, either the T-cells can destroy the infected cells-cytotoxicity-
or they can activate the cell to deal with the pathogen for itself.
Upon entry to a host, the pathogens (bacteria or fungi) by their surface act as a suitable
activator for the alternative pathway of the complement, C3b act as an opsonin and promote
binding of such Ag (pathogen) to APC or to phagocytes (macrophage or neutrophils) the cell
that recruited from circulation (blood) by the chemotactic effect of C5a and C3a.
If the phagocytic cells are able to eliminate the pathogens, macrophage release inhibitory
molecules (e.g. TGFb, PGE2, IL10) which suppress the inflammatory and the immune
responses, including the T-cells activation by the APCs. If the macrophage not able to eliminate
the pathogen: Macrophage priming by IFN-gamma and triggered to release various products,
which promote an inflammatory reaction, recruit other cells, in addition produce IL6 and IL1
to act as circulatory mediators of the acute phase response and stimulate the thermoregulatory
centers in the central nervous system, muscle, and fat stores and the neuroendocrine system to
increase the body temperature (fever).
APCs recognize, attach, internalize and process the pathogen by degradation and if it is not
able to eliminate the pathogen, peptide fragments of the pathogen become bound to MHCI and
II molecule and re-express at their surface to be presented to T-cells, the presentation play a
central role in initiating and maintaining an appropriate immune response to Antigen, the class
I molecule associated with endogenously synthesized peptides, whereas MHC II are loaded
with exogenous peptides in an endosomal compartment.
The process of T-cell activation generally take place in the nearest lymph node to the infection.
The T-cells activation required two signals, the first signal come from the TCR-recognition of
a specific peptide lodged in the peptide binding groove of the MHC-molecule and the second
signal from the co-stimulatory molecule interaction. The T-cell activation induces enzyme
cascades, leading to the production of IL2 and the high affinity IL2-receptor on the T-cells.
Thus, the type of MHC molecules and costimulatory molecules determine whether CMI or
humoral mediated immune response will occur.
