
Thi-Qar University. Immunology
College of medicine Lect: 7
Microbiology Department Dr Dhafer Alghezi
Phagocytosis
Phagocytosis (“phago”=eat, “cyte”=cell) is a specific form of endocytosis and represents a
cellular process used to ingest and eliminate particles larger than 0.5 μm in diameter,
including microorganisms, foreign substances, and apoptotic cells. Cells that perform
phagocytes.
Phagocytes:
They are protected the body by ingesting harmful foreign particles, bacteria, and dead cells.
Phagocytes are called "professional" or "non-professional" depending on how effective they
are at phagocytosis. The professional phagocytes are responsible of removing
microorganisms and of presenting antigens to lymphocytes in order to activate an adaptive
immune response. They include many types of white blood cells such as neutrophils,
monocytes, macrophages, mast cells, and dendritic cells. In contrast, fibroblasts, epithelial
cells, and endothelial cells can also accomplish phagocytosis with low-efficiency and are thus
described as non-professional phagocytes. These cells cannot ingest microorganisms, but are
important in eliminating dead cells and maintaining homeostasis.
The main difference between professional and non-professional phagocytes is that the
professional phagocytes have molecules called receptors on their surfaces that can detect
harmful objects, such as bacteria, that are not normally found in the body. Numerous
receptors are involved in phagocytosis such as complement receptors and Fc receptors are
particularly important for the recognition and phagocytosis of opsonized microbes and other
solid matter.
Other receptors, including opsonin receptors, scavenger receptors, and Toll-like
receptors, are also important in the uptake of many pathogenic microorganisms. Opsonin
receptors increase the phagocytosis of bacteria that have been coated with immunoglobulin G
(IgG) antibodies or with complement. Scavenger receptors bind to a large range of molecules
on the surface of bacterial cells, and Toll-like receptors—so called because of their similarity
to well-studied receptors in fruit flies that are encoded by the Toll gene—bind to more
specific molecules. Binding to Toll-like receptors increases phagocytosis and causes the
phagocyte to release a group of hormones that cause inflammation.
The general activities of phagocytes are summaries below:
(1)
To survey the tissue compartments and discover microbes, particulate matter (dust,
carbon particles, antigen-antibody complexes, and injured or dead cells).
(2)
To ingest and eliminate these materials.
(3)
To extract immunogenic information (antigens) from foreign matter.
The three main types of phagocytes are neutrophils, monocytes, and macrophages.
1. N
eutrophil
The neutrophil is the primary phagocyte that arrives early at the site of inflammation, usually
within 90 minutes of injury. The neutrophils’ cytoplasmic granules contain enzymes and
other antibacterial substances that are used in destroying and degrading the engulfed
particles. The neutrophil count in the blood often increases greatly during the inflammatory
process, especially with bacterial infections. Increased neutrophil count in the blood is called
neutrophilia. Neutrophils are also a primary component of pus.
2. Eosinophils
The second major polymorphonuclear granulocyte. Eosinophils leave the bone marrow in a
relatively immature state and move directly to the spleen, where they reach maturity. They
spend short time circulating in the blood stream, then they migrate into tissues. Eosinophils
are attracted to sites of parasitic infections and antigen-antibody reactions, though they play
only a minor phagocytic role. The granules of eosinophils contain a protein that is highly
toxic to large parasitic worms that cannot be phagocytized.
3. Monocytes
1

Thi-Qar University. Immunology
College of medicine Lect: 7
Microbiology Department Dr Dhafer Alghezi
The monocytes are the largest of the white blood cells. They help to destroy the causative
agent, aid in the signaling processes of specific immunity, and serve to resolve the
inflammatory process. The monocytes, which migrate in increased numbers into the tissues in
response to inflammatory stimuli, mature into macrophages. This process is marked by an
increase in size and by enhanced development of lysosomes and other organelles.
Macrophages, king of phagocytes, can be classified into fixed (adherent to tissue) or
wandering macrophage. The fixed macrophage concentrates in specific areas that are more
vulnerable to intruders like the lungs or the intestine, whereas, wandering macrophages travel
throughout both blood and lymph streams to perform their job. Specialized macrophages
called histiocytes migrate to a certain tissue and remain there during their lifespan. Examples
are alveolar macrophages (lung), the Kupffer cells in the liver, Langerhans cells in the skin
and macrophages in the spleen, lymph nodes, bone marrow, kidney, and brain. Other
macrophages do not reside permanently in a particular tissue and drift nomadically
throughout the RES. Not only are macrophages dynamic scavengers, but they also process
foreign substances and prepare them for reactions with B and T lymphocytes.
Mechanisms of Phagocytic (steps of phagocytosis)
Step 1: Activation of the Phagocyte
Resting phagocytes are activated by inflammatory mediators such as bacterial products
(bacterial proteins, capsules, LPS, peptidoglycan, teichoic acids, etc.), complement proteins,
inflammatory cytokines, and prostaglandins. As a result, the circulating phagocytes produce
surface glycoprotein receptors that increase their ability to adhere to the inner surface of
capillary walls, enabling them to squeeze out of the capillary and be attracted to the site of
infection.
Step 2: Chemotaxis of Phagocytes (for wandering macrophages, neutrophils, and
eosinophils
Chemotaxis is the movement of phagocytes toward an increasing concentration of some
attractant such as bacterial factors (bacterial proteins, capsules, LPS, peptidoglycan, teichoic
acids, etc.), complement proteins (C5a), chemokines (chemotactic cytokines such as
interleukin-8), fibrin split products, kinins, and phospholipids released by injured host cells.
Some microbes, such as the influenza A viruses,
Mycobacterium tuberculosis
, blood invasive
strains of
Neisseria gonorrhoeae
, and Bordetella pertussis have been shown to block
chemotaxis.
Step 3: Attachment of the Phagocyte to the Microbe or Cell
Attachment of microorganisms is necessary for ingestion. Attachment may be unenhanced or
enhanced.
a. Unenhanced attachment
: It is the innate recognition of pathogen-associated molecular
patterns or PAMPs - components of common molecules such as peptidoglycan, teichoic
acids, lipopolysaccharide, mannans, and glucans common in microbial cell walls but not
found on human cells - by means of endocytic pattern-recognition receptors, such as
scavenger receptors and mannose receptors, on the surface of the phagocytes.
b.
Enhanced attachment: It is the attachment of microbes to phagocytes by way of an
antibody molecule called IgG, the complement proteins C3b and C4b produced during the
complement pathways and acute phase proteins such as mannose-binding lectin (MBL)
and C-reactive protein (CRP). Molecules such as IgG, C3b, and mannose-binding lectin
(MBL) that promote enhanced attachment are called opsonin and the process is also
known as opsonization. Enhanced attachment is much more specific and efficient than
unenhanced.
c. Extracellular trapping with neutrophil extracellular traps (NETs): In response to
certain pathogen associated molecular patterns such as LPS, and certain cytokines such as
2

Thi-Qar University. Immunology
College of medicine Lect: 7
Microbiology Department Dr Dhafer Alghezi
IL-8, neutrophils release DNA and antimicrobial granular proteins. These (NETs) bind to
bacteria, prevent them from spreading, and kill them with antimicrobial proteins.
Some microorganisms are more resistant to phagocytic attachment.
● Capsules can resist unenhanced attachment by preventing the endocytic pattern
recognition receptors on phagocytes from recognizing the bacterial cell wall
components
and
mannose-containing
carbohydrates.
Streptococcus
pneumonia
activates the classical complement pathway, but resists C3b opsonization,
and complement causes further inflammation in the lungs.
● Some capsules prevent the formation of C3 convertase. Without this enzyme, the
opsonin C3b and C4b, as well as the other beneficial proteins are not produced.
● Some capsules simply cover the C3b that does bind to the bacterial surface and prevent
the C3b receptor on phagocytes from making contact with the C3b. This is seen with
the capsule of
Streptococcus pneumoniae
.
● An outer membrane molecule of
Neisseria gonorrhoeae
called Protein II and the
M-protein of
Streptococcus pyogenes
allow these bacteria to be more resistant to
phagocytic engulfment. The M-protein of S. pyogenes, for example, binds factor H of
the complement pathway and this results in the degradation of the opsonin C3b by
factor I and the formation of C3 convertase. S. pyogenes also produces a protease that
cleaves the complement protein C5a.
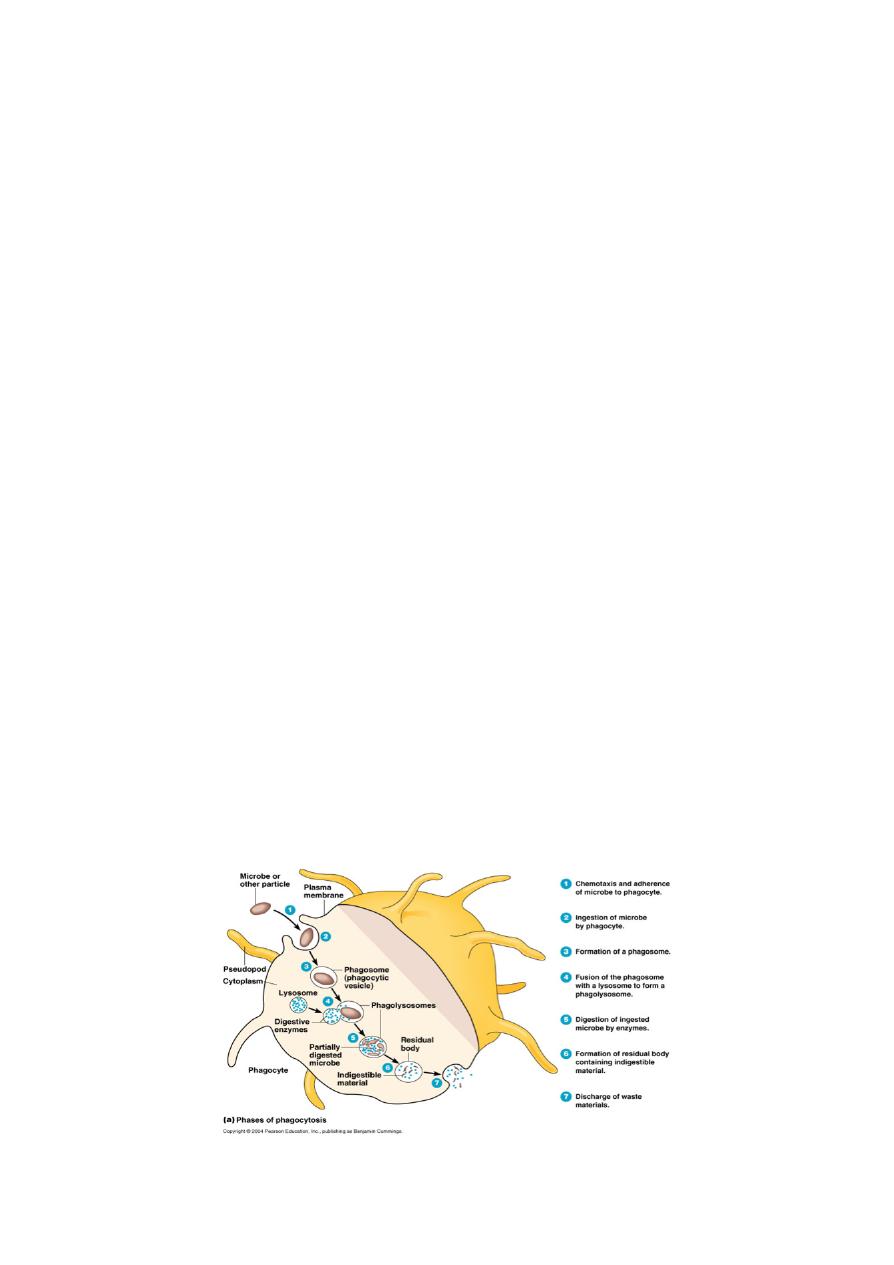
Step 4: Ingestion of the Microbe or Cell by the Phagocyte
Following attachment, polymerization and then depolymerization of actin filaments send
pseudopods out to engulf the microbe and place it in an endocytic vesicle called a
phagosome.
During this process, an electron pump brings protons (H+) into the phagosome. This lowers
the pH within the phagosome to 3.5 - 4.0 so that when a lysosome fuses with the phagosome,
the pH is correct for the acid hydrolases to effectively break down cellular proteins. The
acidification also releases defensins, cathelicidin, and bacterial permeability inducing protein
(BPI), peptides and enzymes that can kill microbes, from a matrix and enabling their
activation.
Intracellular microbes, such as viruses and bacteria that invade host cells, can also be
engulfed once they enter the cytosol of the cell by a process called autophagy. A
membrane-bound compartment called an autophagosome grows around the microbe and the
surrounding cytosol and subsequently delivers it to lysosomes for destruction.
A. Pathogenic
Yersinia
, such as the one that causes plague, contact phagocytes and, by means
of a
type III secretion system, deliver proteins which depolymerize the actin
microfilaments needed for phagocytic engulfment into the phagocytes
B. Some
bacteria,
like
Mycobacterium
tuberculosis,
Salmonella
,
and
Listeria
monocytogenes
can block autophagy.
Step 5: Destruction of the Microbe or Cell
Phagocytes contain membranous sacs called lysosomes produced by the Golgi apparatus that
contain various digestive enzymes, microbicidal chemicals, and toxic oxygen radicals. The
lysosomes travel along microtubules within the phagocyte and fuse with the phagosomes
containing the ingested microbes and the microbes are destroyed.
Some bacteria are more resistant to phagocytic destruction once engulfed.
a. Some bacteria, such as
Legionella pneumophilia
and Mycobacterium species, cause the
phagocytic cell to place them into an endocytic vacuole via a pathway that decreases their
exposure to toxic oxygen compounds.
b. Some bacteria, such as
Salmonella
, are more resistant to toxic forms of oxygen and to
defensins (toxic peptides that kill bacteria).
3
Thi-Qar University. Immunology
College of medicine Lect: 7
Microbiology Department Dr Dhafer Alghezi
c. Some bacteria, such as
Shigella flexneri
and the spotted fever Rickettsia, escape from the
phagosome into the cytoplasm prior to the phagosome fusing with a lysosome
There are 2 killing systems in neutrophils and macrophages: the oxygen-dependent
system and the oxygen-independent system.
1.
The oxygen-dependent system: production of reactive oxygen species (ROS)
The cytoplasmic membrane of phagocytes contains the enzyme oxidase which converts
oxygen into superoxide anion (O2-). This can combine with water by way of the enzyme
dismutase to form hydrogen peroxide (H2O2) and hydroxyl (OH) radicals.
In the case of neutrophils, but not macrophages, the hydrogen peroxide can then combine
with chloride (Cl2-) ions by the action of the enzyme myeloperoxidase (MPO) to form
hypochlorous acid (HOCL), and singlet oxygen. In macrophages, nitric oxide (NO) can
combine with hydrogen peroxide to form peroxynitrite radicals. (In addition to ROS and NO,
macrophages secrete inflammatory cytokines such as TNF-alpha, IL-1, IL-8, and IL-12 to
promote an inflammatory response.)
These compounds are very microbicidal because they are powerful oxidizing agents which
oxidize most of the chemical groups found in proteins, enzymes, carbohydrates, DNA, and
lipids. Lipid oxidation can break down cytoplasmic membranes. Collectively, these oxidizing
free radicals are called reactive oxygen species (ROS).
Oxidase also acts as an electron pump that brings protons (H+) into the phagosome. This
lowers the pH within the phagosome so that when lysosomes fuse with the phagosome, the
pH is correct for the acid hydrolases, like elastase, to effectively break down cellular proteins.
In addition to phagocytes using this oxygen-dependant system to kill microbes intracellularly,
neutrophils also routinely release these oxidizing agents, as well as acid hydrolases, for the
purpose of killing microbes extracellularly. These agents, however, also wind up killing the
neutrophils themselves as well as some surrounding body cells and tissues.
2. The oxygen-independent system
Some lysosomes contain defensins , cationic peptides that alter cytoplasmic membranes;
lysozyme, an enzyme that breaks down peptidoglycan, lactoferrin, a protein that deprives
bacteria of needed iron; cathepsin G, a protease that causes damage to microbial membranes;
elastase, a protease that kills many types of bacteria; cathelicidins, proteins that upon
cleavage are directly toxic to a variety of microorganisms; bactericidal permeability inducing
protein (BPI ), proteins used by neutrophils to kill certain bacteria by damaging their
membranes; collagenase ; and various other digestive enzymes that exhibit antimicrobial
activity by breaking down proteins, RNA, phosphate compounds, lipids, and carbohydrates.
4
