
Biochemistry 3070
– Amino Acids & Proteins
1
Amino Acids
&
Proteins
Biochemistry 3070

Biochemistry 3070
– Amino Acids & Proteins
2
• Proteins are linear copolymers built from
monomeric units called amino acids.
• Twenty amino acids are commonly found in
proteins.
• These amino acids contain a variety of different
functional groups:
– Alcohols
(R-OH)
– Phenols
(Ph-OH)
– Carboxylic acids
(R-COOH)
– Thiols
(R-SH)
– Amines
(R-NH
2
)
– and others…

Biochemistry 3070
– Amino Acids & Proteins
3
• Protein function depends on both
– amino acid content, and
– amino acid sequence.
• Protein fold into diverse shapes such as
– spherical
– elipsoidal
– long strands, etc.
• All information for 3-D structure is
contained in the linear sequence of amino
acids.

Biochemistry 3070
– Amino Acids & Proteins
4
• To understand protein function, we must
first understand the nature of amino acids.
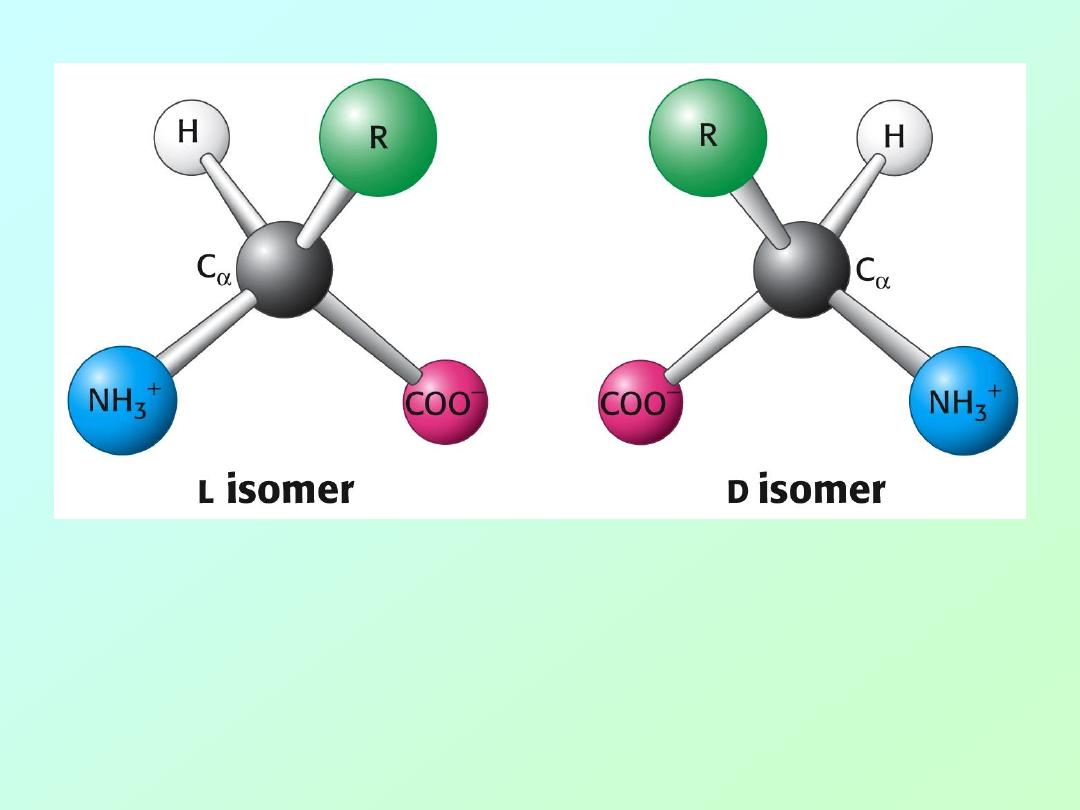
• Amino acids are essentially α-amino acids:
alpha carbon (IUPAC #2 position)
H
2
N
– C – COOH
|
R
• When R is not H, the alpha carbon
is asymetric, giving rise to isomers.
Biochemistry 3070
– Amino Acids & Proteins
5
Only L-amino acids are constituents of proteins.
“L” and “D” isomeric nomenclature is similar to the
“R” and “S” utilized in modern organic chemistry.

Biochemistry 3070
– Amino Acids & Proteins
6
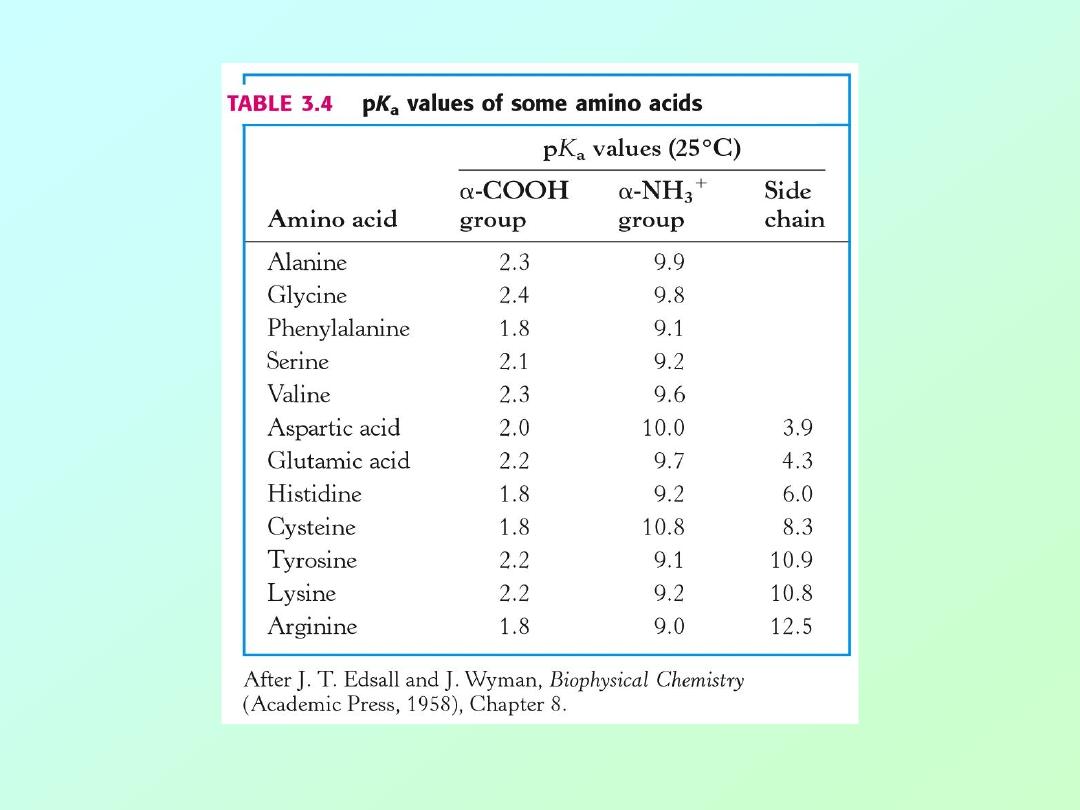
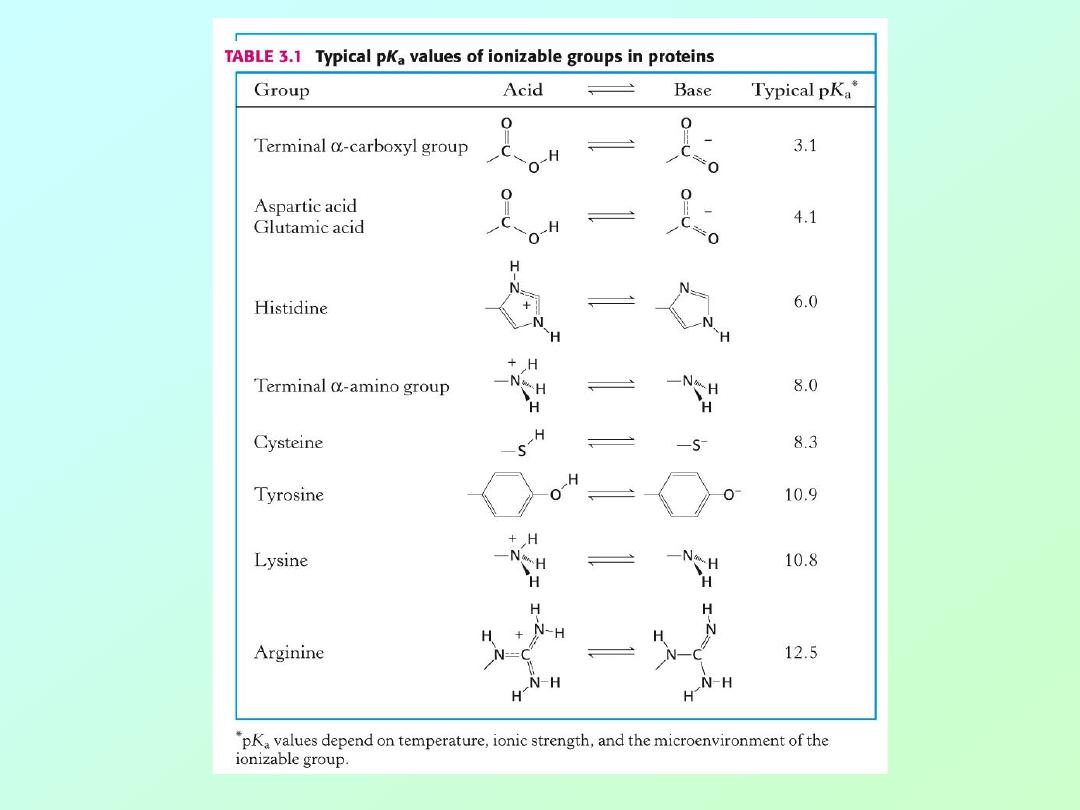
• Carboxylic acids are traditional Bronsted-
Lowery acids, donating a proton in
aqueous solution.
• The pKa for caroboxylic acids is normally
around 2 to 5. That is, the pH at which
these acids are 50% ionized:
R-COO
H
→
R-COO
-
+
H
+
pH= [less than 2]
→
[above 5]

Biochemistry 3070
– Amino Acids & Proteins
7
• Amino groups function as bases,
accepting a proton.
• The pKa for amino groups is usually
around 9
– 10. Again, at the pKa these
groups are 50% ionized:
R-N
H
3
+
→
R-NH
2
+
H
+
pH= [below 8]
→
[above 9]
Biochemistry 3070
– Amino Acids & Proteins
8
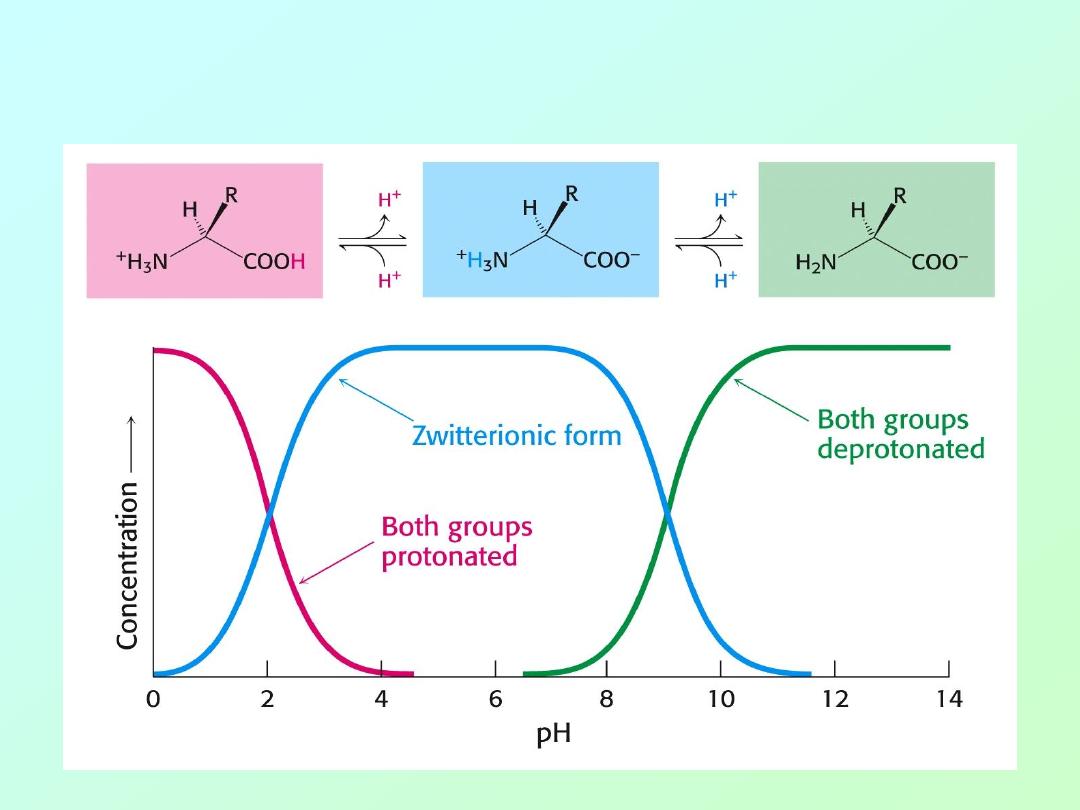
• Even though both acids and amines are present in the
same molecule, they mostly behave as though they were
separate entities:
Biochemistry 3070
– Amino Acids & Proteins
9

Biochemistry 3070
– Amino Acids & Proteins
10
• Summary:
At low pH, proton concentration [H+]is high.
Therefore, both amines and carboxylic
acids are protonated. (
-NH
3
+
&
-COOH
)
At high pH, proton concentration is low.
Therefore, both amines and carboxylic
acids are deprotonated. (
-NH
2
&
-COO
-
)
At neutral pH, amines are protonated(
-NH
3
+
)
and carboxylates are deprotonated
(-COO
-
)

Biochemistry 3070
– Amino Acids & Proteins
11
• “Zwitter” Ions:
• Ions bearing two charges were named
zwitter ions by German scientists; the
name still applies today, especially for
amino acids at neutral pH:
+
H
3
N
– CH
2
– COO
-

Biochemistry 3070
– Amino Acids & Proteins
12
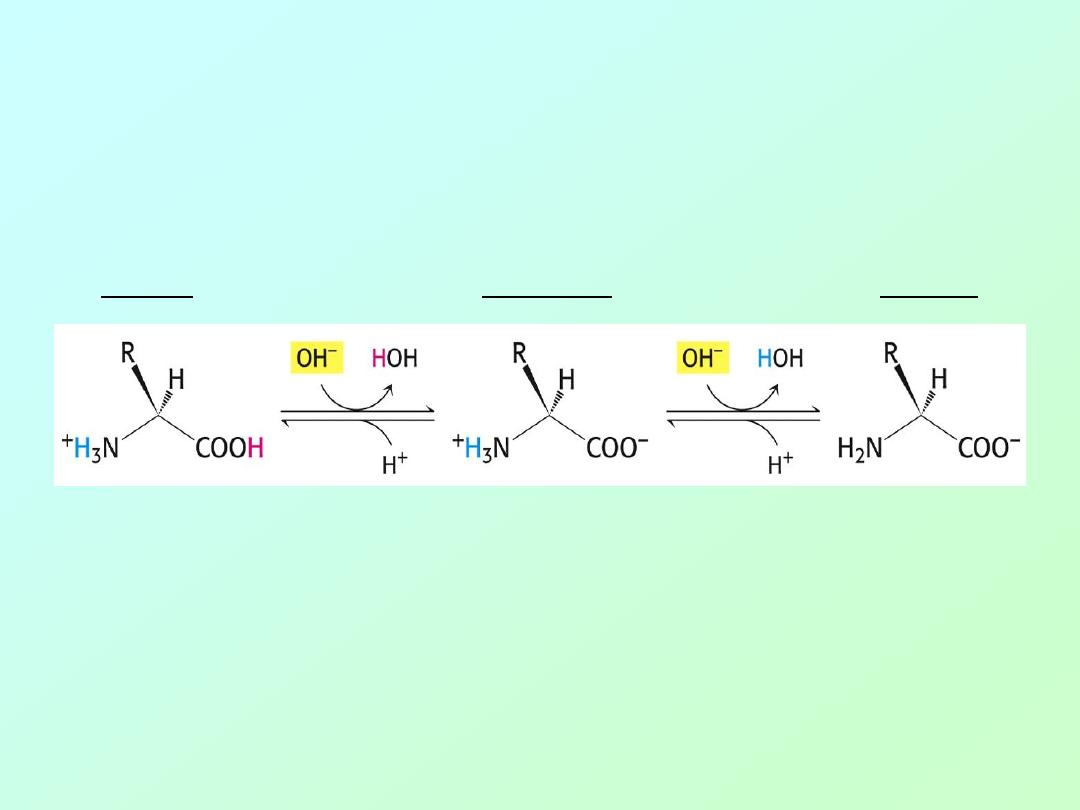
Acid-Base Properties of Amino Acids
Draw the following chemical structures for glycine:
(Non-existent form:)
H
2
N
– CH
2
-
COOH
pH=1:
pH=7:
pH=12:

Biochemistry 3070
– Amino Acids & Proteins
13
Acid-Base Properties of Amino Acids
Draw the following chemical structures for glycine:
(Non-existent form:)
H
2
N
– CH
2
-
COOH
pH=1:
+
H
3
N
– CH
2
-
COOH
pH=7:
pH=12:

Biochemistry 3070
– Amino Acids & Proteins
14
Acid-Base Properties of Amino Acids
Draw the following chemical structures for glycine:
(Non-existent form:)
H
2
N
– CH
2
-
COOH
pH=1:
+
H
3
N
– CH
2
-
COOH
pH=7:
+
H
3
N
– CH
2
–
COO
-
pH=12:

Biochemistry 3070
– Amino Acids & Proteins
15
Acid-Base Properties of Amino Acids
Draw the following chemical structures for glycine:
(Non-existent form:)
H
2
N
– CH
2
-
COOH
pH=1:
+
H
3
N
– CH
2
-
COOH
pH=7:
+
H
3
N
– CH
2
–
COO
-
pH=12:
H
2
N
– CH
2
–
COO
-
Biochemistry 3070
– Amino Acids & Proteins
16
Low pH
Neutral pH
High pH
Biochemistry 3070
– Amino Acids & Proteins
17
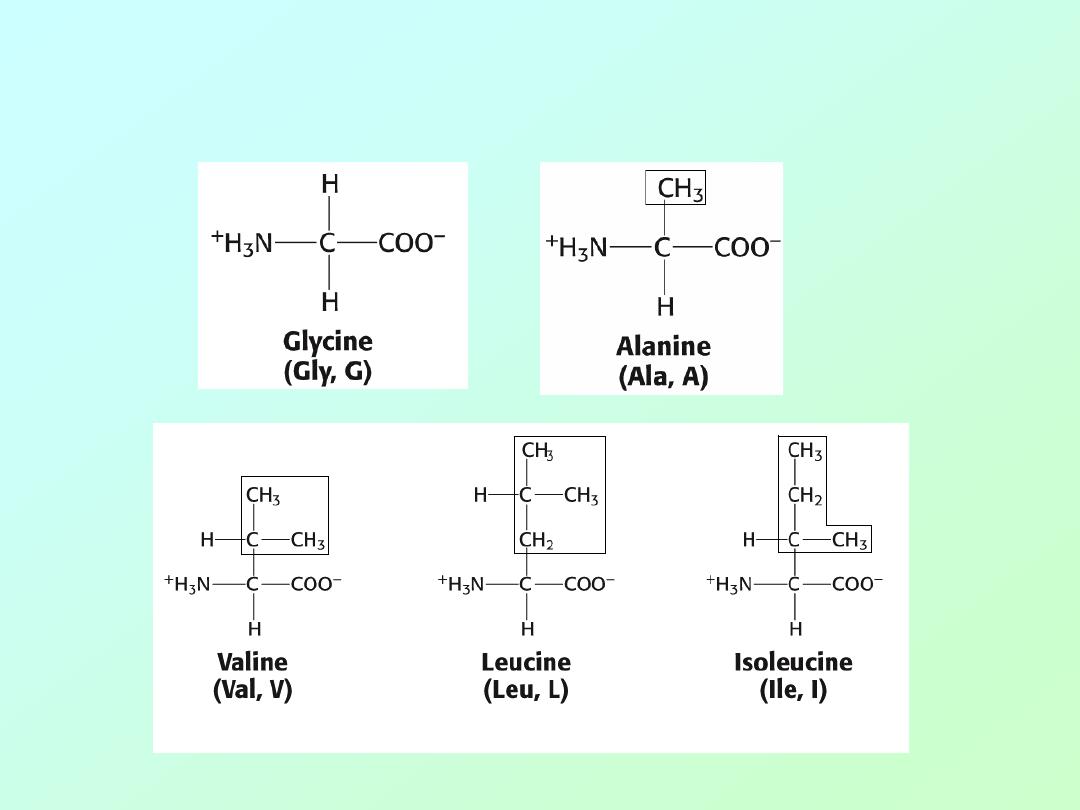
Amino acids: (Aliphatic)
Biochemistry 3070
– Amino Acids & Proteins
18
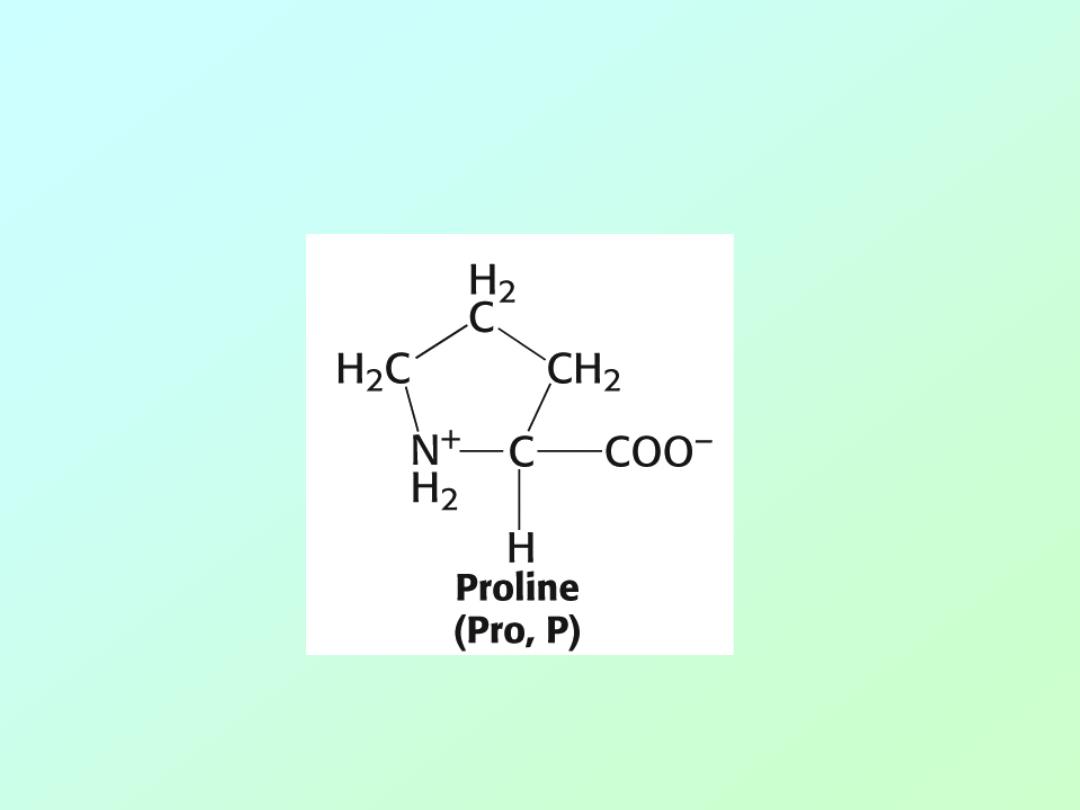
• Amino acid Proline
(The only secondary (2°
) amino acid or (“imino” acid.)
Biochemistry 3070
– Amino Acids & Proteins
19
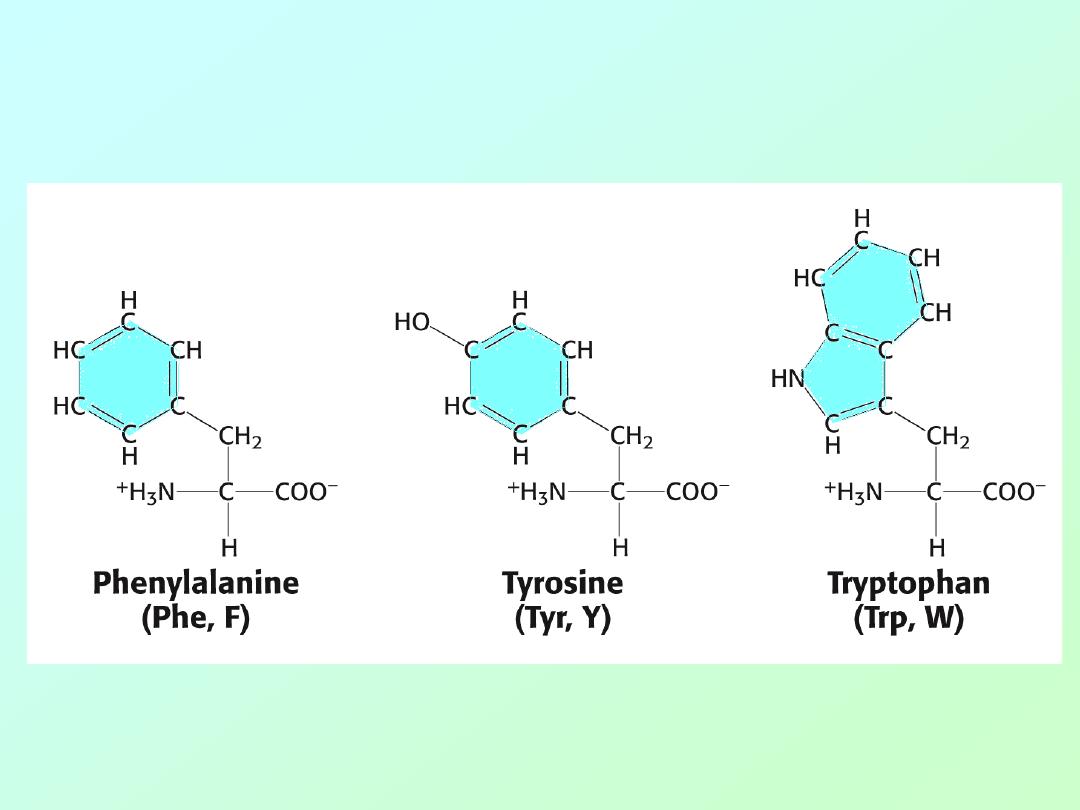
• Amino acids (Aromatic)
Biochemistry 3070
– Amino Acids & Proteins
20
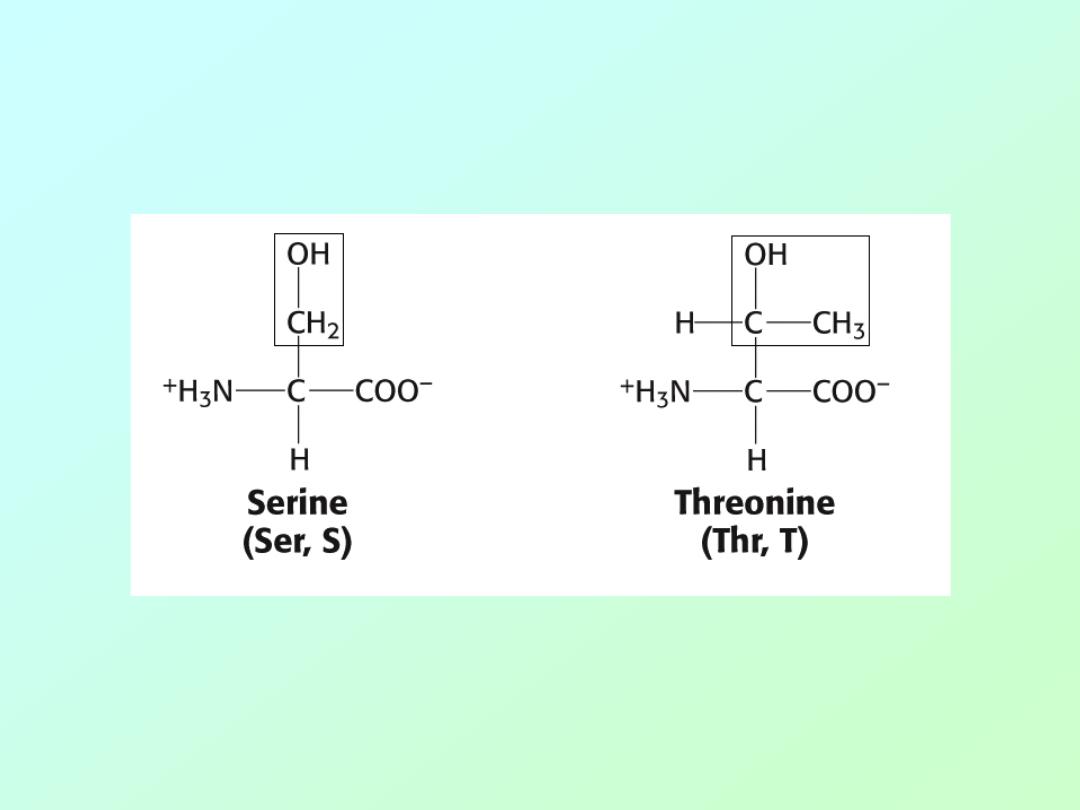
• Amino acids (Alcohols)
Biochemistry 3070
– Amino Acids & Proteins
21
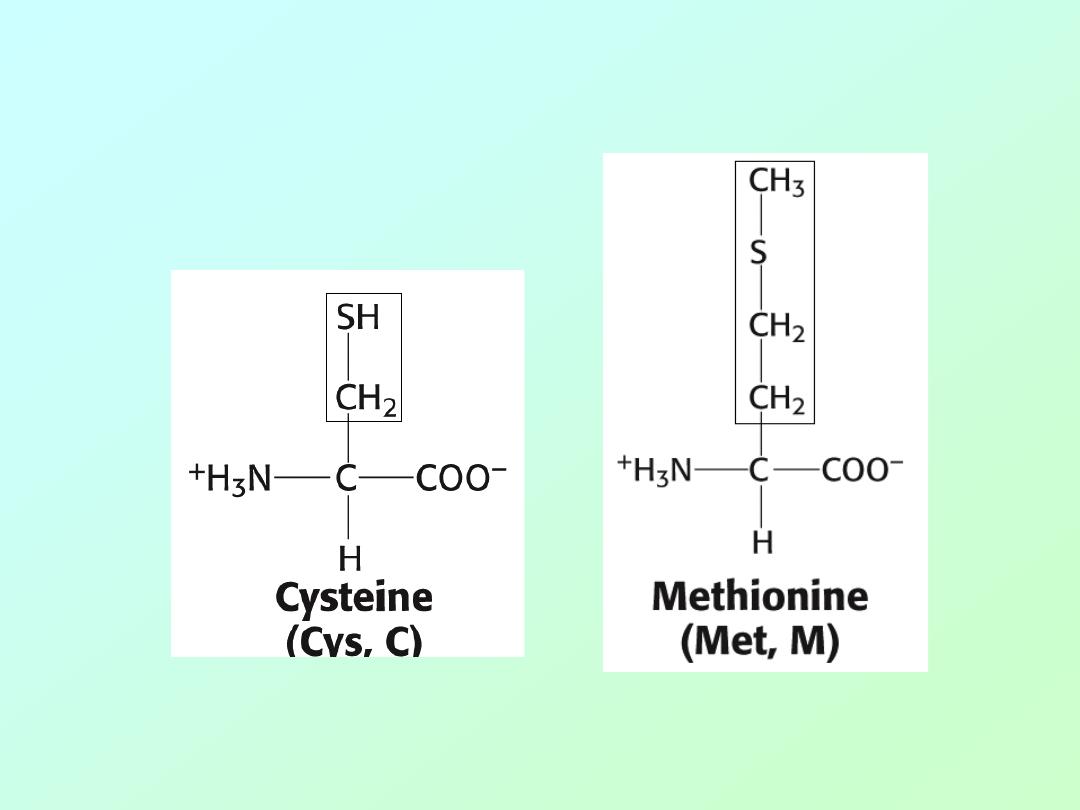
• Amino acids (Sulfur)
Biochemistry 3070
– Amino Acids & Proteins
22
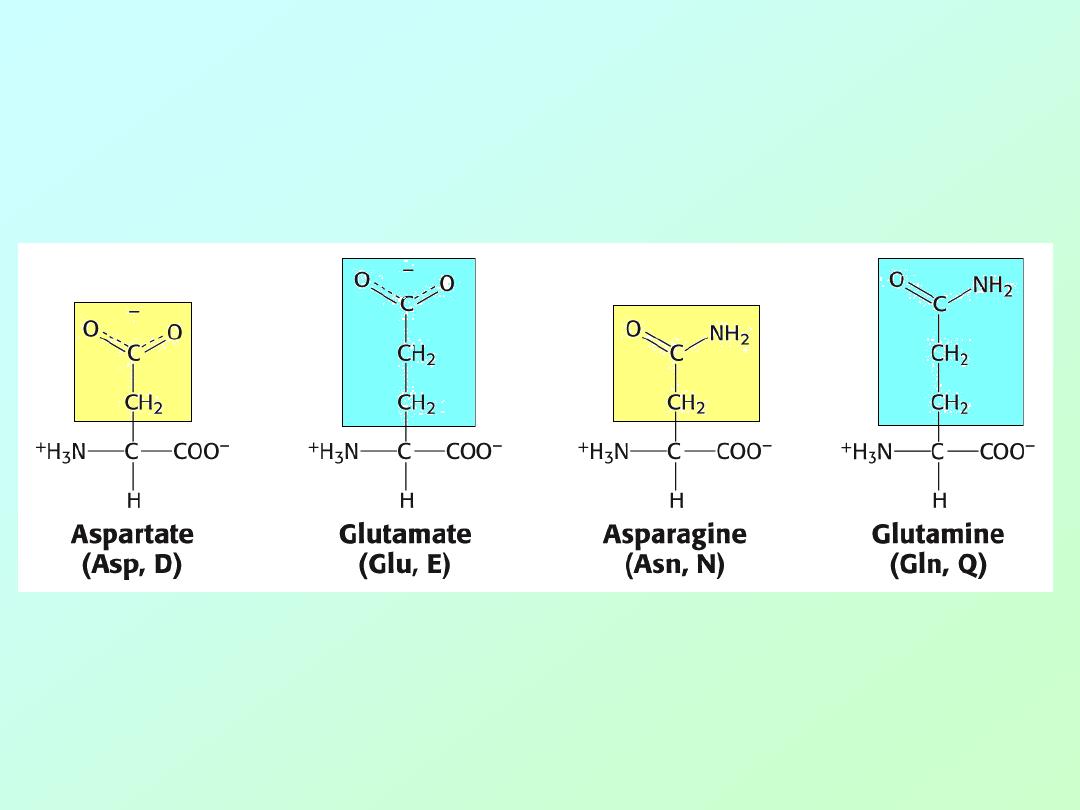
• Amino acids (Acids and related amides)
Biochemistry 3070
– Amino Acids & Proteins
23
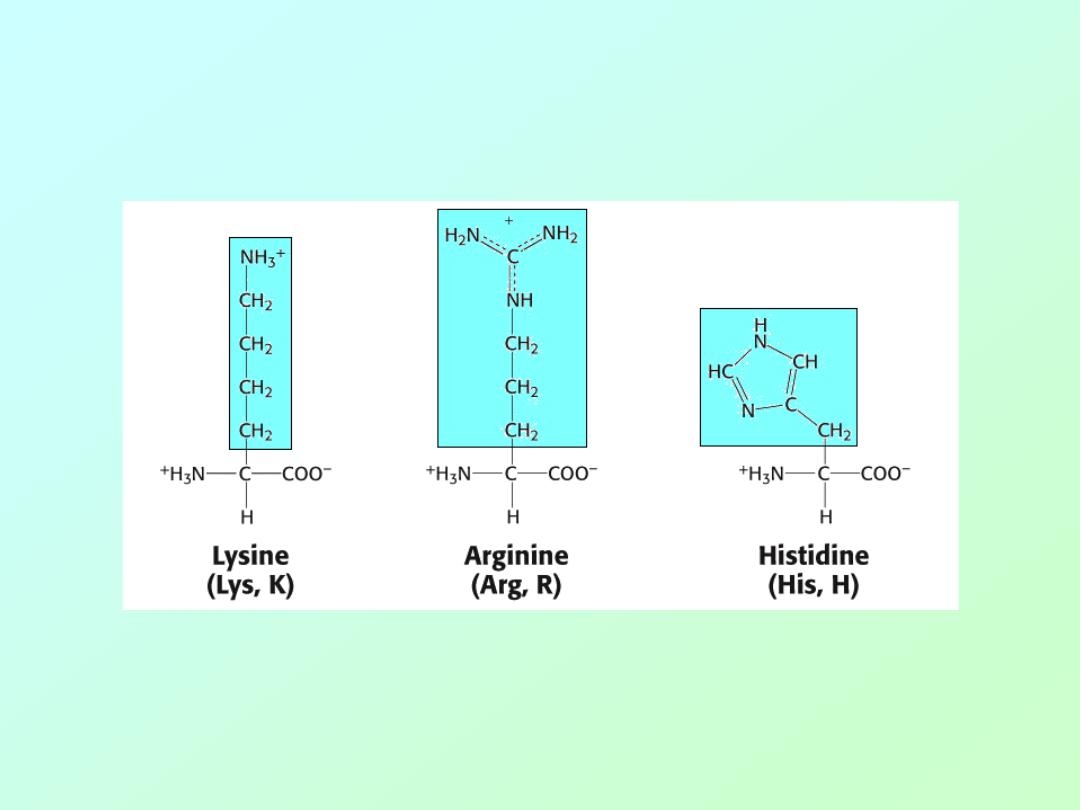
• Amino acids (Basic)
Biochemistry 3070
– Amino Acids & Proteins
24
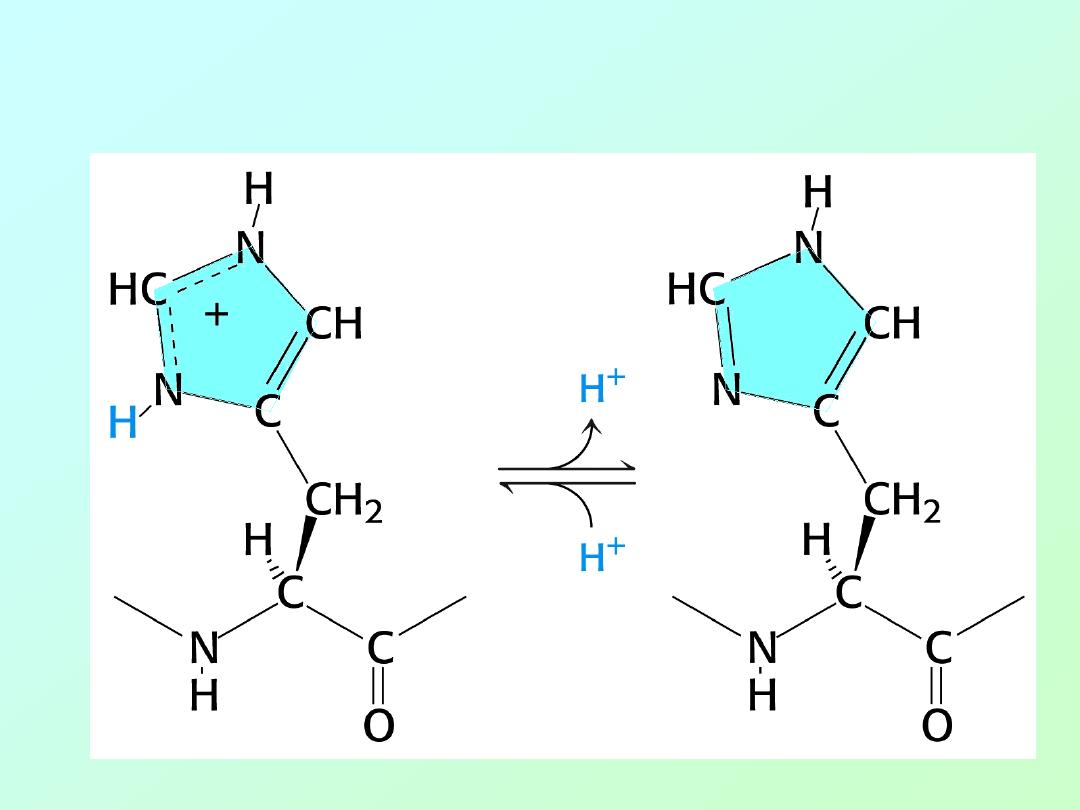
• Histidine (Acid/Base Activity)
Biochemistry 3070
– Amino Acids & Proteins
25
Biochemistry 3070
– Amino Acids & Proteins
26

Biochemistry 3070
– Amino Acids & Proteins
27
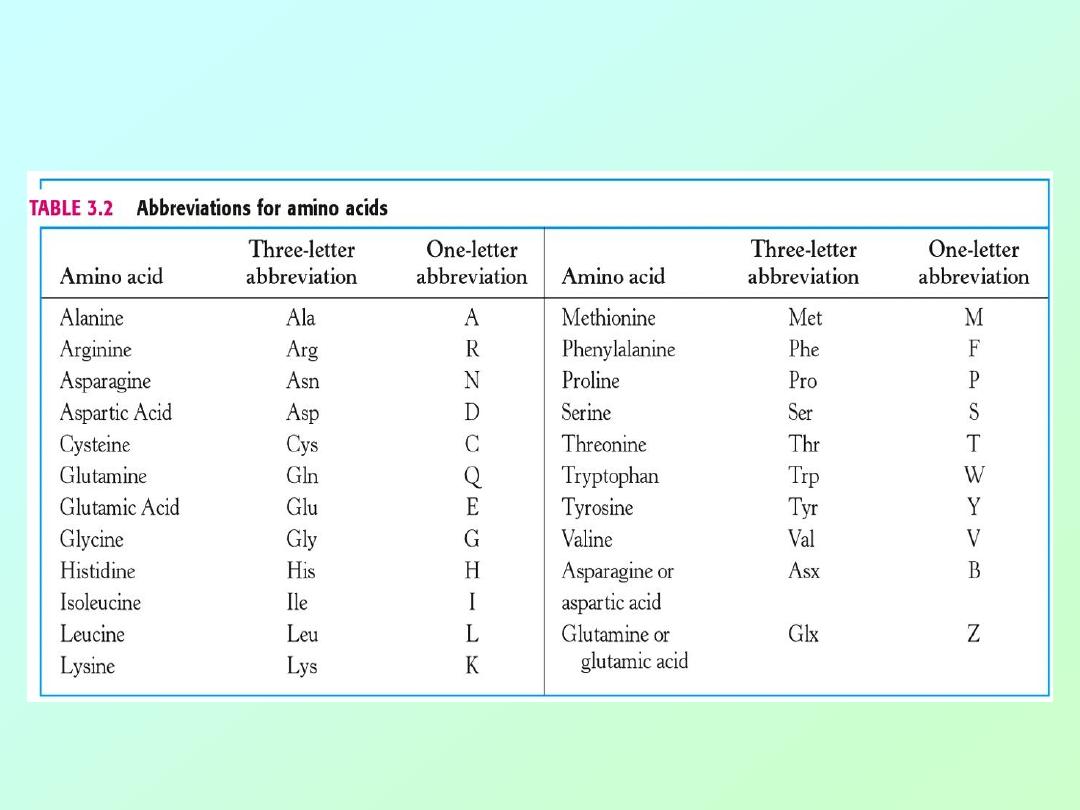
Essential Amino Acids:
Isoleucine
Leucine
Lysine
Methionine
Phenylalanine
a
Threonine
Tryptophan
a
Valine
Arginine
b
Histidine
b
a
Aromatic
b
Probably essential
Biochemistry 3070
– Amino Acids & Proteins
28
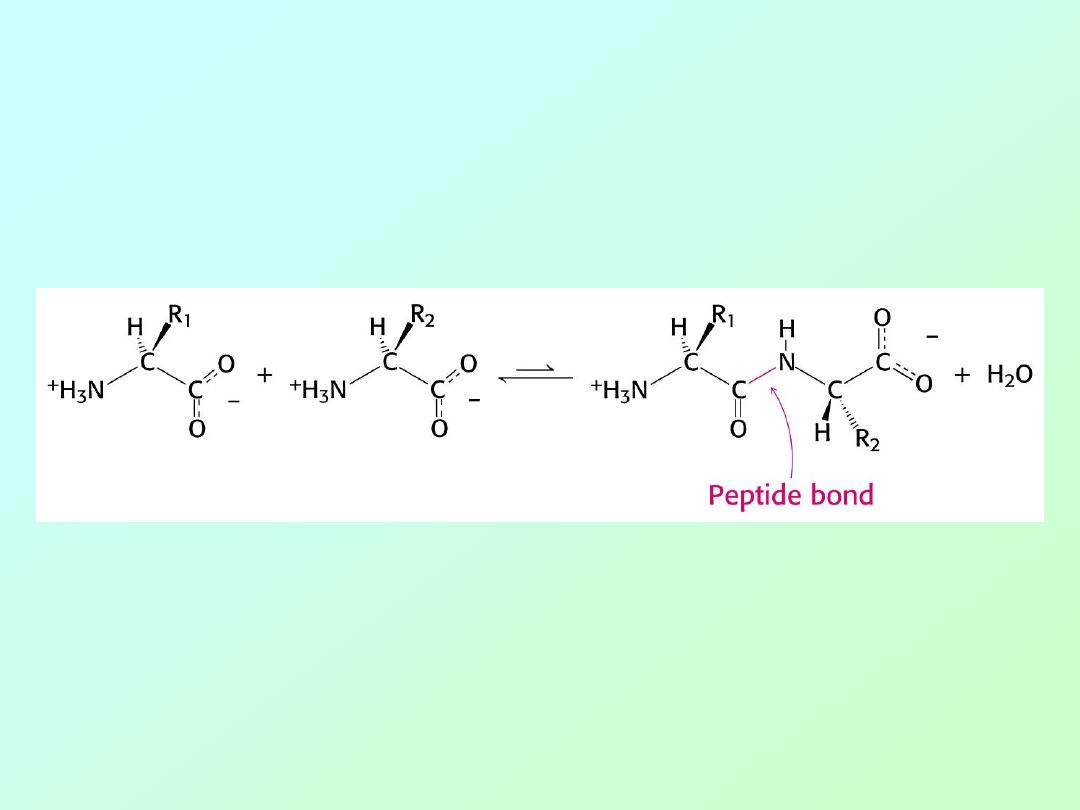
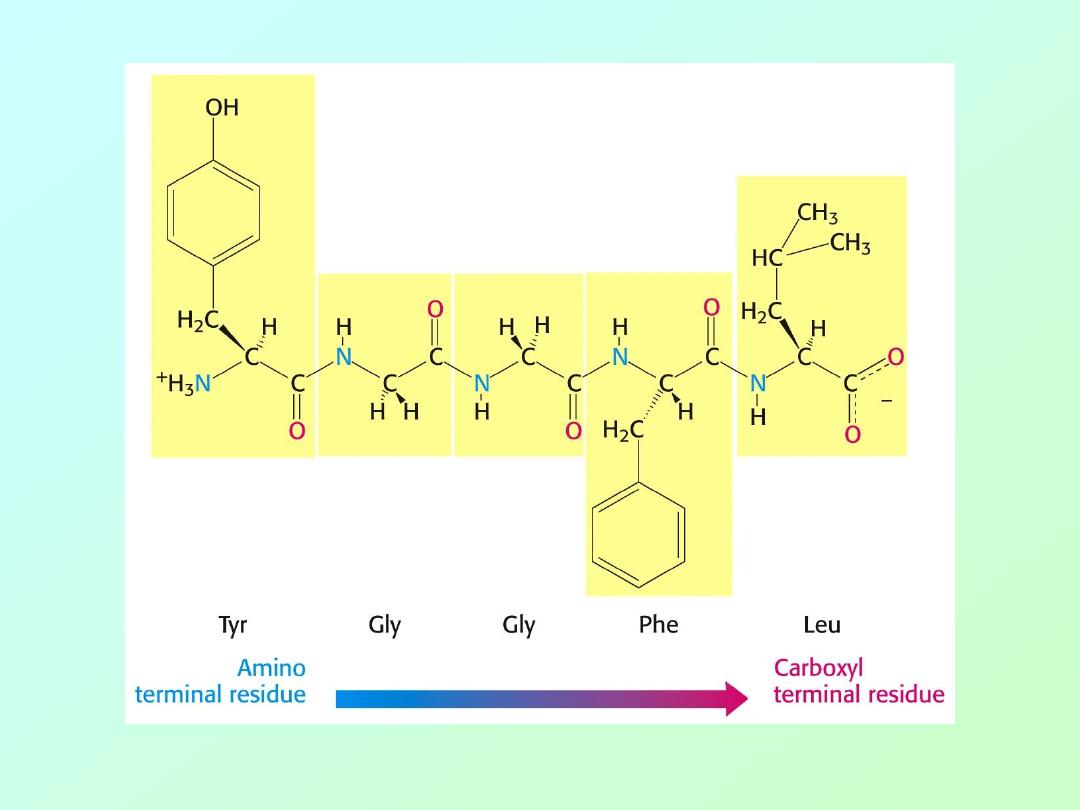
• Amino acids are polymerized via amide or
“peptide” bonds:
Biochemistry 3070
– Amino Acids & Proteins
29
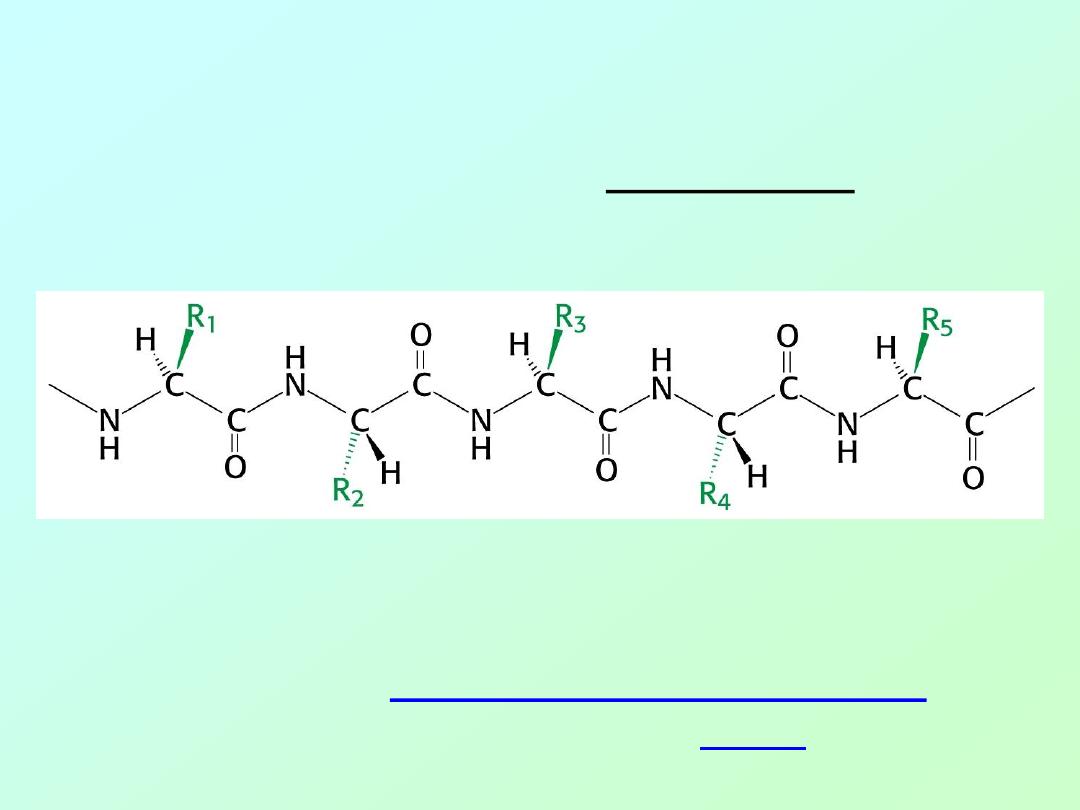
• Copolymer of amino acids:
– a “polypeptide”
Definition:
Amino acid polymers of
≤50 amino acids are called
“
polypeptides, peptides, oligopeptides, etc.
”
Amino acids polymer of >50 amino acids are called “
proteins
.”
Biochemistry 3070
– Amino Acids & Proteins
30

Biochemistry 3070
– Amino Acids & Proteins
31
• An example of a “dipeptide” is the sweetener
Aspartame.
• Other names include:
– NutraSweet
– Equal
– Tri-Sweet
– Sanecta
• IUPAC Name:
“N-L- α – Aspartyl-L-phenylalanine 1-methyl ester”
Abbreviated Structure:
Asp
– Phe - OCH3
Biochemistry 3070
– Amino Acids & Proteins
32
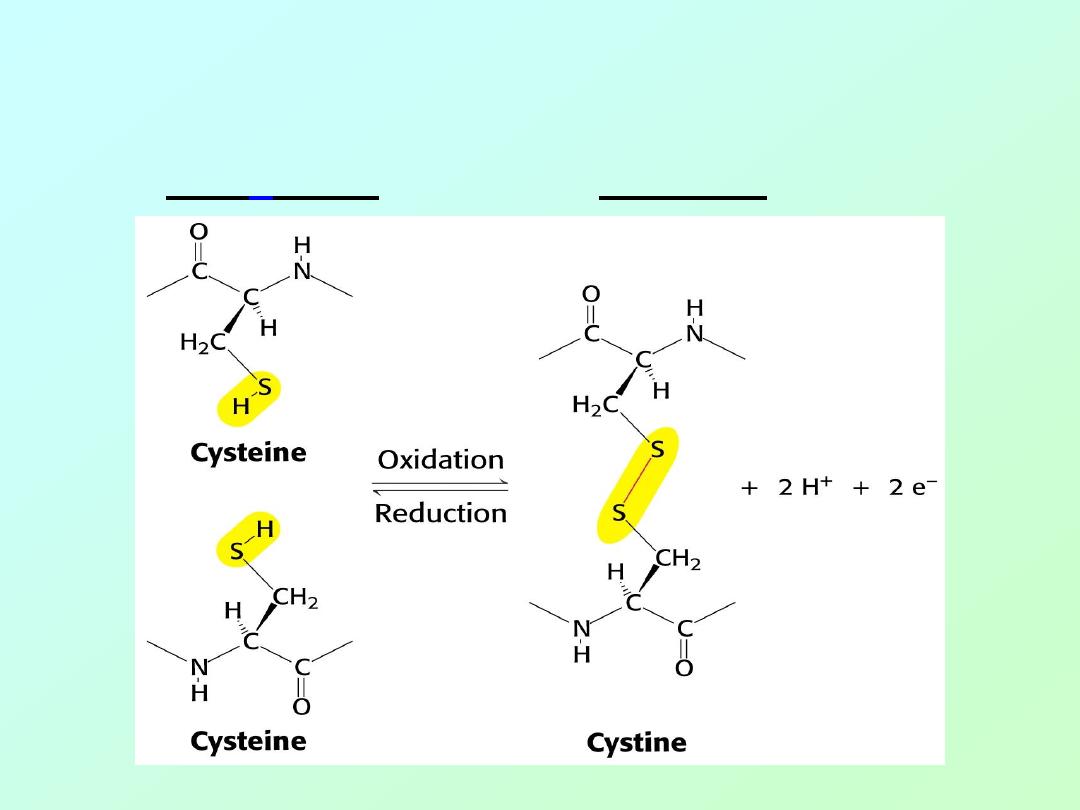
• Cross links between peptide chains:
– Disulfide linkages between individual
“cyst
e
ines” are called “cystines:”
Biochemistry 3070
– Amino Acids & Proteins
33
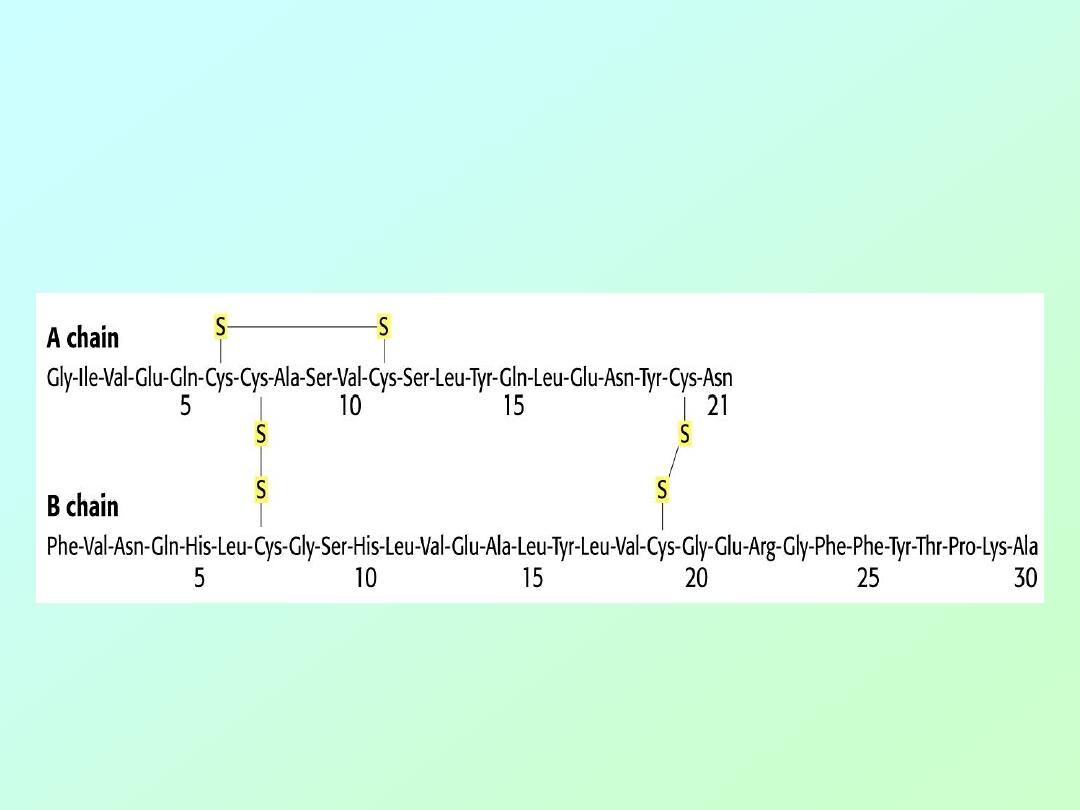
• Insulin is the smallest protein, with 51
amino acids in two chains linked by
cystine (disulfide) cross links:
Biochemistry 3070
– Amino Acids & Proteins
34
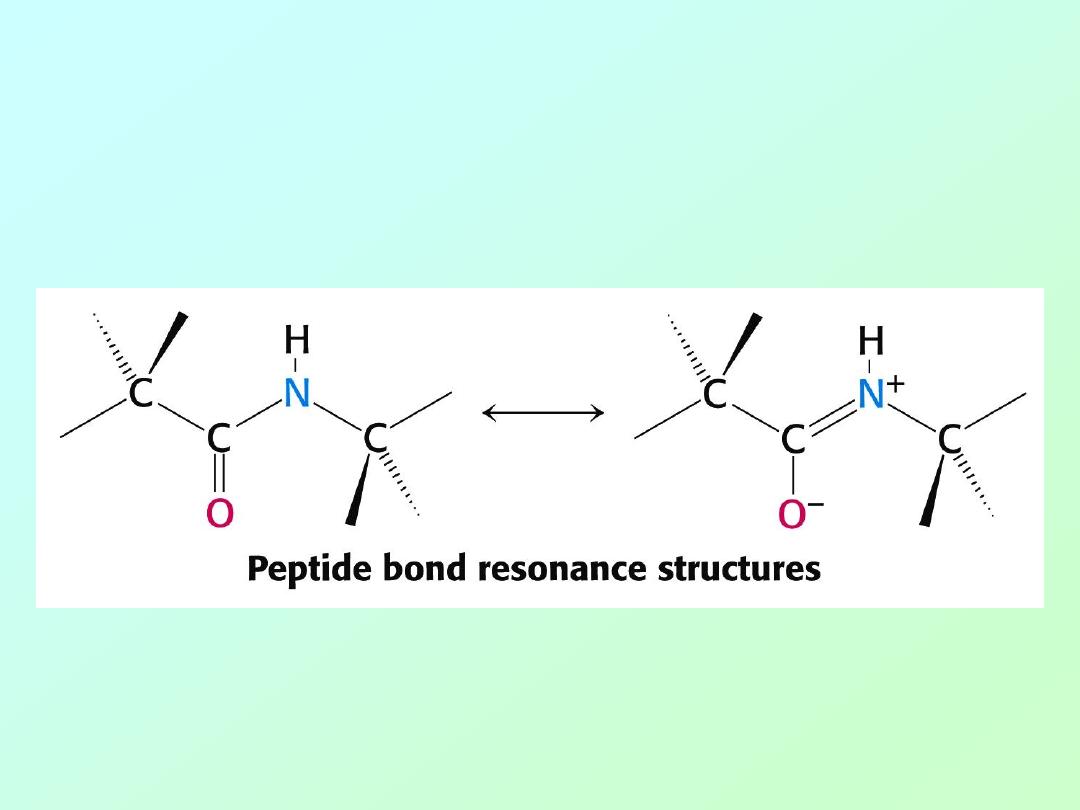
• Peptide bonds have partial double bond
character due to resonance that limits
rotation about this bond:
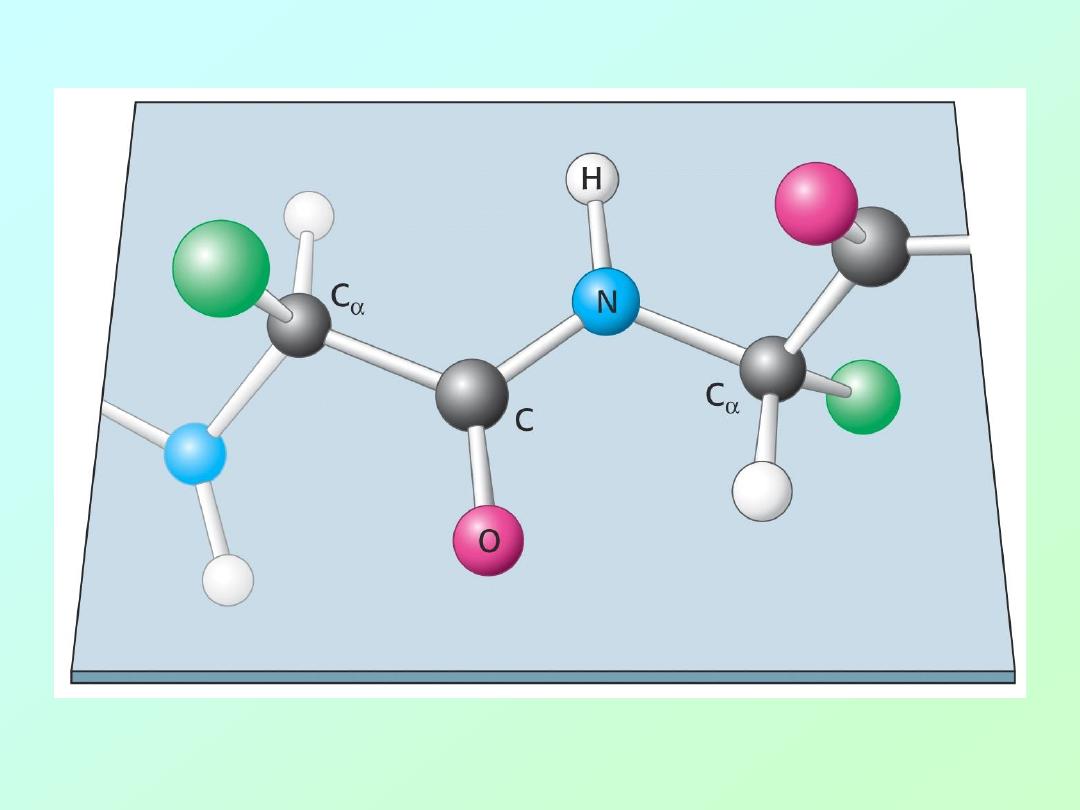
Biochemistry 3070
– Amino Acids & Proteins
35

Biochemistry 3070
– Amino Acids & Proteins
36
Levels of Protein Structure
• Primary (1°) Protein Structure
– linear sequence of amino acids.
• Secondary (2°) Protein Structure
– localized regional structures
• Teritary (3°) Protein Structure
– overal shape of proteins
• Quaternary (4°) Protein Structure
– interactions between proteins

Biochemistry 3070
– Amino Acids & Proteins
37
Protein Structure:
• Twisting about various bonds in the
polypeptide backbone gives proteins a
variety of shapes.
• Bond angles give rise to secondary
structures. Then, localized secondary
structures help drive the peptide folding
that gives rise to tertiary structure.

Biochemistry 3070
– Amino Acids & Proteins
38
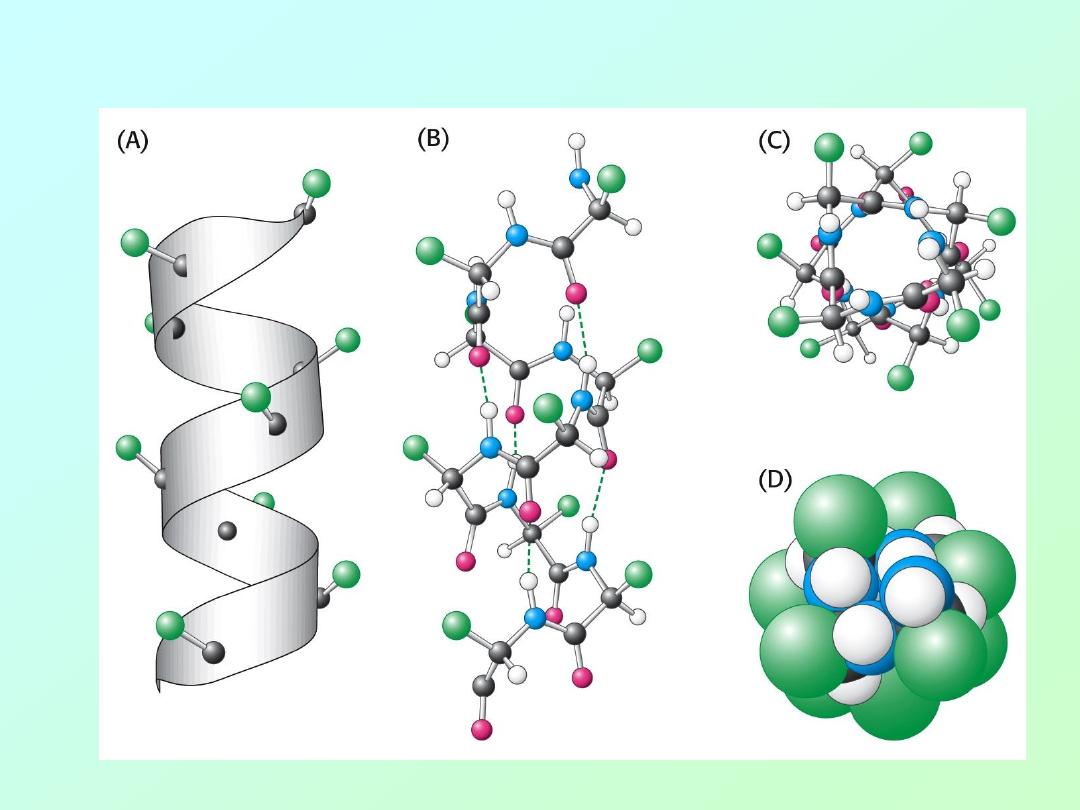
Secondary Structure in Proteins:
• Pauling and Corey proposed two
secondary structures in proteins many
years before they were actually proven:
alpha
– helix
beta
- sheet
Both of these secondary protein structures
are stabilized by hydrogen bonding between
the carbonyl oxygen atoms and the nitrogen
atoms of amino acids in the protein chain.
Biochemistry 3070
– Amino Acids & Proteins
39
• The alpha (α) – helix:
Biochemistry 3070
– Amino Acids & Proteins
40
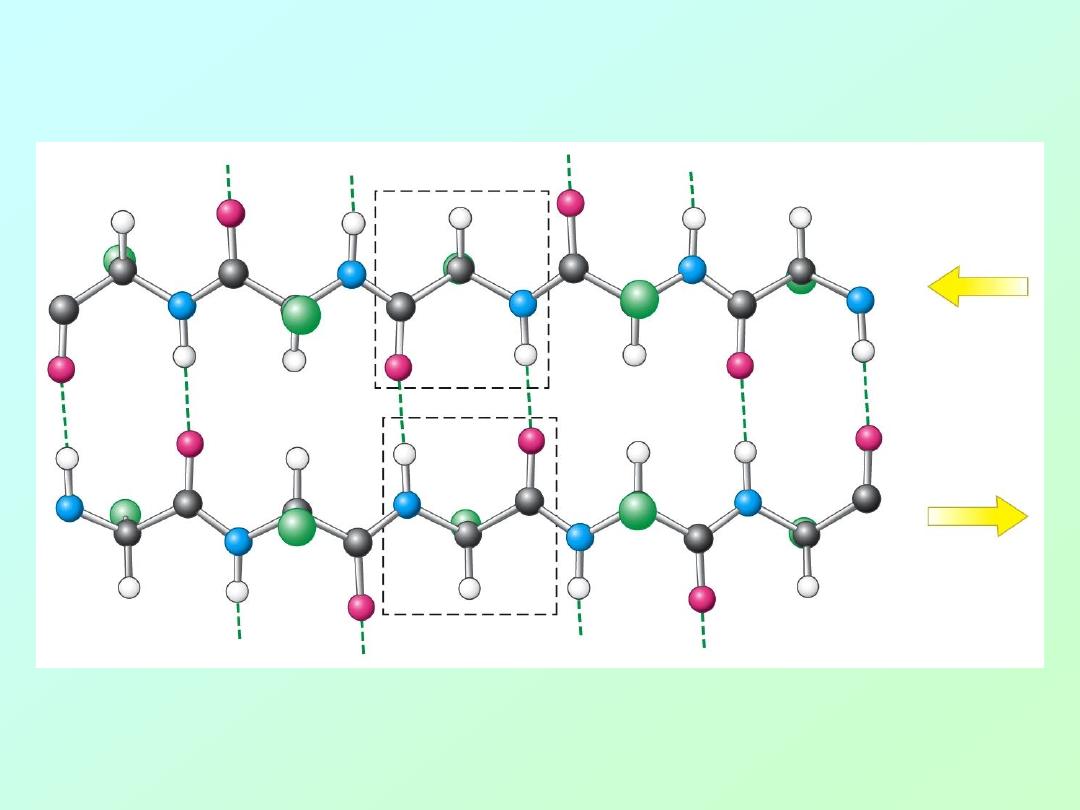
• beta – sheet (
antiparallel
):
Biochemistry 3070
– Amino Acids & Proteins
41
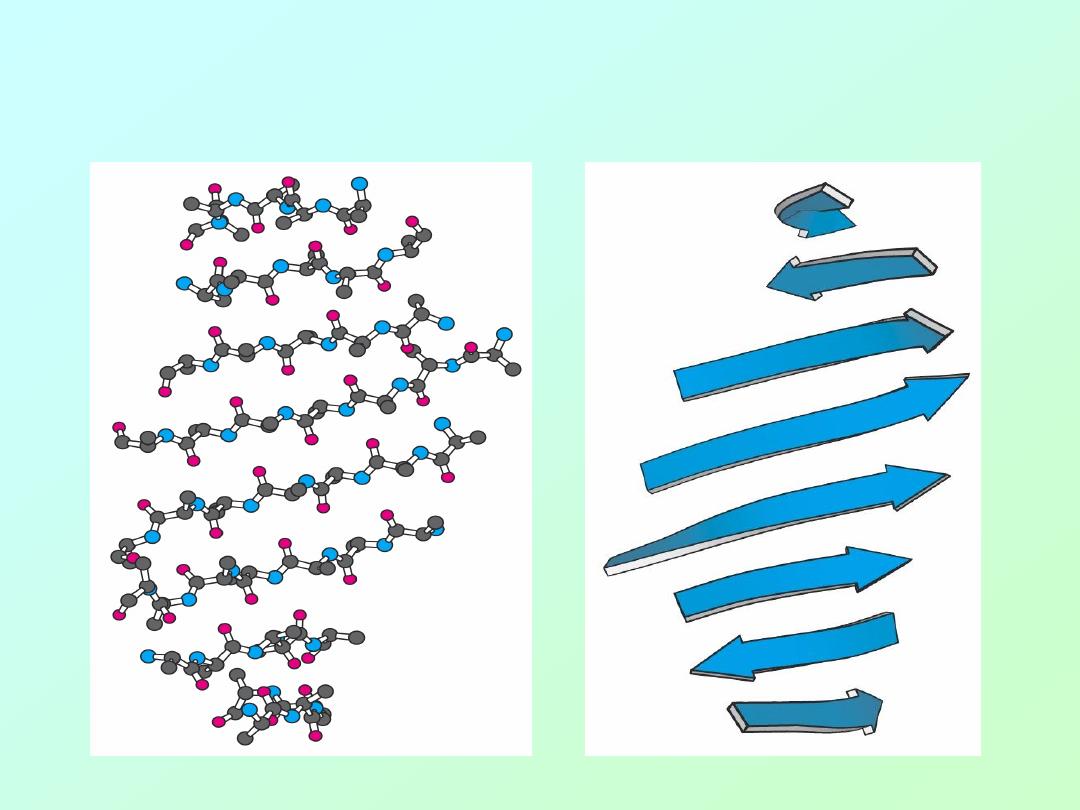
• beta – sheet (
artistic representations
):
Biochemistry 3070
– Amino Acids & Proteins
42
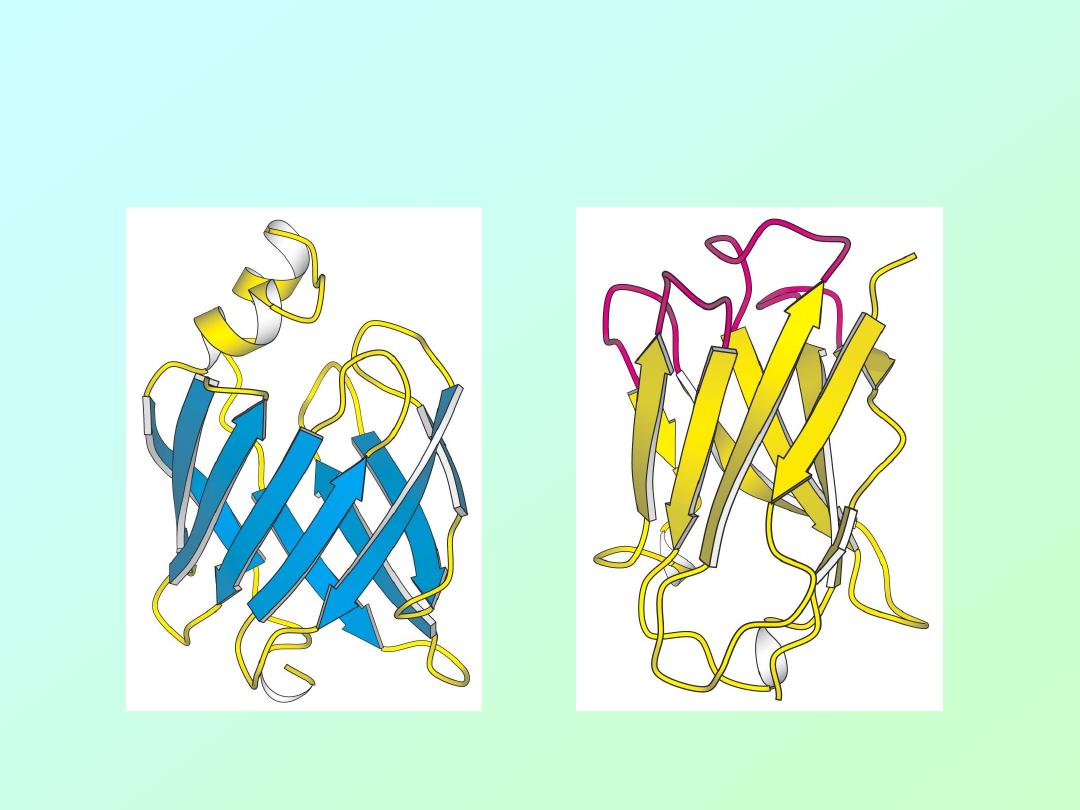
Examples of
beta
-sheet domains in proteins:

Biochemistry 3070
– Amino Acids & Proteins
43
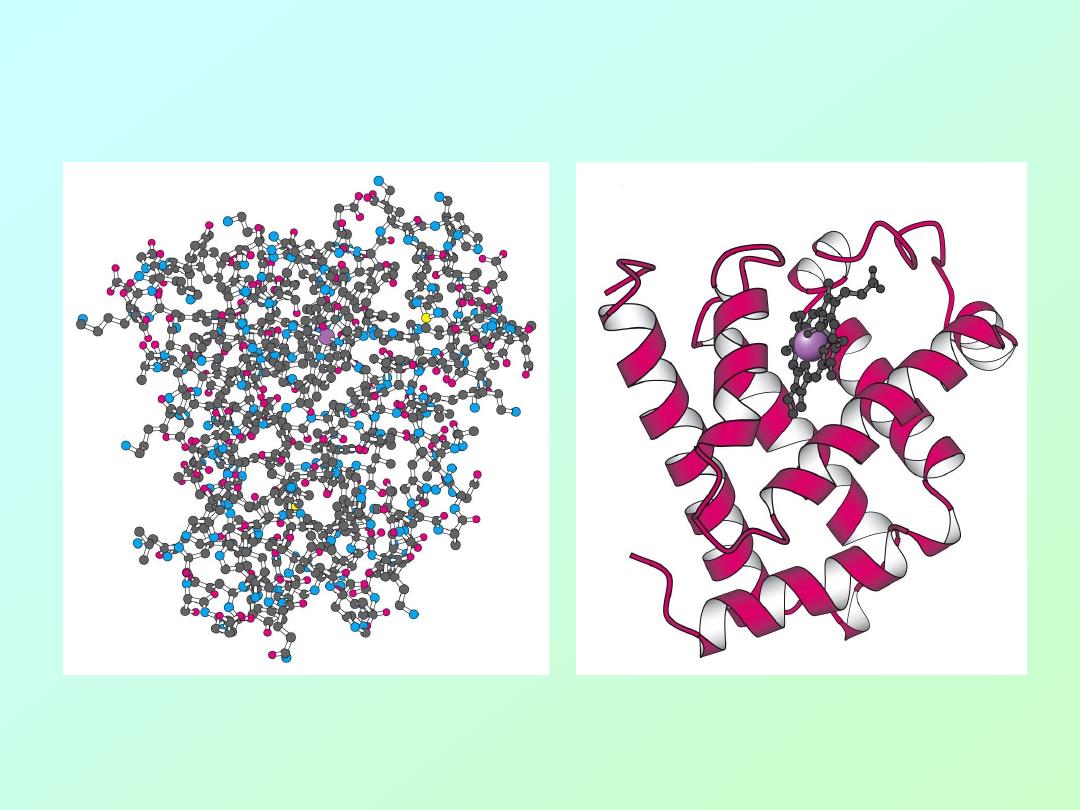
• Tertiary (3°) Structure of Protein
Water-soluble proteins fold into compact structures with nonpolar cores.
Biochemistry 3070
– Amino Acids & Proteins
44
Tertiary (3°) Structure the Protein Myoglobin
Water-soluble proteins fold into compact structures with non-polar cores.
Biochemistry 3070
– Amino Acids & Proteins
45
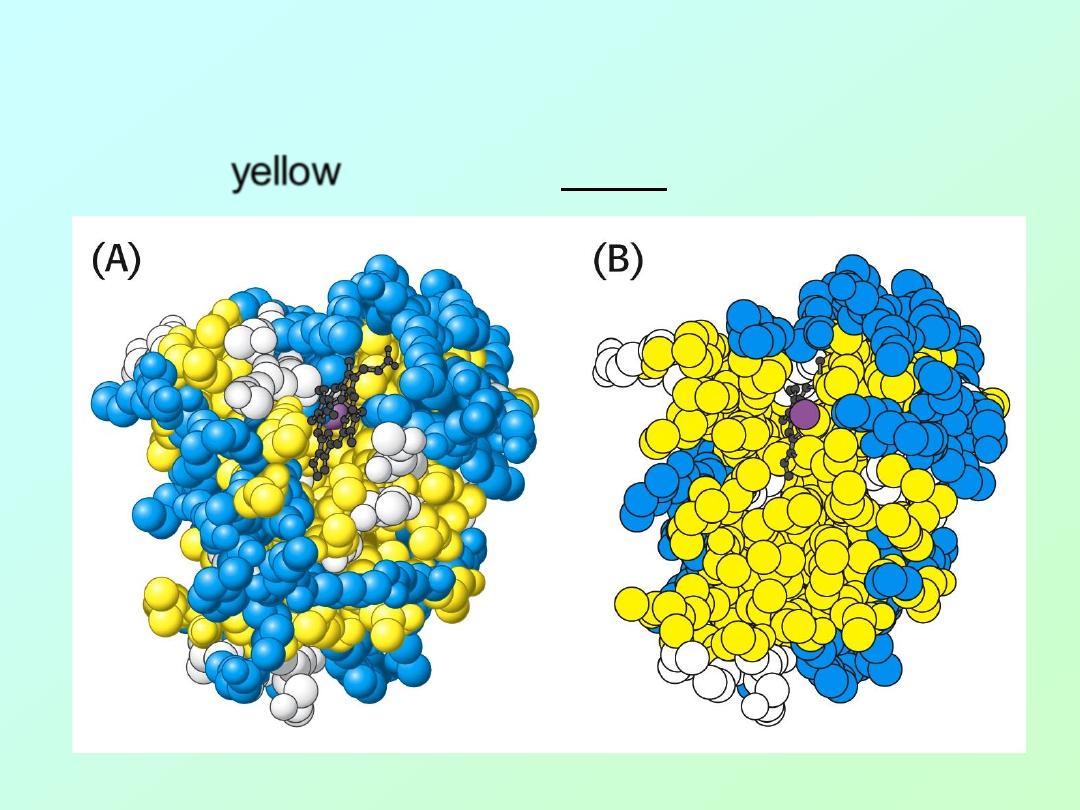
• In the case of myoglobin and many other
proteins, the majority of hydrophobic amino
acids (
yellow
) are found inside in structure:
Biochemistry 3070
– Amino Acids & Proteins
46
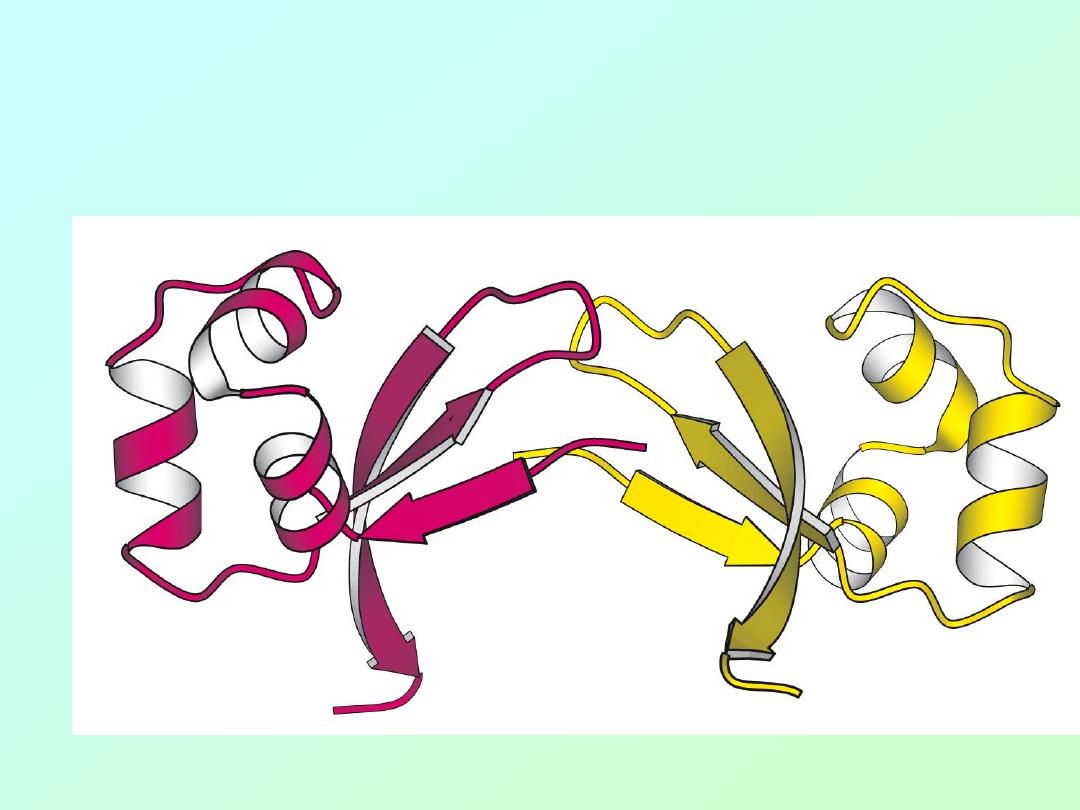
• The Cro protein of Lambda bacteriophage
is a dimer of identical subunits:
Biochemistry 3070
– Amino Acids & Proteins
47
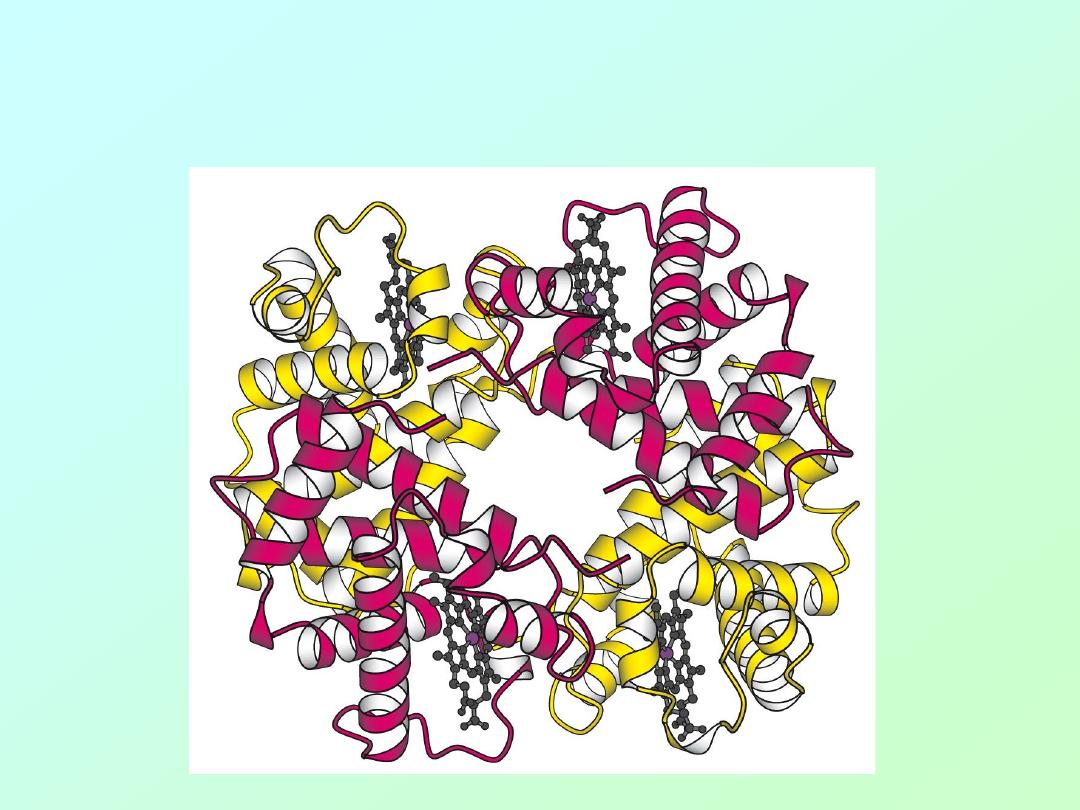
• Hemoglobin is a protein tetramer,
containing two identical pairs of subunits:

Biochemistry 3070
– Amino Acids & Proteins
48
• The coat of rhinovirus contains 60 copies
of each of four subunits (240 total)!

Biochemistry 3070
– Amino Acids & Proteins
49
• In 1961 Christian Anfinsen published a
classic landmark work that clearly showed
tertiary structure was determined by
primary structure!
• His experiment was a classic example of
well-designed experiments that did not
require expensive equipment or years of
work.
• It deserves our attention.

Biochemistry 3070
– Amino Acids & Proteins
50
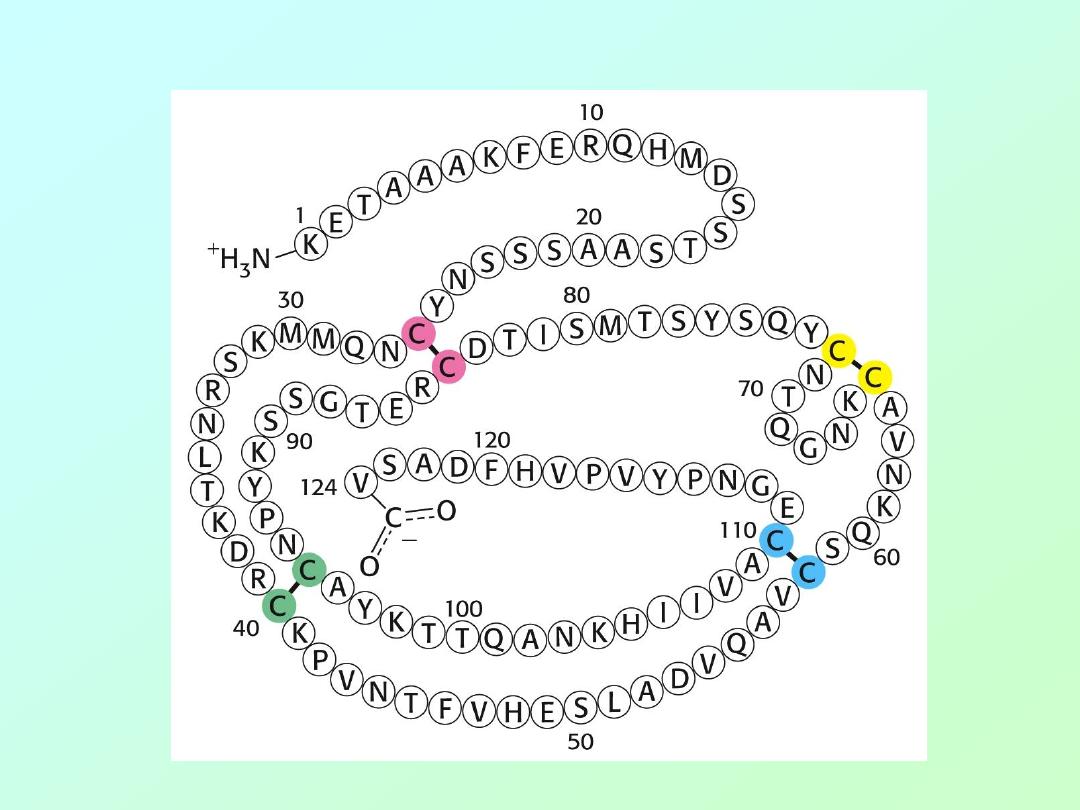
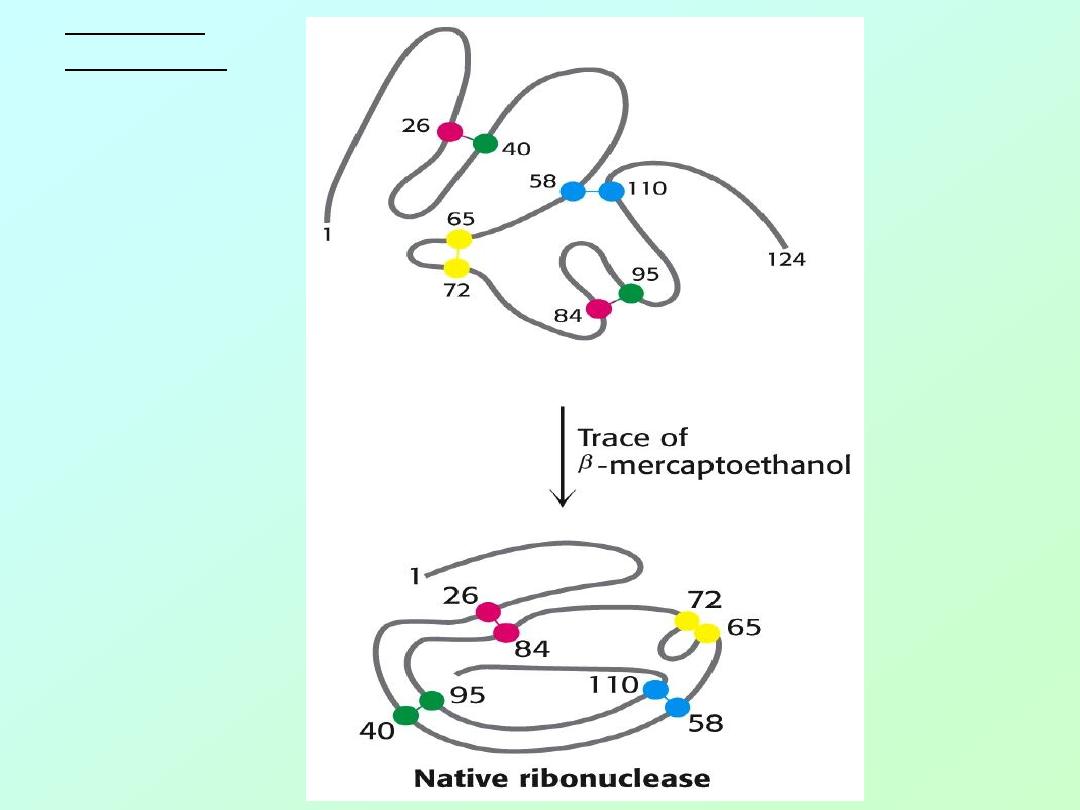
• Anfinson chose the enzyme,
ribonuclease
,
for his experiments. This enzyme
hydrolyzes RNA and is composed of a
single polypeptide chain with 124 amino
acids.
• Four disulfide (cystine) linkages are
observed in the active enzyme that
stabilize the 3-D (3°) shape of the enzyme.
• The enzyme functions only when its
3° structure is properly aligned.
Biochemistry 3070
– Amino Acids & Proteins
51
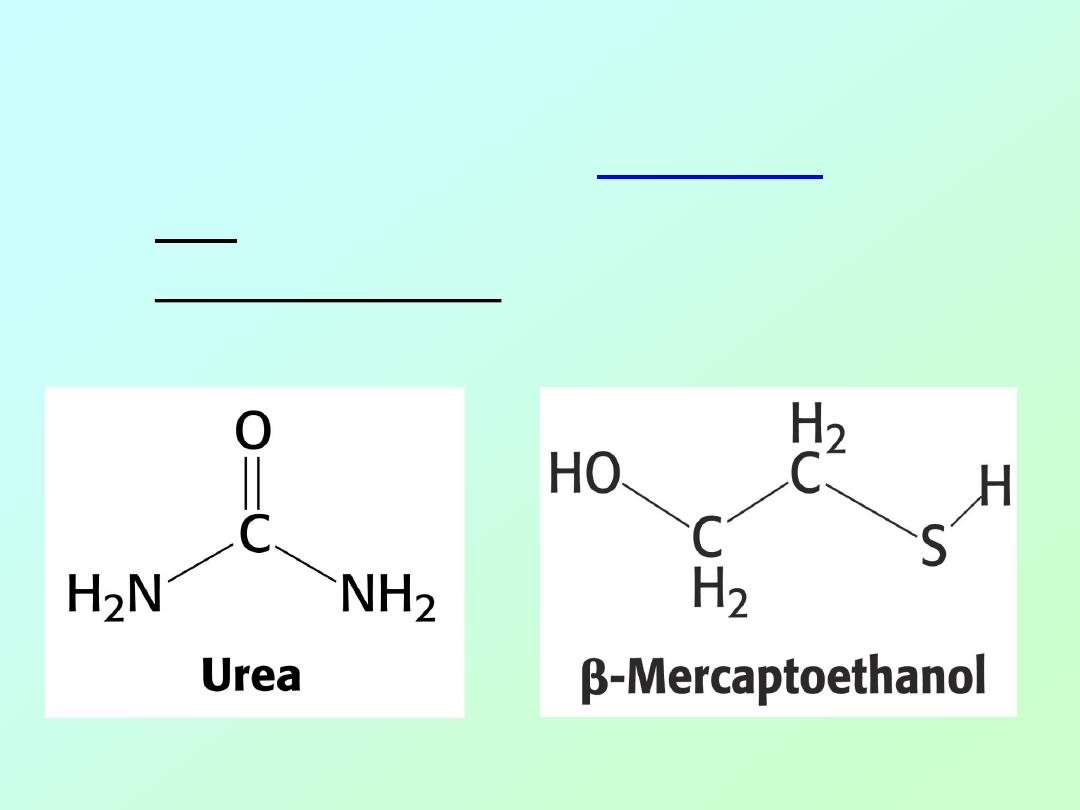
• Amino acid sequence of ribonuclease:
Biochemistry 3070
– Amino Acids & Proteins
52
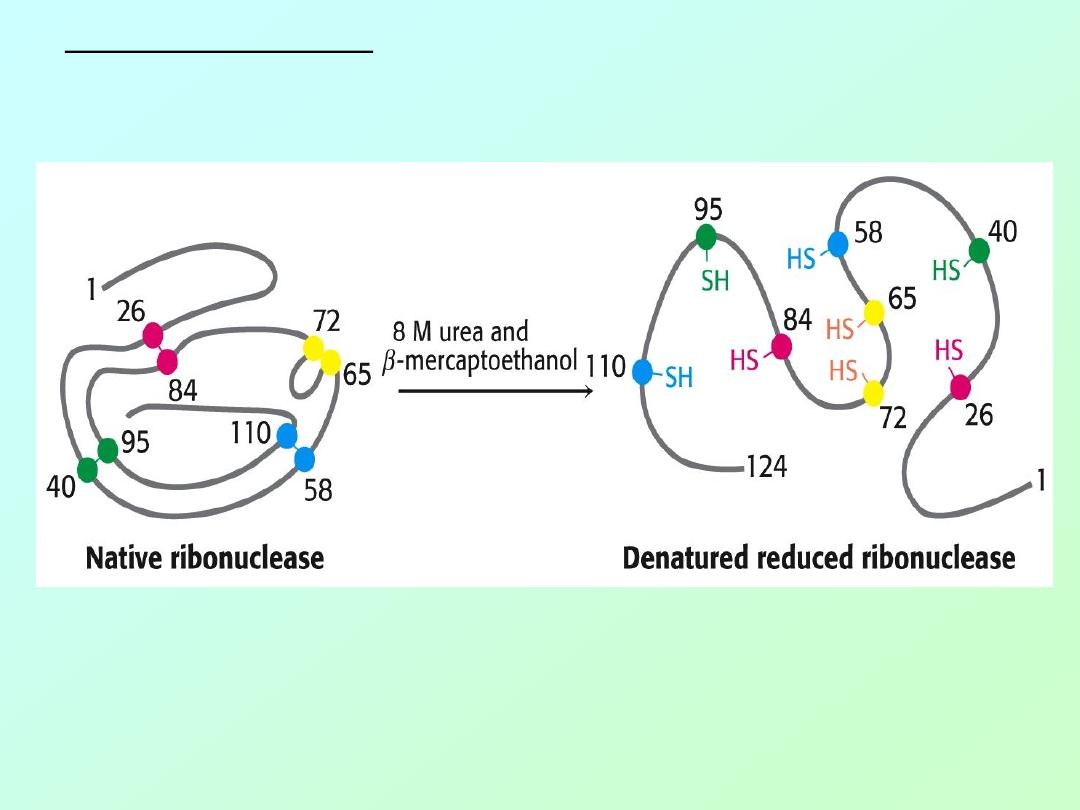
Anfinson used two chemicals to disrupt the
enzyme’s 3° structure [
D
ENATURATION
]
1. urea - disrupts hydrogen bonds
2.
β-mercaptoethanol – reduces disulfide bonds
Biochemistry 3070
– Amino Acids & Proteins
53
Anfinson’s Experiment:
Biochemistry 3070
– Amino Acids & Proteins
54
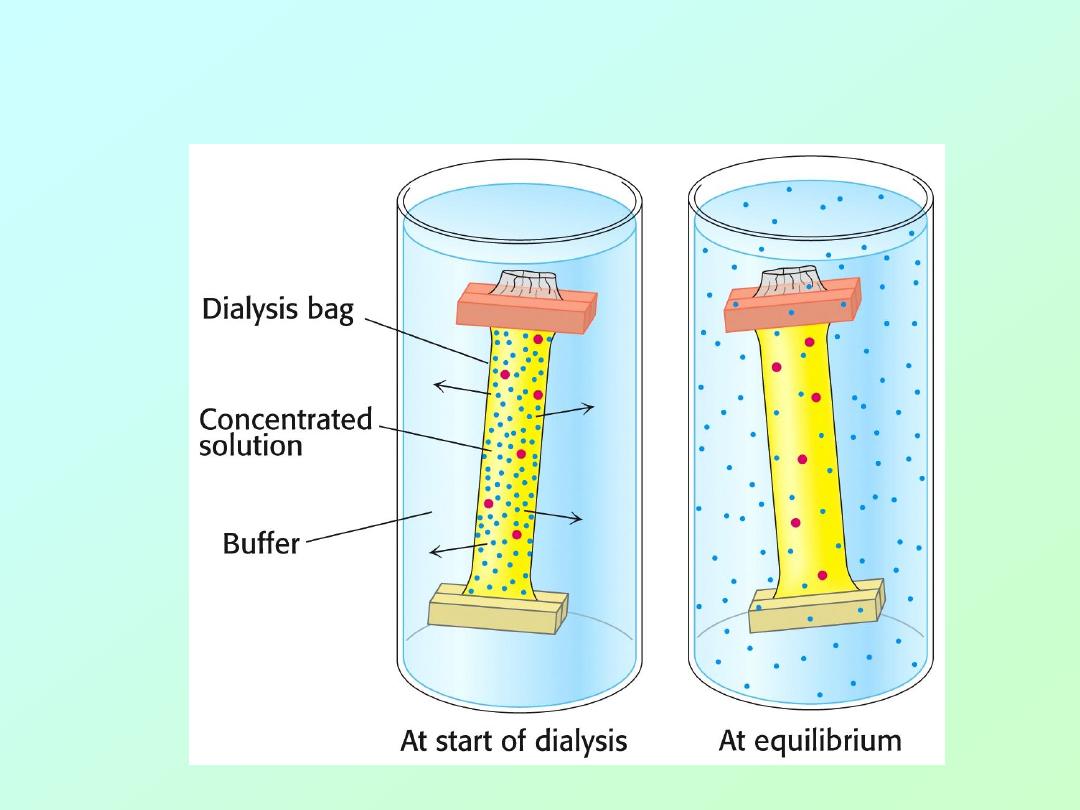
He also used dialysis to separate these chemicals
from the enzyme in different orders.

Biochemistry 3070
– Amino Acids & Proteins
55
• By adding either one of these two
chemicals to the surrounding medium, it is
not removed during dialysis.
• In essence, Anfinson could remove either
the urea or the
β-mercaptoethanol in any
order he chose.
• The order made a big difference in the
enzymes ability to recover from the
treatment!

Biochemistry 3070
– Amino Acids & Proteins
56
Anfinson’s Experiment:
Experiment #1:
1.
Add both urea and
β-mercaptoethanol to a solution of enzyme.
Activity is lost.
2.
Remove urea by dialysis; then remove
β-mercaptoethanol by dialysis.
Activity is recovered 100%!
Experiment #2:
1.
Add both urea and
β-mercaptoethanol to a solution of enzyme.
Activity is lost.
2.
Remove
β-mercaptoethanol by dialysis; then remove urea by dialysis.
Only ~1% of activity is recovered.
N = 8
2
= 64, 1/64 ~ 1%
Experiment #3:
1.
Add
β-mercaptoethanol to the solution from Exp.#2. Then, remove
urea by dialysis;
2.
Finally, remove
β-mercaptoethanol by dialysis.
Activity is recovered
100%!
Biochemistry 3070
– Amino Acids & Proteins
57
Anfinson’s
Experiment:

Biochemistry 3070
– Amino Acids & Proteins
58
End of Lecture Slides
for
Amino Acids & Proteins
Credits: Most of the diagrams used in these slides were taken from Stryer, et.al, Biochemistry, 5
th
Ed., Freeman
Press, Chapters 3-4 (Our course textbook).
