
Hypermia And Congestion
Congestion
In this system we will discuss the following:
•
Hyperemia and Congestion
•
Hemorrhage
•
Edema
•
Thrombosis
•
Disseminated Intravascular Coagulation
•
Embolism
Infarction
•
Shock
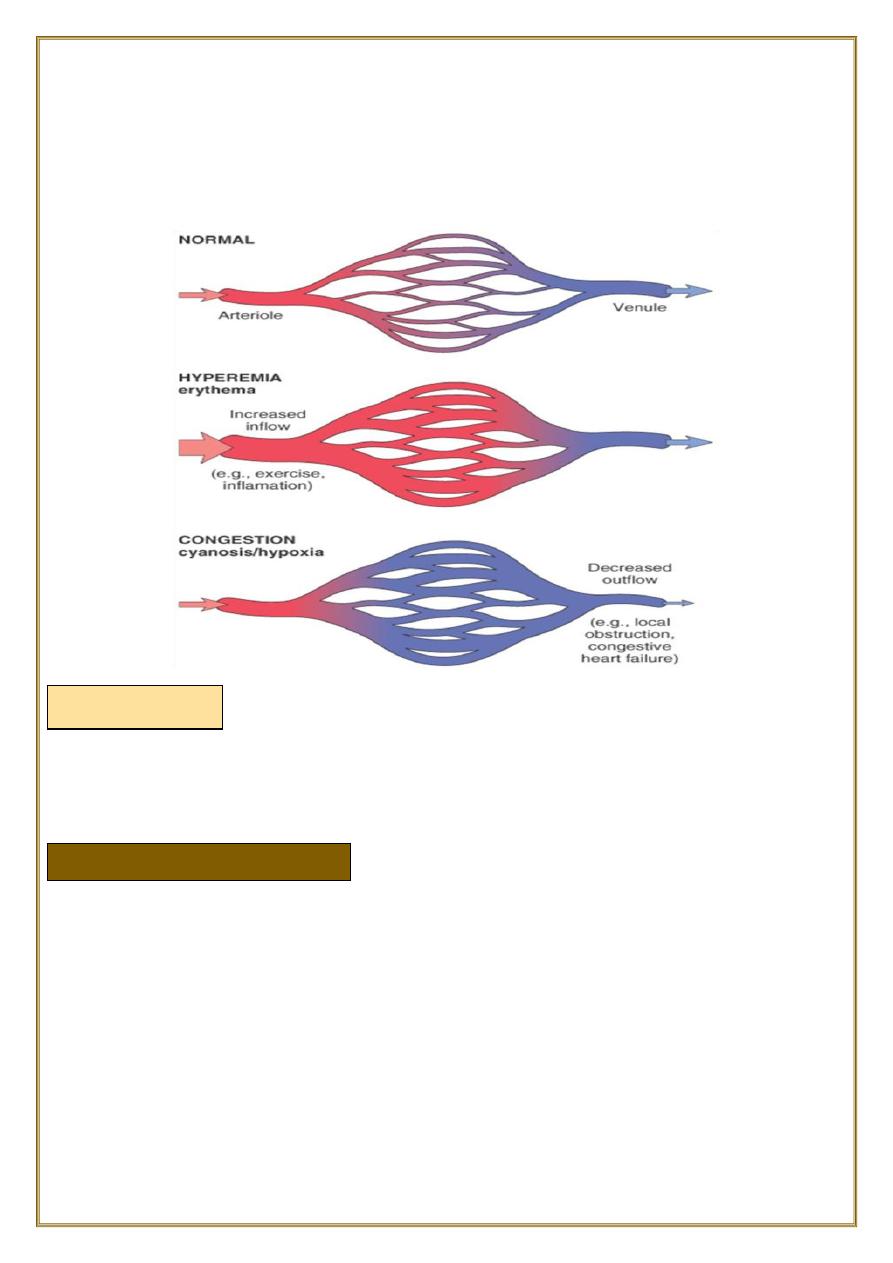
Definition
both of them can be defined as a local increase in volume of blood in a particular
tissue.
Hyperemia
It is an
active
process resulting from
arteriolar dilation
and increased blood inflow,
as occurs at sites of:
•
exercising skeletal muscle.
•
or acute inflammation.
♦
Hyperemic tissues are
redder
than normal because of engorgement with oxygenated
blood.
Congestion is a passive process resulting from impaired outflow of venous blood from a
tissue.
It can occur:
•
systemically, as in cardiac failure,
•
or locally as a consequence of an isolated venous obstruction.
♦
Congested tissues have an abnormal
blue-red
color (cyanosis) that stems from the
accumulation of
deoxygenated
hemoglobin in the affected area.
Patho
Assis. Prof.
Dr.Maha Shakir
Pdf by Qamar Saad
Hemodynamic Disorders,
Thromboembolism,
and Shock
MORPHOLOGY
a) Pulmonary congestion:
♦ In long-standing chronic congestion, inadequate tissue perfusion and persistent
hypoxia may lead to:
•
parenchymal cell death.
•
secondary tissue fibrosis.
•
the elevated intravascular pressures may cause edema or sometimes rupture
capillaries forming focal hemorrhage.
Cut surfaces of hyperemic or congested tissues
•
feel wet and
•
typically ooze blood.
•
Acute
•
chronic
1.
Acute pulmonary congestion:
•
Alveolar capillaries engorged with blood
•
variable degrees of alveolar septal edema and intraalveolar hemorrhage.
2.
Chronic pulmonary congestion:
•
Thickened & fibrotic septa
•
Alveolar spaces contain hemosiderin-laden macrophages (“heart failure cells”)
derived from phagocytosed red cells.
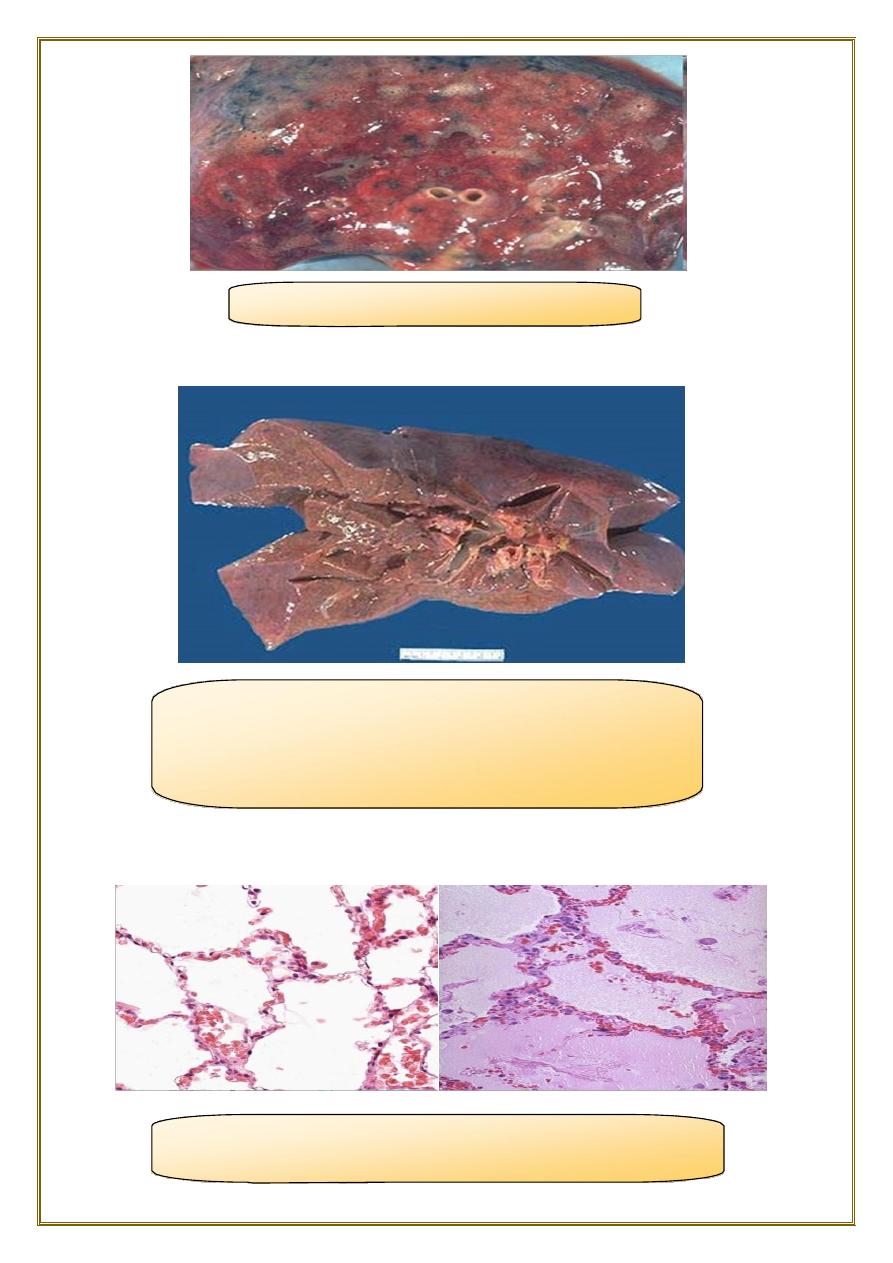
Fig; Lung, acute pulmonary congestion.
fig:Lung, chronic passive congestions: surface The
lung has a red-brown color due to accumulation of
hemosiderin from extravasated erythrocytes. Fibrosis
causes the cut edges to stand up rather than collapse.
fig: left :normal lung.
right:acute passive hyperemia/congestion, lung

fig:chronic passive
hyperemia/congestion, lung:
heart failure cells
Fig:Special stain for
haemosiderin (prusian blue) for
heart failure cells
b) Hepatic congestion
1-
Acute hepatic congestion:
•
the central vein and sinusoids are distended with blood,
•
and there may even be necrosis of centrally located hepatocytes.
•
The periportal hepatocytes, better oxygenated???WHY
because of their proximity to
hepatic arterioles
, experience less severe hypoxia and
may develop only reversible
fatty change
.
2-
Chronic passive congestion of liver:
Gross examination
•
the central regions of the hepatic lobules, viewed, are red-brown and slightly
depressed.
•
the surrounding zones of uncongested tan, sometimes fatty, liver (nutmeg liver).
Microscopic findings
•
centrilobular hepatocyte necrosis.
•
hemorrhage.
•
hemosiderin-laden macrophages.
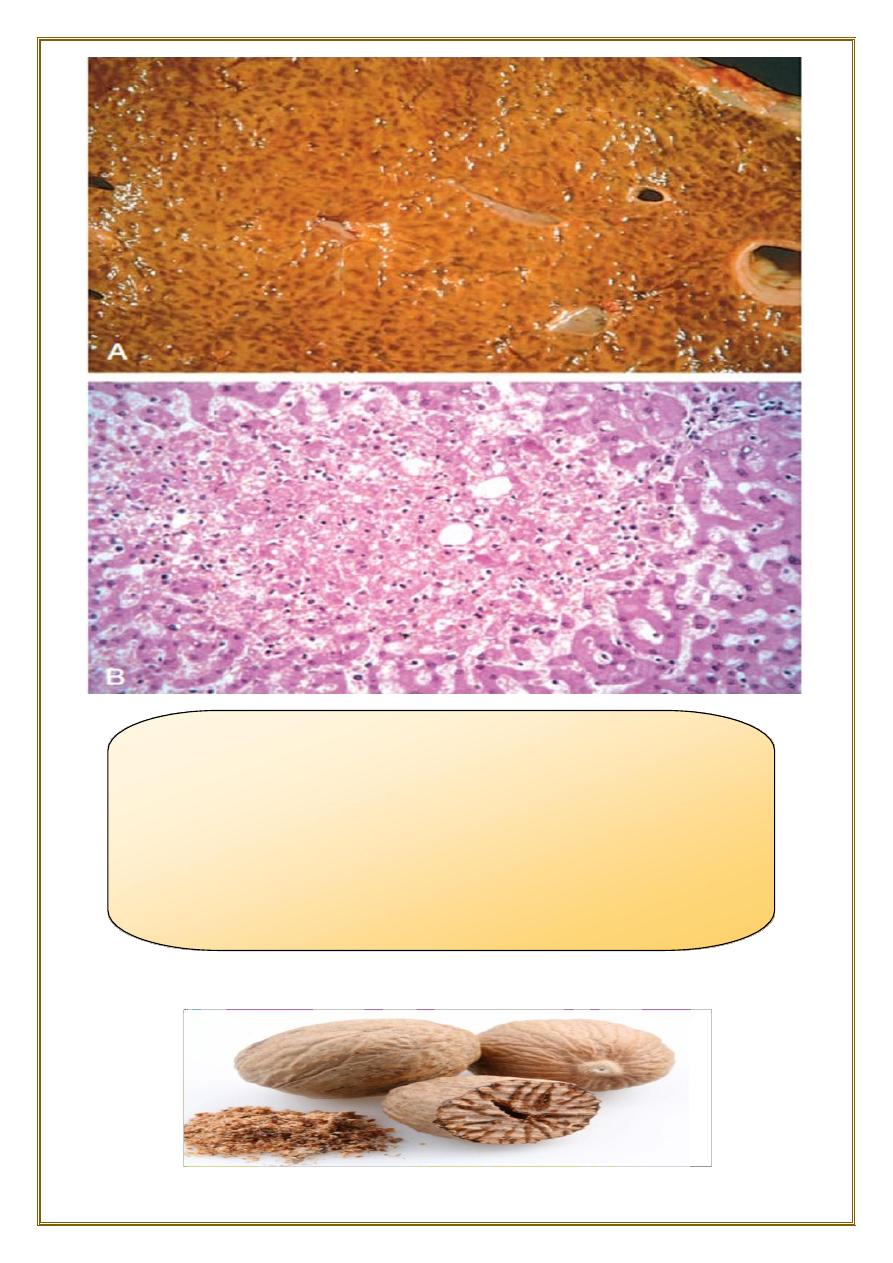
Fig. Liver with chronic passive congestion and hemorrhagic
necrosis.
(A) In this autopsy specimen, central areas are red and slightly
depressed compared with the surrounding tan viable
parenchyma, creating “nutmeg liver”
(so called because it resembles the cut surface of a nutmeg).
(B) Microscopic preparation shows centrilobular hepatic
necrosis with hemorrhage and scattered inflammatory cells.

Petechiae
Hemorrhage, defined as the extravasation of blood from vessels, is most often
the result of damage to blood vessels or defective clot formation.
•
capillary bleeding can occur in chronically congested tissues.
•
Trauma.
•
atherosclerosis.
•
or inflammatory or neoplastic erosion of a vessel wall also may lead to hemorrhage.
♦Bleeding may be extensive if the affected vessel is a large vein or artery.
♦
The risk of hemorrhage is increased in a wide variety of clinical disorders collectively
called:
hemorrhagic diatheses
.
Including:
inherited or acquired defects in:
•
vessel walls.
•
platelets.
•
or coagulation factors.
♦Hemorrhage may be manifested by different appearances and clinical
consequences.
♦
Hemorrhage may be
external
or accumulate within a tissue as a
hematoma
,
which ranges in significance from trivial to fatal.
♦Large bleeds into body cavities are described variously according to location
• hemothorax.
• hemopericardium.
• hemoperitoneum.
• hemarthrosis (in joints).
are minute (1 to 2 mm in diameter) hemorrhages into skin, mucous membranes, or
serosal surfaces causes include :
•
low platelet counts (thrombocytopenia).
•
defective platelet function.
•
and loss of vascular wall support, as in vitamin C deficiency.
Hemorrhage
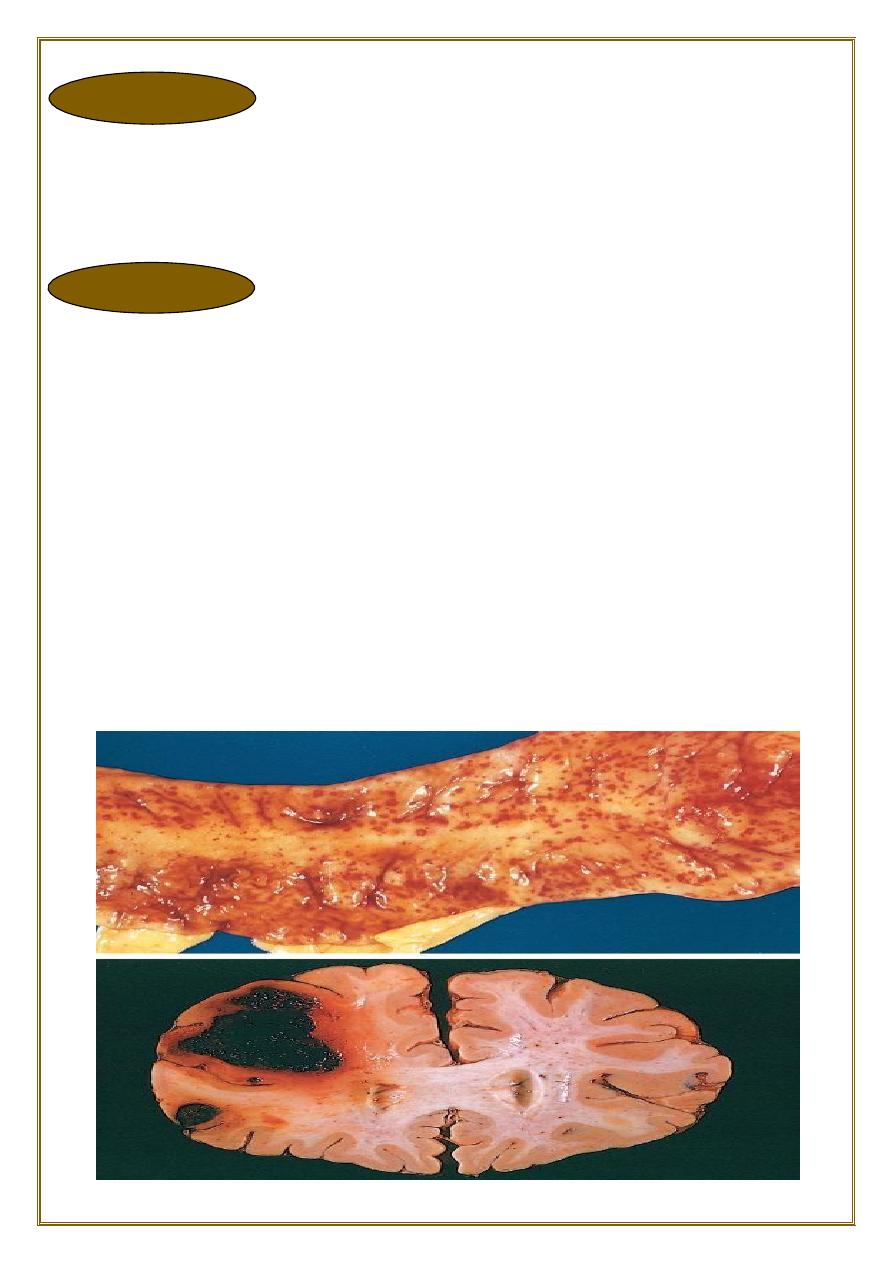
Ecchymoses
are slightly larger (3 to 5 mm) hemorrhages.
Purpura can result from
:
•
the same disorders that cause petechiae.
•
Trauma
vascular inflammation (vasculitis), and increased vascular fragility.
are larger (1 to 2 cm) subcutaneous hematomas (colloquially called bruises).
♦ Extravasated red cells are phagocytosed and degraded by macrophages; the
characteristic color changes of a bruise result from the enzymatic conversion of
hemoglobin
(red-blue color) to
bilirubin
(blue-green color) and eventually
hemosiderin
(golden-brown).
♦
The clinical significance of any particular hemorrhage depends on:
•
the volume of blood that is lost.
•
the rate of bleeding..
•
The site of hemorrhage also is important.
♦
chronic or recurrent external blood loss culminates in iron deficiency anemia
♦
By contrast, iron is efficiently recycled from phagocytosed red cells,
so internal
bleeding (e.g., a hematoma) does not lead to iron deficiency.
Purpura
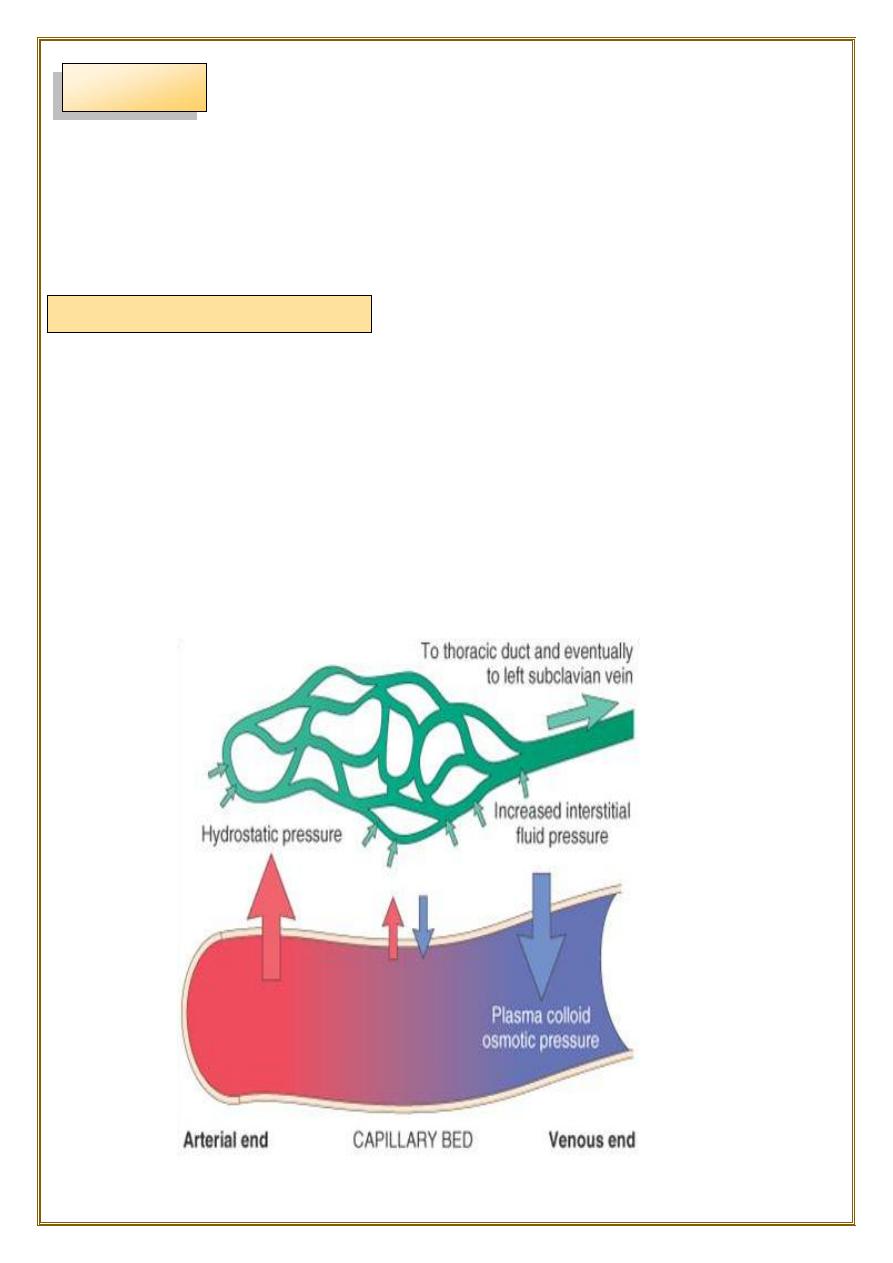
Mechanism of edema formation:
Definition:
edema is an accumulation of interstitial fluid within tissues.
Extravascular fluid can also collect in body cavities such as:
a) Hydrothorax.
b) Hydropericardium .
c) Hydroperitoneum (ascites) Anasarca.
♦Approximately 60% of lean body weight is water, two thirds of which is
intracellular.
Most of the remaining water is found in extracellular compartments in the form of
interstitial fluid; only 5% of the body’s water is in blood plasma.
♦
The capillary endothelium acts as a semi permeable membrane and highly
permeable to water & to almost all solutes in plasma with an exception of proteins.
Normally, any outflow of fluid into the interstitium from the arteriolar end of the
microcirculation is nearly balanced by inflow at the venular end. Therefore,
normally, there is very little fluid in the interstitium.
EDEMA
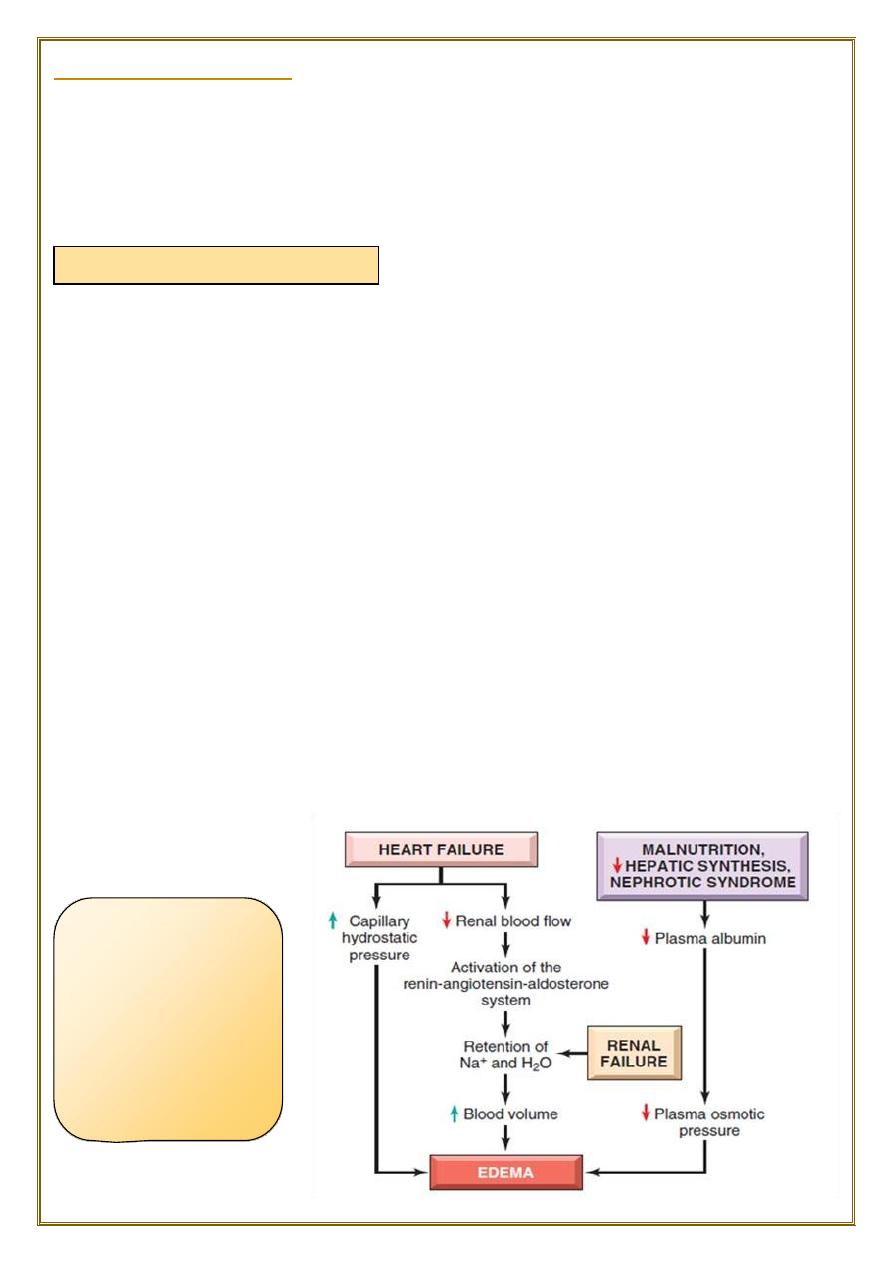
1) Increased Hydrostatic pressure
Renal failure also
cause edema
because of retention
of Na and water
leads to increase
blood volume
(increase hydrostatic
pressre).
causes of Edema are:
1) Increased Hydrostatic pressure.
2) Decrease plasma Oncotic pressure.
3) Increased vascular permeability.
4) Lymphatic channels obstruction.
5) Sodium retention.
♦
mainly caused by
disorders that impair venous return.
♦Local increases in intravascular pressure caused, for example, by deep venous
thrombosis in the lower extremity can cause edema restricted to the distal portion of
the affected leg.
♦Generalized increases in venous pressure, with resultant systemic edema, occur
most commonly in congestive heart failure.
Several factors increase venous hydrostatic pressure in patients with
congestive heart failure.
•
The reduced cardiac output leads to
systemic venous congestion
.
•
reduction in cardiac output results in hypoperfusion of the kidneys, triggering the
reninangiotensin-aldosterone axis
and inducing sodium and water retention
(secondary hyperaldosteronism)
.
♦
a vicious circle of fluid retention, increase blood volume, increased venous
hydrostatic pressures, and worsening edema ensues.
Unless cardiac output is restored or renal water retention is reduced this
vicious circle continues.

Nephrotic syndrome
3) Increased Vascular permeability:
•
Reduction of plasma
albumin
concentrations.
•
Under normal circumstances, albumin accounts for almost
half
of the total plasma
protein.
Common causes of reduced plasma osmotic pressure:
•
Albumin lost from the circulation.
•
Or albumin synthesized in inadequate amounts.
•
is the most important cause of albumin loss from the blood.
•
the glomerular capillaries become leaky, leading to the loss of albumin (and other
plasma proteins) in the urine and the development of
generalized edema
.
•
Reduced albumin synthesis occurs in the setting of severe liver disease (e.g.,
cirrhosis) and protein malnutrition.
low albumin levels lead to edema, reduced intravascular volume, renal
hypoperfusion, and secondary hyperaldosteronism. Increased salt and water retention
by the kidney fails to correct the plasma volume deficit and exacerbates the edema,
because the primary defect— low serum protein—persists.
•
usually occurs due to acute inflammation.
•
In inflammation, chemical mediators are produced.
Some of these mediators cause increased vascular permeability which leads to loss of
fluid & high molecular weight albumin and globulin into the interstitium.
Inflammatory edema differs from non inflammatory edema by the following
features:
a) Inflammatory edema (exudate)
•
Due to inflammation-induced increased permeability and leakage of plasma proteins.
•
Forms an exudate [protein rich]
Specific gravity > 1.012
b) Non-inflammatory oedema (transudate)
•
A type of edema occurring in hemodynamic derangement (i.e. increased plasma
hydrostatic pressure & decreased plasma oncotic pressure.)
•
Formed transudate [protein poor]
•
Specific gravity < 1.012.
2) Decrease plasma Oncotic pressure
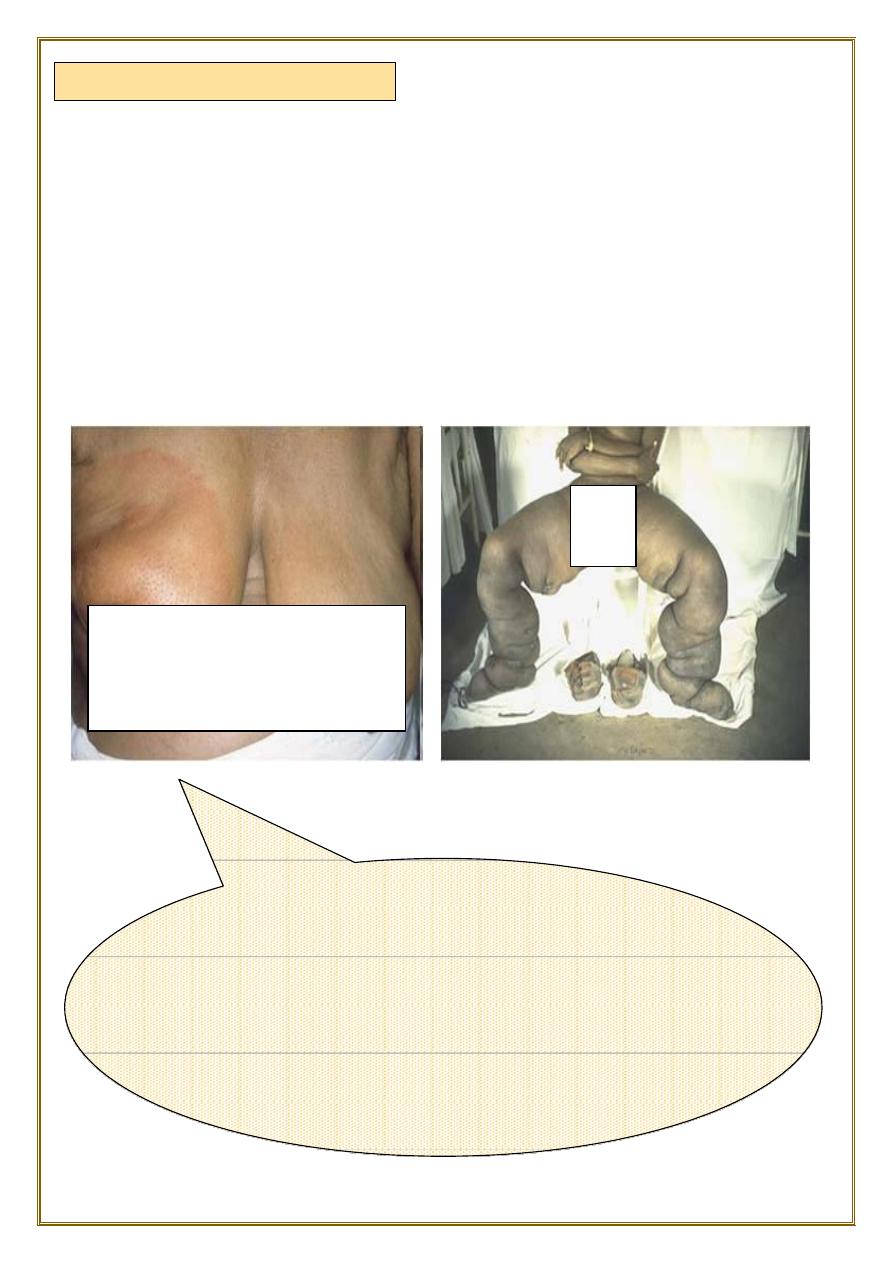
Breast, lymphedema secondary to breast carcinoma
– Clinical presentation Breas t cancer cells have blocked
the lymphatic channels draining fluid from the skin of
the right breast, leading to passive congestion and
resulting in a peau d'orange( orange skin) appearance.
Compare with the normal left breast.
♦
Edema may result from lymphatic obstruction that compromises resorption of fluid
from interstitial spaces. Impaired lymphatic drainage and consequent lymphedema It
usually results from a localized obstruction caused by an
inflammatory
or
neoplastic
conditions.
♦For example, the parasitic infection filariasis can cause massive edema of the
lower extremity and external genitalia (so-called “
elephantiasis
”) by
producing
inguinal lymphatic and lymph node fibrosis.
Infiltration and obstruction of superficial lymphatics by
breast cancer
may cause
edema of the overlying skin; the characteristic finely pitted appearance of the skin of
the affected breast is called peau d’orange (orange peel).
4) Lymphatic channels obstruction

5) Sodium and water retention
Morphology of edema
♦Subcutaneous edema
♦
Lymphedema also may occur as a complication of
therapy
. in women with breast
cancer who undergo axillary lymph node
resection
and/or
irradiation
, both of which
can disrupt and obstruct lymphatic drainage, resulting in severe
lymphedema of the
arm
.
♦
Excessive retention of salt (and its obligate associated water) can lead to edema by
increasing hydrostatic pressure (because of expansion of the intravascular volume)
and reducing plasma osmotic pressure.
♦
Excessive salt and water retention are seen in a wide variety of diseases that
compromise renal function, including poststreptococcal glomerulonephritis and acute
renal failure.
♦
Causes of sodium and water retention:
1- excessive salt intake with renal insufficiency.
2- increased tubular reabsorption of sodium.
3-
Renal hypo perfusion.
4-
Increased renin- angiotensin- aldosterone secretion.
♦Gross examination:
clearing and separation of the extracellular matrix (ECM) elements. edema most
commonly encountered in:
•
subcutaneous tissues,
•
lungs,
•
and brain.
•
can be diffuse.
•
but usually accumulates preferentially in parts of the body where hydrostatic
pressures are highest.
edema typically is most pronounced in the legs with standing and the sacrum
with recumbency.
• dependent edema. Finger pressure over edematous subcutaneous tissue displaces
the interstitial fluid, leaving a finger-shaped depression; this appearance is called
pitting edema
.
•
Edema resulting from renal dysfunction or nephrotic syndrome often manifests first
in
loose connective tissues (e.g., the eyelids, causing periorbital edema).
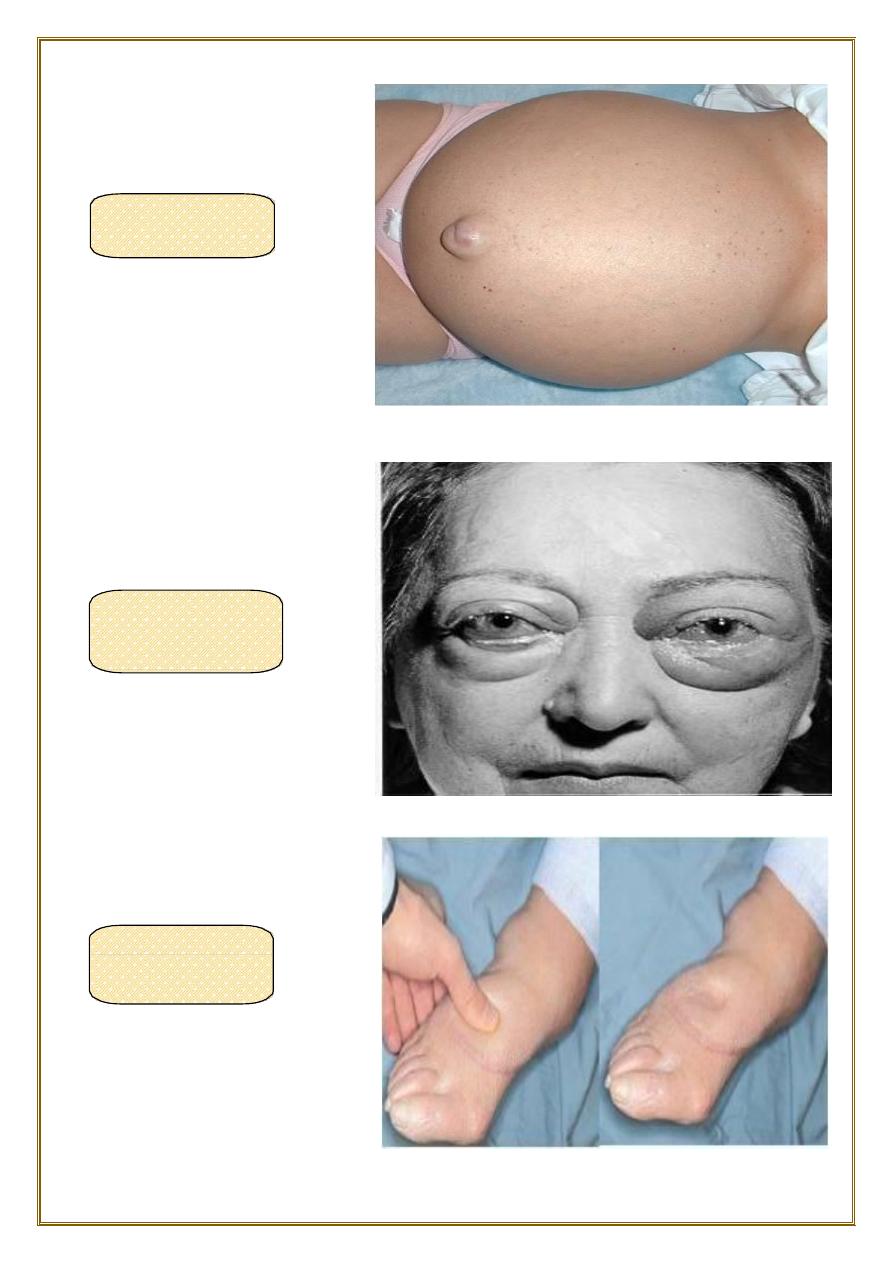
PERI ORBITAl
EDEMA
“PITTING”
EDEMA
ASCITES
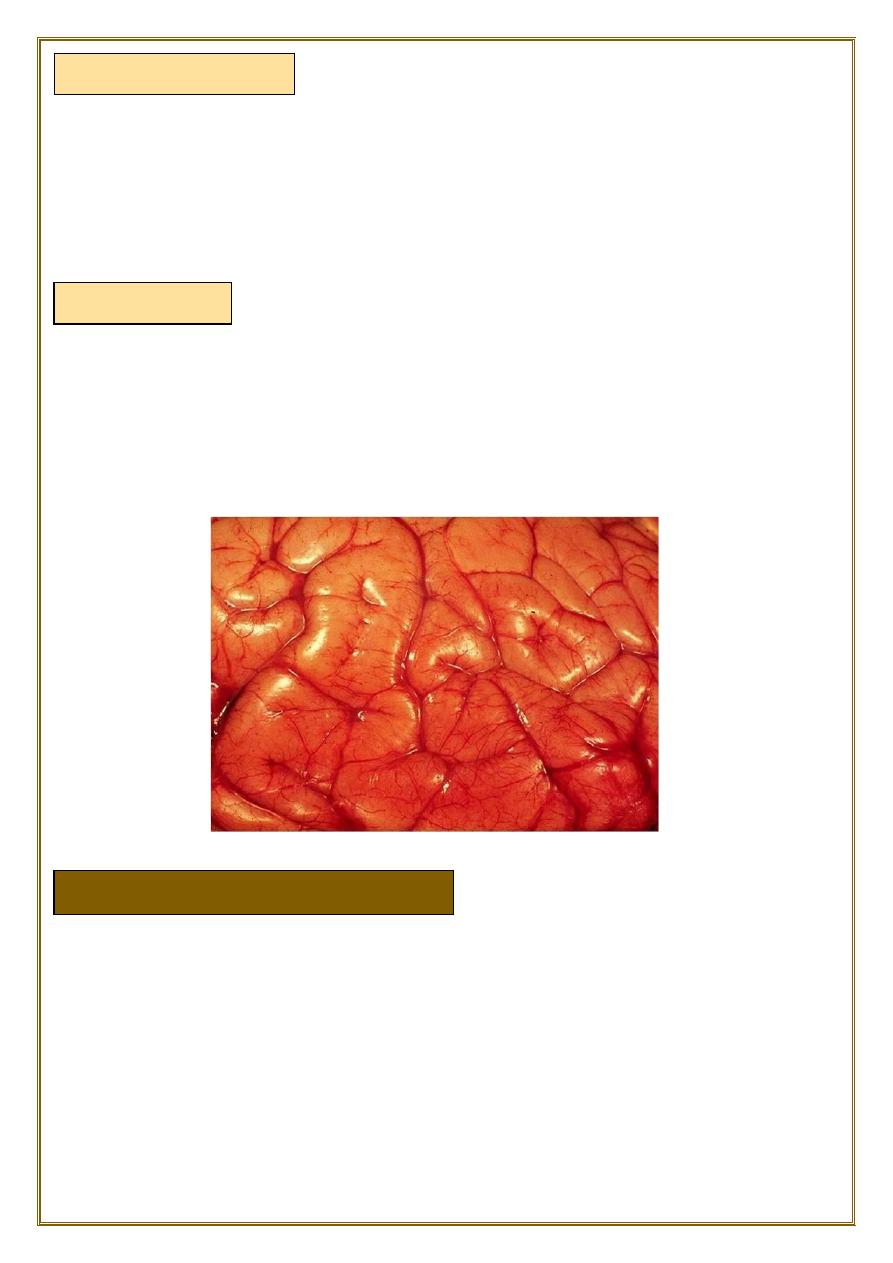
♦Brain edema
HEMOSTASIS AND THROMBOSIS
•
the lungs often are two to three times their normal weight,
•
and sectioning shows frothy, sometimes blood-tinged fluid.
consisting of a mixture of:
•
air.
•
edema fluid.
•
and extravasated red cells.
can be:
•
localized (e.g., because of abscess or tumor).
•
generalized depending on the nature and extent of the pathologic process or injury.
With generalized edema:
•
The
sulci
are narrowed .
•
The
gyri
swell and become flattened against the skull.
♦Normal hemostasis
•
comprises a series of regulated processes that culminate in the formation of a blood
clot that limits bleeding from an injured vessel.
•
The pathologic counterpart of hemostasis is thrombosis, the formation of blood clot
(thrombus) within non-traumatized, intact vessels.
♦Pulmonary edema
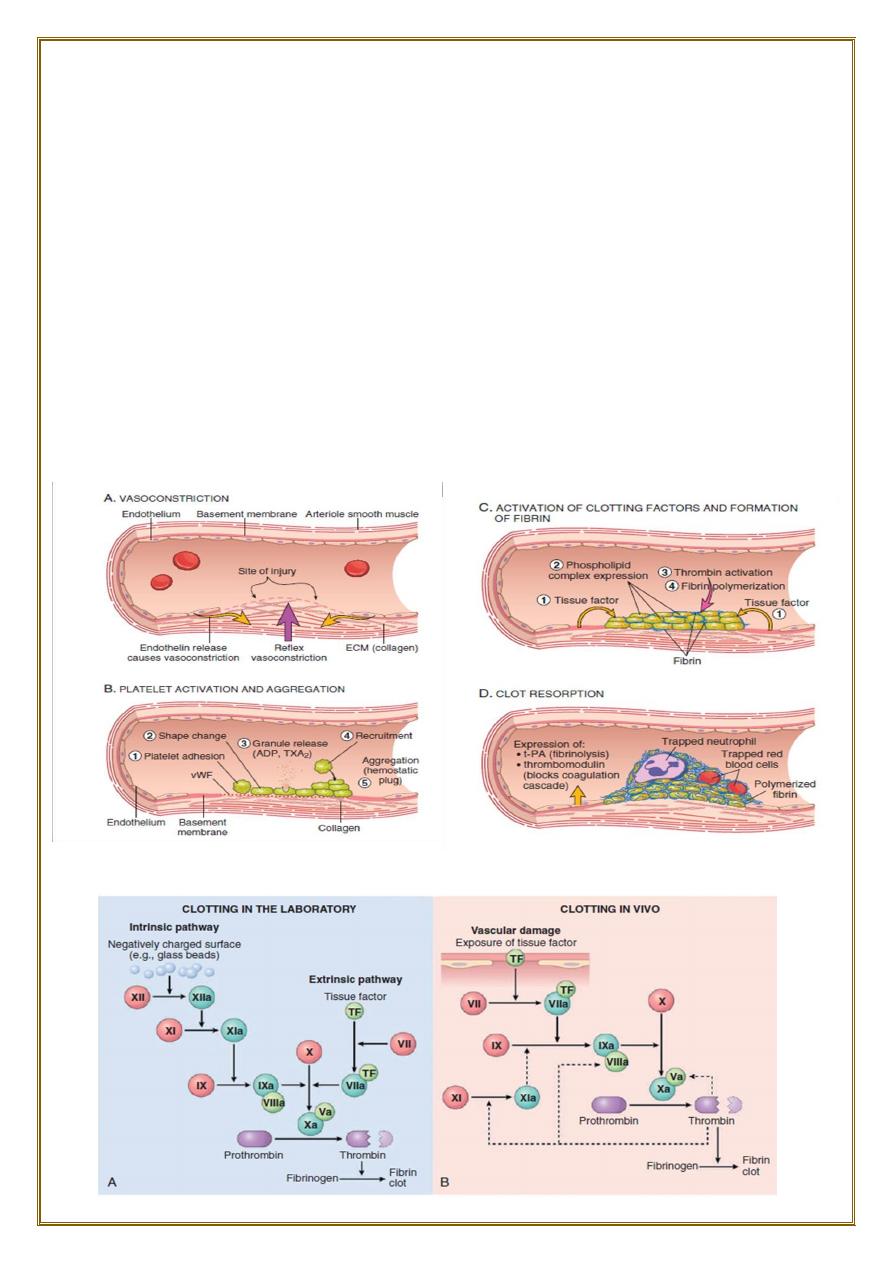
•
(A) After vascular injury
, local neurohumoral factors induce a transient
vasoconstriction.
•
(B) Platelets bind via glycoprotein Ib
(GpIb) receptors to von Willebrand factor
(VWF) on exposed ECM and are activated, undergoing a shape change and granule
release. Released ADP and thromboxane A2 (TXA2) induce additional platelet
aggregation through platelet GpIIb-IIIa receptor binding to fibrinogen, and form the
primary hemostatic plug.
•
(C) Local activation of the coagulation cascade
results in fibrin polymerization,
“cementing” the platelets into a definitive secondary hemostatic plug.
•
(D) Counterregulatory mechanisms
, mediated by tissue plasminogen activator (t-
PA, a fibrinolytic product) and thrombomodulin, confine the hemostatic process to
the site of injury.
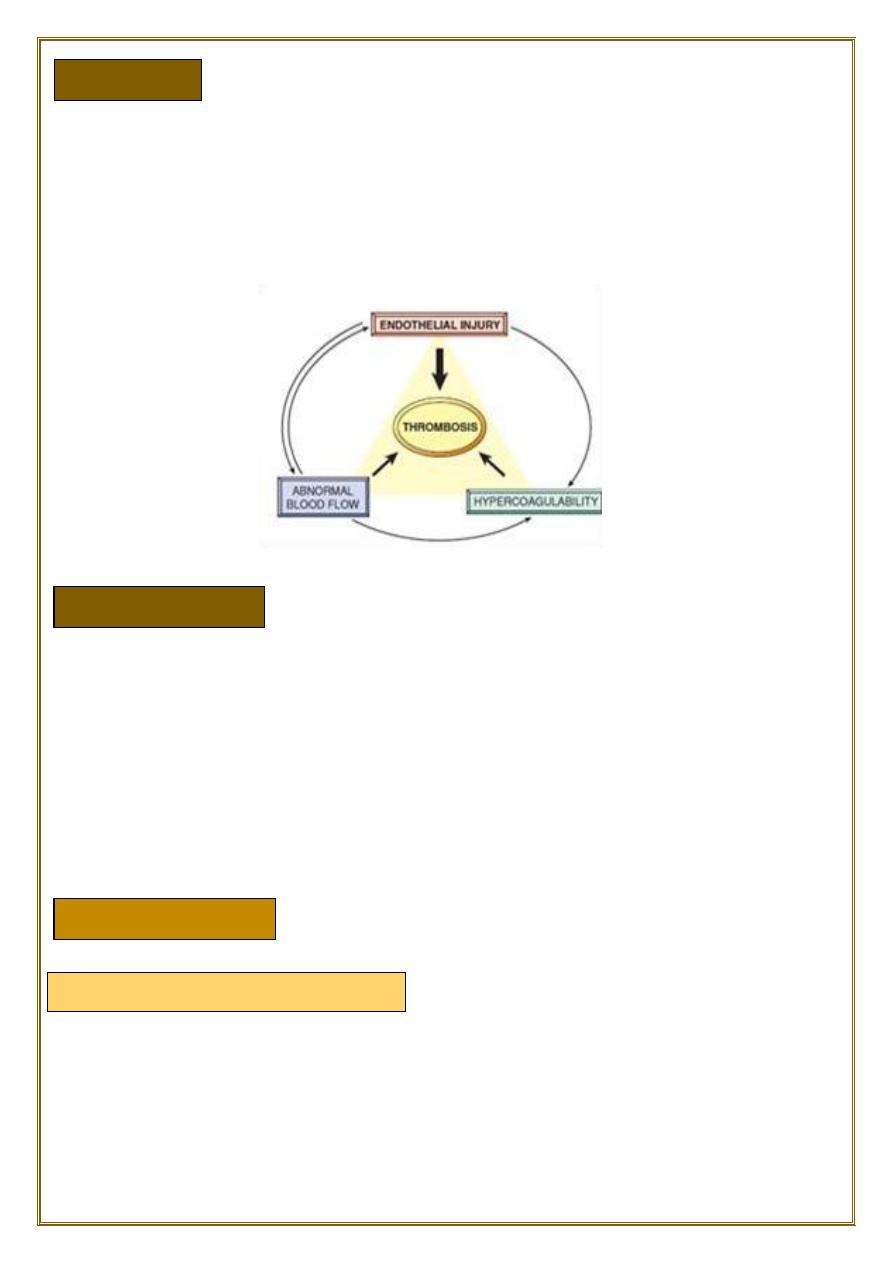
Endothelial injury
Abnormal Blood Flow
•
The pathologic counterpart of hemostasis is thrombosis, the formation of blood clot
(thrombus) within non-traumatized, intact vessels.
The primary abnormalities that lead to intravascular thrombosis are:
(1) endothelial injury.
(2) stasis or turbulent blood flow.
(3) hypercoagulability of the blood (the so-called “Virchow triad”).
•
Endothelial injury leading to platelet activation.
underlies thrombus formation in the
heart and the arterial circulation
, where the
high rates of blood flow impede clot formation.
This is the reason behind the use of aspirin and other platelet inhibitors in coronary
artery disease and acute myocardial infarction.
severe endothelial injury may trigger thrombosis by exposing VWF and tissue factor.
Most common examples are:
•
Endocardial injury during myocardial infarction.
•
Injury over ulcerated plaque in severely atherosclerotic arteries.
contributes to:
•
arterial thrombosis.
•
cardiac thrombosis
by causing:
•
endothelial injury or dysfunction.
•
forming countercurrents and local pockets of stasis.
Thrombosis
Turbulence (chaotic blood flow)

Hypercoagulability
is a major factor in the development of venous thrombi.
Under conditions of normal
laminar blood flow
, platelets (and other blood cells) are
found mainly in the
center
of the vessel lumen.
separated from the endothelium by a slower-moving layer of plasma.
stasis and turbulence have the following deleterious effects:
•
Both promote endothelial cell activation and enhanced procoagulant activity.
•
Stasis allows platelets and leukocytes to come into contact with the endothelium
when the flow is sluggish.
•
Stasis also slows the washout of activated clotting factors and impedes the inflow of
clotting factor inhibitors.
Turbulent and static blood flow contributes to thrombosis in a number of
clinical settings.
Ulcerated atherosclerotic plaques
expose subendothelial ECM ,turbulence.
aneurysms
create local stasis.
Acute myocardial infarction
results in focally noncontractile myocardium.
Ventricular remodeling after more remote infarction can lead to aneurysm formation.
cause local blood stasis.
Mitral valve stenosis
(e.g., after rheumatic heart disease) results in left atrial
dilation. In conjunction with atrial fibrillation, a dilated atrium also produces stasis
and is a prime location for the development of thrombi.
Hyperviscosity syndromes
(such as polycythemia vera,) increase resistance to flow
and cause small vessel stasis;
sickle cell anemia
the deformed red cells cause vascular occlusions, and the
resultant stasis also predisposes to thrombosis.
• Hypercoagulability refers to an abnormally high tendency of the blood to clot,
and is typically caused by alterations in coagulation factors.
•
It is an important underlying risk factor for venous thrombosis.
•
can be divided into:
primary (genetic) and secondary (acquired) disorders.
STASIS

♦Secondary (Acquired)
Common (>1% of the Population)
Factor V mutation.
Prothrombin mutation.
Increased levels of factor VIII, IX, or XI or fibrinogen.
♦ Rare
Anti-thrombin III deficiency .
Protein C deficiency.
Protein S deficiency.
Prolonged bed rest or immobilization.
Myocardial infarction.
Atrial fibrillation.
Tissue injury (surgery, fracture, burn).
Cancer.
Prosthetic cardiac valves.
Disseminated intravascular coagulation .
Heparin-induced thrombocytopenia.
•
Thrombi can develop anywhere in the cardiovascular system.
•
Arterial or cardiac thrombi
typically arise at sites of endothelial injury or
turbulence;
•
venous thrombi
characteristically occur at sites of stasis.
•
Thrombi are
focally attached to the underlying vascular surface
.
•
propagate toward the heart:
•
arterial thrombi grow
in a
retrograde
direction from the point of attachment,
•
venous thrombi
extend in the
direction
of blood flow.
•
The propagating portion of a thrombus tends to be poorly attached and therefore
prone to fragmentation and migration through the blood as an
embolus
.
•
Thrombi can have grossly (and microscopically) apparent laminations called lines
of Zahn
.
•
these represent pale platelet and fibrin layers alternating with darker red cell–rich
layers.
•
Such lines are significant in that they are only found in thrombi that form in flowing
blood;
♦Primary (Genetic)
MORPHOLOGY

•
their presence can therefore usually distinguish
antemortem thrombosis from the
bland nonlaminated post mortum thrombi
.
•
Although thrombi formed in the “low-flow”
venous system
superficially resemble
postmortem clots, careful evaluation generally shows
ill-defined laminations
.
•
Thrombi occurring in heart chambers or in the aortic lumen are designated as
mural thrombi
.
♦Arterial thrombi
•
are frequently occlusive.
•
They are typically rich in platelets, as the processes underlying their development
(e.g., endothelial injury) lead to platelet activation.
•
Although usually superimposed on a ruptured
atherosclerotic plaque
, other
vascular injuries (
vasculitis, trauma
) can also be underlying causes.
♦Venous thrombi (phlebothrombosis):
•
are almost invariably occlusive;
•
they frequently propagate some distance toward the heart, forming a long cast
within the vessel lumen that is prone to give rise to emboli.
•
they contain more enmeshed red cells, leading to the moniker red, or stasis,
thrombi.
•
The veins of the lower extremities are most commonly affected.
♦
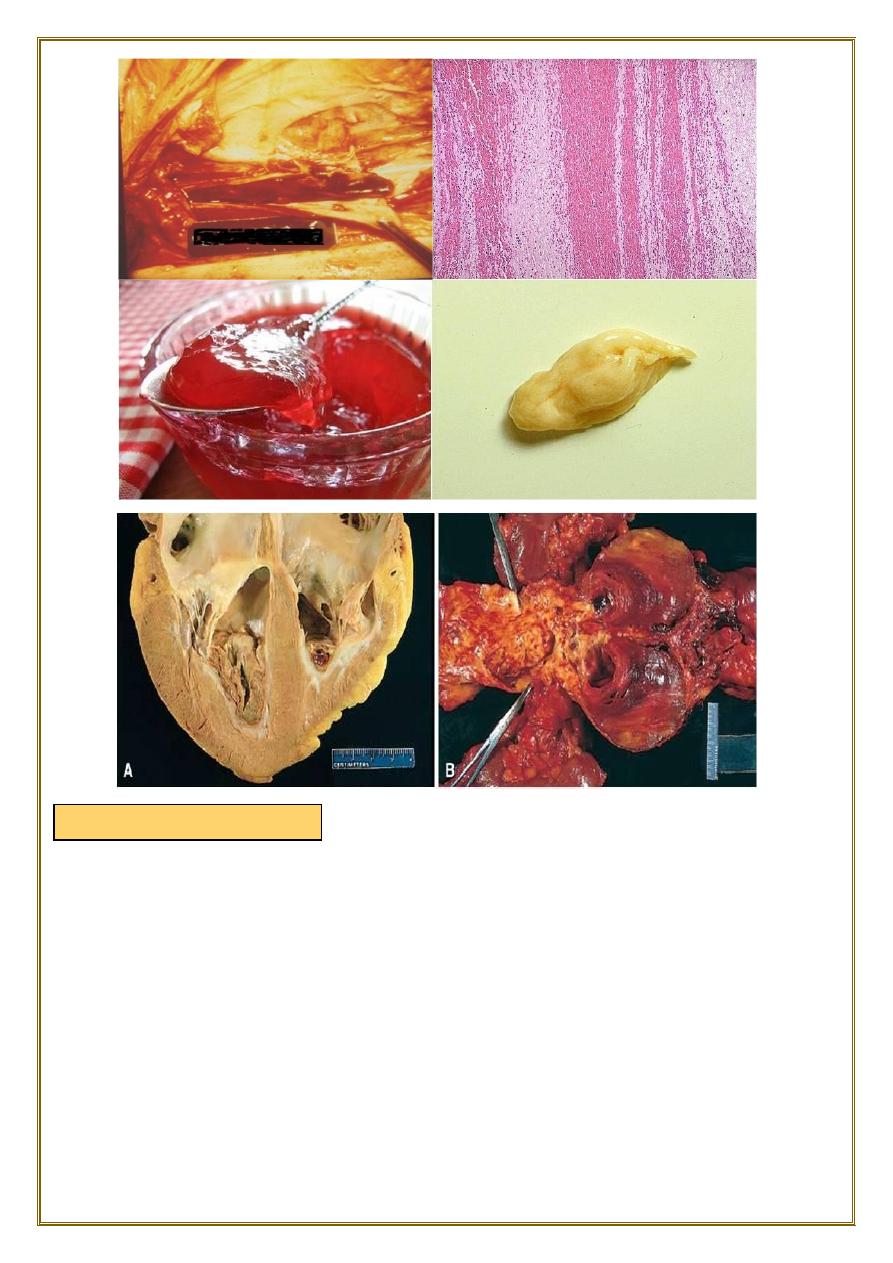
At autopsy, postmortem clots are:
• gelatinous
and because of red cell settling they have a dark red dependent portion and a
yellow “chicken fat” upper portion;
they also are usually not attached to the underlying vessel wall.
♦By contrast, red thrombi typically are:
firm,
focally attached to vessel walls,
and the contain gray strands of deposited fibrin.
Thrombi on heart valves are called vegetations.
•
Propagation.
The thrombus enlarges through the accretion of additional
platelets and fibrin, increasing the odds of vascular occlusion.
•
Embolization
. Part or all of the thrombus is dislodged and transported elsewhere
in the vasculature.
•
Dissolution
. fibrinolytic factors may lead to its rapid shrinkage and complete
dissolution.
•
Organization and recanalization
. Older thrombi become organized by the
ingrowth of
endothelial cells, smooth muscle cells, and fibroblasts
.
♦
In time, capillary channels are formed reestablishing the continuity of the original
lumen.
♦
Further recanalization can sometimes convert a thrombus into a vascularized mass
of connective tissue that is eventually incorporated into the wall of the remodeled
vessel.
Fate of the Thrombus
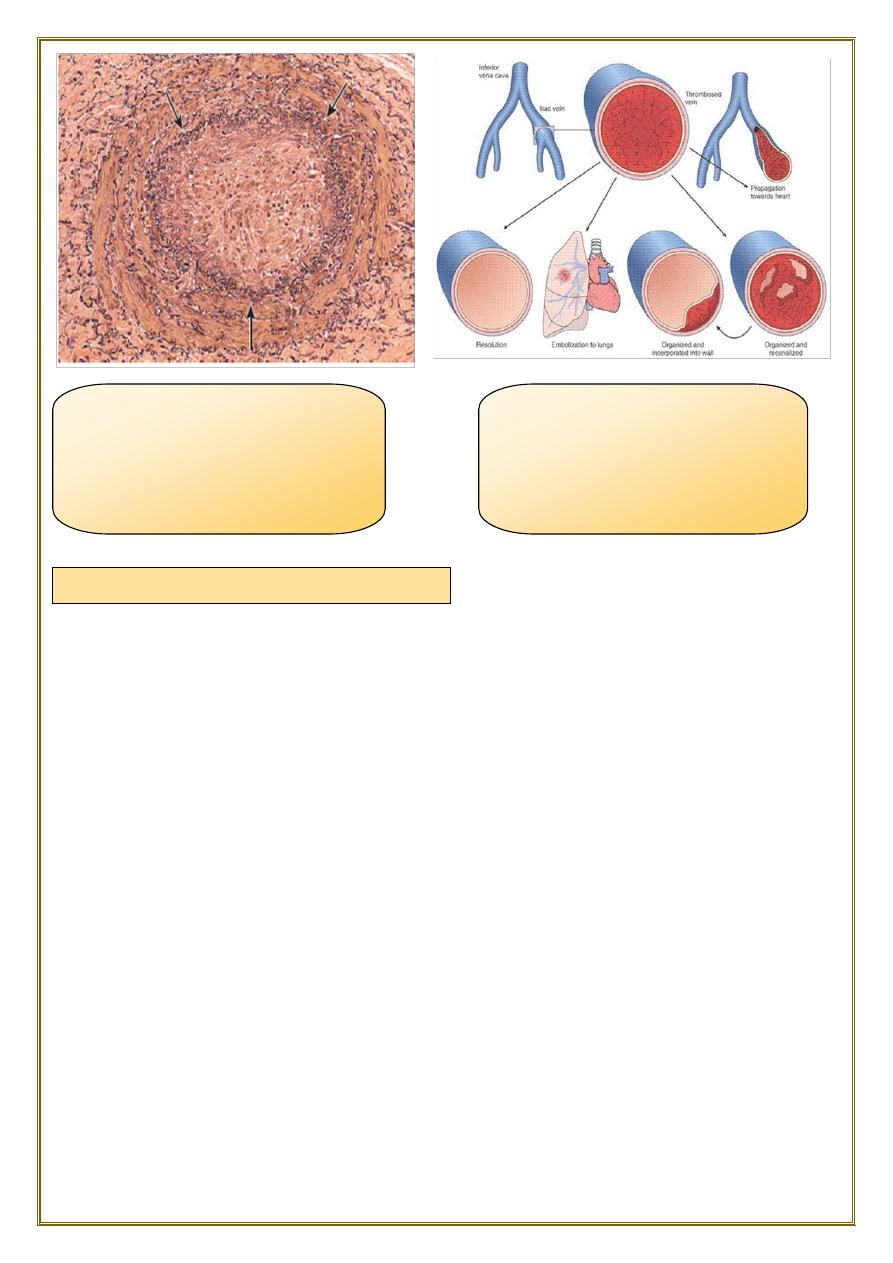
Most venous thrombi occur in the superficial or the deep veins of the leg.
Superficial venous thrombi
usually arise in the saphenous system.
particularly in the setting of varicosities.
these rarely embolize.
but they can be painful.
and can cause local congestion.
and swelling from impaired venous outflow,
predisposing the overlying skin to the development of infections and varicose
ulcers.
Deep venous thrombosis DVT
(DVTs) in the larger leg veins at or above the knee joint (e.g., popliteal, femoral,
and iliac veins).
are more serious because they are prone to embolize.
Although such DVTs may cause local pain and edema, collateral channels often
circumvent the venous obstruction. Consequently, DVTs are entirely asymptomatic
in approximately 50% of patients and
are recognized only after they have embolized
to the lungs
.
DVTs are associated with stasis and hypercoagulable states.
Fig. An organized thrombus. Low-
power view of a thrombosed artery
stained for elastic tissue. The original
lumen is delineated by the internal
elastic lamina (arrows) and is
completely filled with organized
thrombus.
deep pelvic vein thrombus, the
prime source of pulmonary emboli,
the other source would be deep
pelvic veins. superficial vein
thromboses do not usually
embolize to the lungs.
Venous Thrombosis (Phlebothrombosis)

•
An embolus is a detached intravascular solid, liquid, or gaseous mass that is carried
by the blood from its point of origin to a distant site, where it often causes tissue
dysfunction or infarction.
The vast majority of emboli derive from a dislodged thrombus—hence the term
thromboembolism
.
Less commonly, emboli are composed of:
• fat droplets.
bubbles of air or nitrogen.
tumor fragments.
bits of bone marrow.
or amniotic fluid.
•
Inevitably, emboli lodge in vessels too small to permit further passage, resulting in
partial or complete vascular occlusion
.
•
depending on the
site of origin
, emboli can arrest anywhere in the vascular tree.
The primary consequence of systemic embolization
•
is ischemic necrosis (infarction) of downstream tissues,
•
whereas embolization in the pulmonary circulation leads to
hypoxia ,hypotension,
and rightsided heart failure
.
•
Pulmonary emboli originate from deep venous thrombosis and are responsible for
the most common form of thromboembolic disease
.
•
In more than 95% of cases, venous emboli originate from thrombi within deep leg
veins proximal to the popliteal fossa.
•
Fragmented thrombi from DVTs are carried through progressively
larger channels
and usually pass through the
right side
of the heart before arresting in the
pulmonary vasculature.
Depending on size, a PE can occlude:
•
the main pulmonary artery,
•
lodge at the bifurcation of the right and left pulmonary arteries (saddle embolus),
•
or pass into the smaller, branching arterioles.
EMBOLISM
Pulmonary Thromboembolism

the major clinical and pathologic features are the following:
♦
Most pulmonary emboli (60%–80%) are small and
clinically silent
.
With time, they undergo organization and become incorporated into the vascular
wall. At the other end of the spectrum, a large embolus that blocks a major
pulmonary artery can cause
sudden death
.
♦
Embolic obstruction of medium-sized arteries and subsequent rupture of
downstream capillaries rendered anoxic can cause
pulmonary hemorrhage
. Such
emboli do not usually cause pulmonary infarction because the area also receives
blood through an intact bronchial circulation (dual circulation).
However, a similar embolus in the setting of left-sided cardiac failure (and
diminished bronchial artery perfusion) can lead to a
pulmonary hypertension and
pulmonary infarct
.
♦
Embolism to small end-arteriolar pulmonary branches usually causes infarction.
♦
Multiple emboli occurring through time can cause and right ventricular failure (cor
pulmonale).
•
Systemic thromboembolism refers to emboli travelling within arterial circulation &
impacting in the systemic arteries.
•
Most systemic emboli (80%) arise from intracardiac mural thrombi.
•
two thirds of intracardiac mural thrombi are associated with left ventricular wall
infarcts.
•
and another quarter with dilated left atria secondary to rheumatic valvular heart
disease.
Systemic thromboembolism

•
The remaining (20%) of systemic emboli arise from :
thrombi on ulcerated athrosclerotic plaques.
or fragmentation of valvular vegetation.
Aortic aneurysm.
Paradoxical emboli from venous side.
•
Unlike venous emboli, which tend to lodge primarily in one vascular bed
(the lung), arterial emboli can travel to a wide variety of sites.
-the
lower extremities
(75%).
-&
the brain
(10%).
-with the rest lodging in the
intestines
,
kidney
&
spleen
.
•
The consequences of embolization depend on:
•
the caliber of the occluded vessel.
•
the collateral supply.
•
and the affected tissue’s vulnerability to anoxia.
••
arterial emboli often lodge in end arteries and cause infarction
.
•
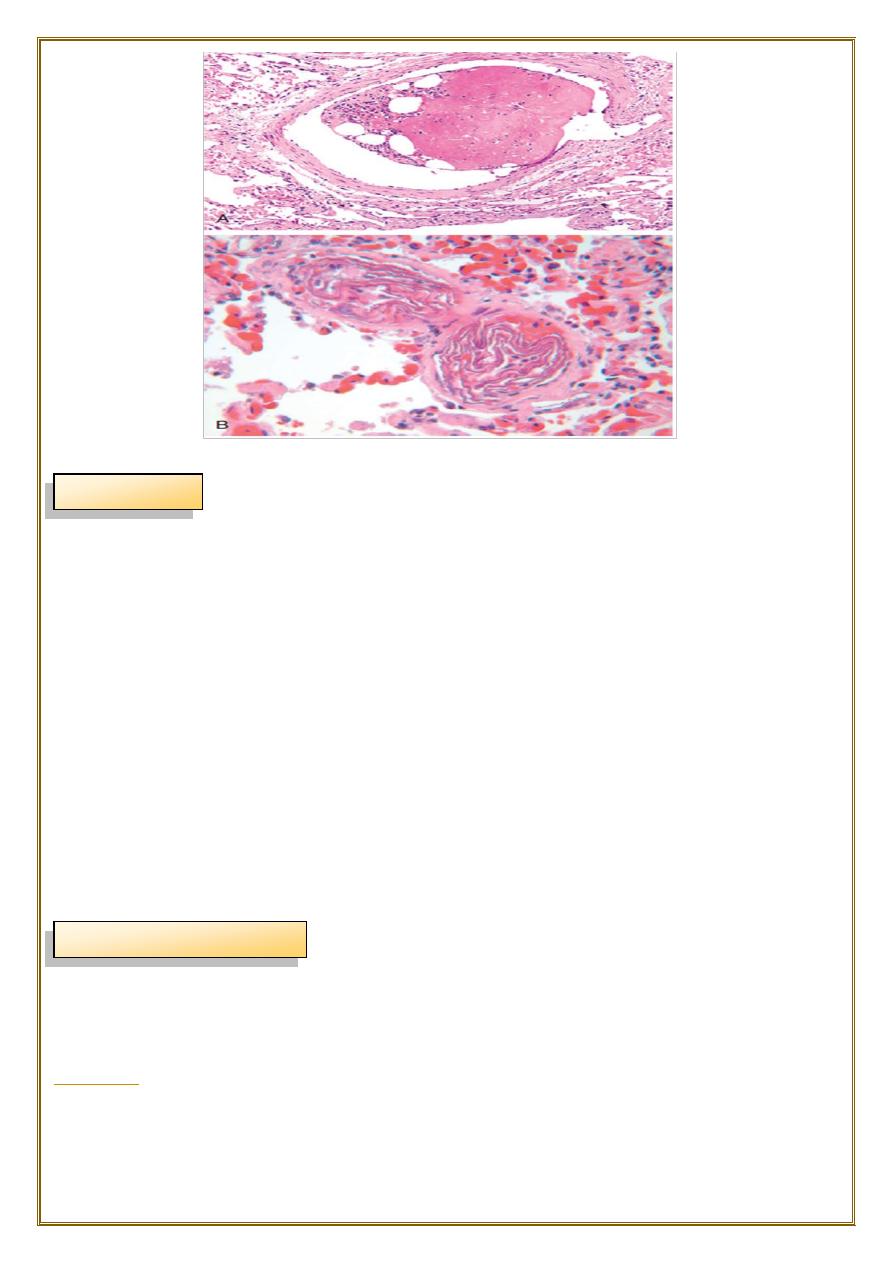
Fat embolism usually follows fracture of bones and other type of tissue injury.
•
After the injury, globules of fat frequently enter the circulation.it is asymptomatic in
most cases and fat is removed.
•
But in some severe injuries the fat emboli may cause occlusion of
pulmonary or
cerebral
microvasculature
•
fat embolism syndrome may result.
Fat embolism syndrome
•
typically begins 1 to 3 days after injury during which the raised tissue pressure
caused by swelling of damaged tissue forces fat into marrow sinosoid & veins.
•
The features of this syndrome are
:
-a sudden onset of dyspnea, blood stained sputum, tachycardia.
-mental confusion with neurologic symptoms sometimes progress to delirium &
coma.
Fat Embolism
Gas bubbles within the circulation can obstruct vascular flow and cause distal
ischemic injury almost as readily as thrombotic masses.
♦
Air may enter the circulation during:
Obstetric procedures
Chest wall injury
In deep see divers & under water construction workers.
Neck wounds penetrating the large veins
Cardio thoracic surgery.
Arterial catheterisation& intravenous infusion.
♦
Generally, in excesses of 100cc is required to have a clinical effect and 300cc or
more may be fatal.
♦
The bubbles act like physical obstructions and may coalesce to form a frothy mass
sufficiently large to occlude major vessels.
It is a grave but uncommon, unpredictable complication of labour which may
complicate vaginal delivery, caesarean delivery and abortions
. It had mortality rate
over 80%. The amniotic fluid containing fetal material enters via the placental bed &
the ruptured uterine veins.
Leads to:
•
hypotensive shock
•
seizure & coma
•
pulmonary edema
•
50% of the cases will develop DIC
Air embolism
Amniotic fluid embolism

♦
Definition:
An infarct is an area of ischemic necrosis caused by occlusion of the vascular supply
to the affected tissue.
Infarction primarily affecting the heart and the brain is a
common and extremely important cause of clinical illness.
♦
Causes:
•
Arterial thrombosis or arterial embolism underlies the vast majority of infarctions.
♦
Less common causes of arterial obstruction include:
1. vasospasm,
2. expansion of an atheroma secondary to intraplaque hemorrhage.
3. and extrinsic compression of a vessel, such as by tumor, a dissecting aortic
aneurysm.
4. Other uncommon causes of tissue infarction include vessel twisting (e.g., in
testicular torsion or bowel volvulus).
Factors That Influence Infarct Development
♦
Anatomy of the vascular supply.
The presence or absence of an
alternative blood supply lung
by the pulmonary and
bronchial arteries means that obstruction of the pulmonary arterioles does not cause
lung infarction unless the bronchial circulation also is compromised.
Similarly, the
liver
, which receives blood from the hepatic artery and the portal vein,
and the
hand and forearm
, with its parallel radial and ulnar arterial supply, are
resistant to infarction. By contrast, the
kidney and the spleen both have end-arterial
circulations
.
♦
Rate of occlusion.
Slowly developing occlusions are less likely to cause infarction because they allow
time for the development of
collateral
blood supplies. For example, small
interarteriolar anastomoses, which normally carry minimal blood flow, interconnect
the three major coronary arteries.
♦
Tissue vulnerability to hypoxia.
Neurons
undergo irreversible damage when deprived of their blood supply for only 3
to 4 minutes.
Myocardial cells
, although hardier than neurons, still die after only 20
to 30 minutes of ischemia. By contrast,
fibroblasts
within myocardium remain viable
after many hours of ischemia.
Morphology of infarcts
Types of infarcts Infarcts are classified depening on:
A) the basis of their colour (reflecting the amount of haemorrhage) into
:
1. Hemorrhagic (Red) infarcts.
2. Anemic (White) infarcts.
Infract

B) the presence or absence of microbial infection into
:
1. Septic infarcts.
2. Bland infarcts.
•Red infarcts occur in:
a)
Venous occlusions as in ovarian torsion
b)
Loose tissues
such as the lung which allow blood to collect in infarct zone.
c
) Tissues with dual circulations
(e.g. the lung), permitting flow of blood from
unobstructed vessel in to necrotic zone.
d) In
tissues
that were previously congested because of sluggish outflow of blood.
e) When
blood flow
is reestablished to a site of previous arterial occlusion &
necrosis.
•
White infarcts occur in:
a)
Arterial occlusion
in organs with a single arterial blood supply.
b)
Solid organs
such as the heart, spleen, & kidney, where the solidity of the tissue
limits the amount of hemorrage that can percolate or seep in to the area of ischemic
necrosis from the nearby capillaries.
•
Gross:
All infarcts are
wedge-shaped
with the occluded vessel at the apex and the periphery
of the organ forming the base of the wedge. The infarction will induce inflammation
in the tissue surrounding the area of infarction.
Following
inflammation
, some of the infarcts may show recovery, however, most are
ultimately replaced with scars
except in the brain
.
•
Microscopy:
The dominant histologic feature of infarction is ischemic coagulative necrosis. The
brain is an exception to this generalization, where liquifactive necrosis is common.

♦
Definition:
Shock is a state in which diminished cardiac output or reduced effective circulating
blood volume impairs tissue perfusion and leads to cellular hypoxia.
♦
Its causes fall into three general categories:
♦Cardiogenic shock
results from low cardiac output as a result of myocardial pump failure. It may be
caused by myocardial damage (infarction), ventricular arrhythmias, extrinsic
compression (cardiac tamponade) or outflow obstruction (e.g.,
pulmonaryembolism).
♦Hypovolemic shock
results from low cardiac output due to loss of blood or plasma volume (e.g., resulting
from hemorrhage or fluid loss from severe burns).
♦Septic shock
is triggered by microbial infections and is associated with severe systemic
inflammatory response syndrome(SIRS). In addition to microbes, SIRS may be
triggered by a variety of insults, including burns, trauma, and/or pancreatitis.
The common pathogenic mechanism is a massive outpouring of inflammatory
mediators from innate and adaptive immune cells that produce
:
•
arterial vasodilation.
•
vascular leakage.
•
and venous blood pooling.
These cardiovascular abnormalities result in tissue hypoperfusion, cellular hypoxia,
and metabolic derangements that lead to organ dysfunction and, if severe and
persistent, organ failure and death.
•
Pathogenesis of septic shock:
-It results from the spread & expansion of an initially localized infection like
pneumonia into the blood stream.
-Most causes of septic shock (~70%) are caused by endotoxin-producing gram-
negative bacilli, hence the term endotoxic shock.
•
Septic shock acting on:
•
The heart
– causing decreased myocardial contractility which results in low cardiac
output,
•
Blood vessel
– causing systemic vasodilation
•
The mediators
also cause widespread endothelial injury & activation of the
coagulation system resulting in DIC.
•
Lung
– causing alveolar capillary damage resulting in adult respiratory distress
syndrome (ARDS).
Shock

♦Anaphylactic shock
results from systemic vasodilation and increased vascular permeability that is
triggered by an immunoglobulin E–mediated hypersensitivity reaction.
Less commonly, shock can result from a loss of vascular tone associated with
anesthesia or secondary to a spinal cord injury (
neurogenic shock
).
Stages of shock
Uncorrected shock passes through 3 important stages:
1)
An initial nonprogressive phase
during which reflex compensatory mechanisms are activated and vital organ
perfusion is maintained.
2)
Progressive stage (Established shock)
- characterized by tissue hypoperfusion and onset of worsening circulatory and
metabolic derangement, including acidosis.
3)
An irreversible stage
- in which cellular and tissue injury is so severe that even if the hemodynamic
defects are corrected, survival is not possible.
Morphology of shock:
All organs are affected in severe shock. In shock, there is widespread tissue
hypoperfusion involving various organs such as the heart, brain, & kidney.
widespread hypoxic tissue necrosis.
The widespread tissue necrosis manifests as
multiple organ dysfunction [MODS].
And
lungs may show ARDS
.
