
Prof.Dr.H.D.El-Yassin
I-REGULATION OF ENZYMES BY SUBSTRATE AND PRODUCT CONCENTRATION
II-ENZYME INHIBITORS
2012
K
INETICS OF
E
NZYME
-C
ATALYZED
R
EACTIONS

2
|
P a g e
REGULATION OF ENZYMES BY SUBSTRATE AND
PRODUCT CONCENTRATION
The velocity of all enzymes is dependent on the concentration of
substrate.
The hypothesis of enzyme kinetics assumes the rapid, reversible
formation of a complex between an enzyme and its substrate (the
substance upon which it acts to form a product).
It also assumes that the rate of formation of the product, P, is
proportional to the concentration of the complex.
The velocity of such a reaction is greatest when all the sites at
which catalytic activity can take place on the enzyme molecules (active
sites) are filled with substrate; i.e., when the substrate concentration
is very high.
k
1
k
2
E + S
ES
E + P
k
-1
E= enzyme,
S= substrate,
ES= enzyme-substrate complex, P= product
k
1
, k
-1
and k
2
are rate constants
3
|
P a g e
The Michaelis-Menton equation describes how reaction velocity varies
with substrate concentration:
V
max
[S]
v
0
=
K
m
+[S]
V
max
=maximum velocity, v
0
= initial velocity, K
m
= (k
-1
+ k
2
)/k
1
To determine the maximum speed of an enzymatic reaction, the
substrate concentration is increased until a constant rate of product
formation is achieved. This is the maximum velocity (V
max
) of the
enzyme. In this state, all enzyme active sites are saturated with
substrate.
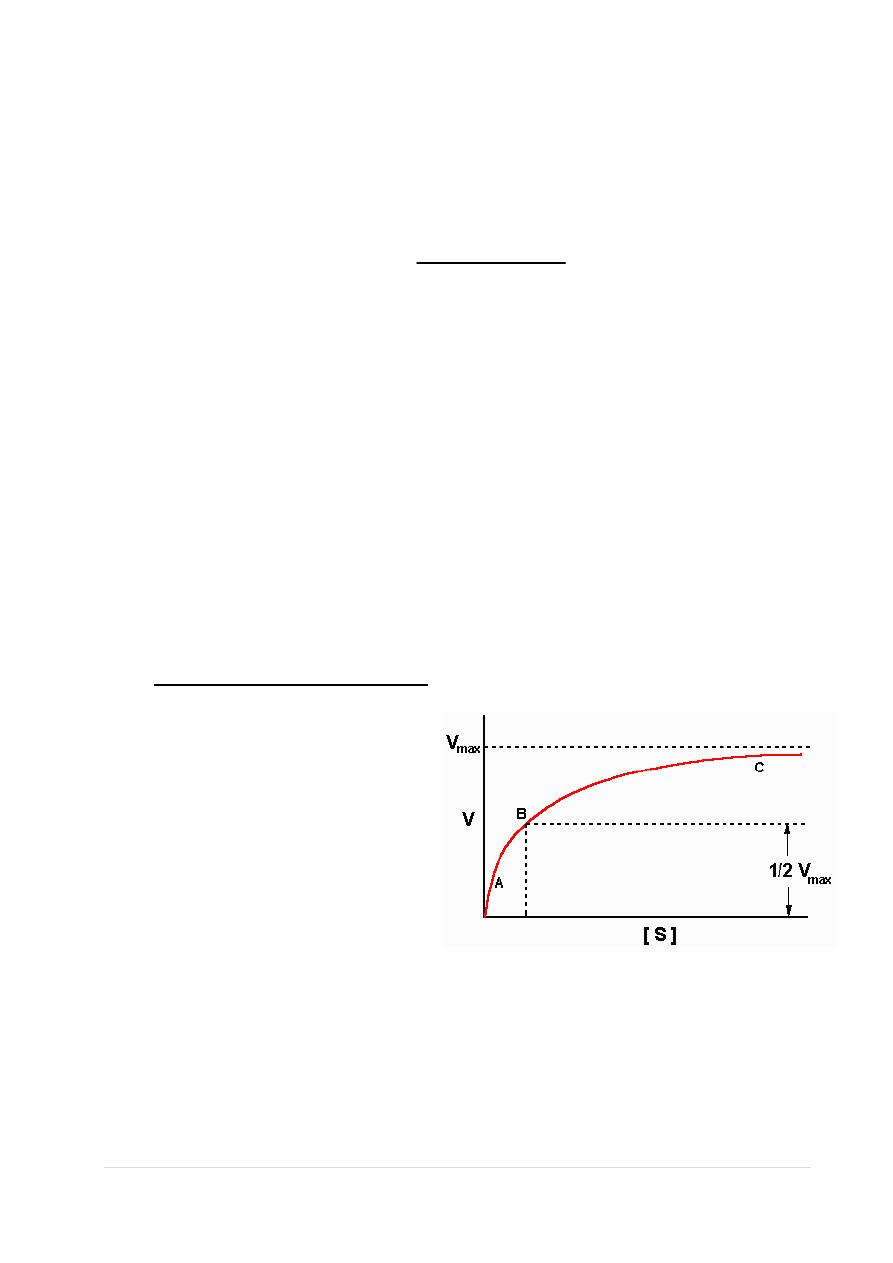
The Michaelis-Menten constant (K
m
)= B, is the substrate
concentration required for an
enzyme to reach one half its
maximum velocity. Each
enzyme has a characteristic K
m
for a given substrate.
The key features of the plot are marked by points A, B and C. At high
substrate concentrations the rate represented by point C the rate of
the reaction is almost equal to V
max
, and the difference in rate at
nearby concentrations of substrate is almost negligible.

4
|
P a g e
If the Michaelis-Menten plot is extrapolated to infinitely high
substrate concentrations, the extrapolated rate is equal to V
max
. When
the reaction rate becomes independent of substrate concentration, or
nearly so, the rate is said to be zero order. (Note that the reaction is
zero order only with respect to this substrate. If the reaction has two
substrates, it may or may not be zero order with respect to the second
substrate). At lower substrate concentrations, such as at points A and
B, the lower reaction velocities indicate that at any moment only a
portion of the enzyme molecules are bound to the substrate. In fact,
at the substrate concentration denoted by point B, exactly half the
enzyme molecules are in an ES complex at any instant and the rate is
exactly one half of V
max
.
5
|
P a g e
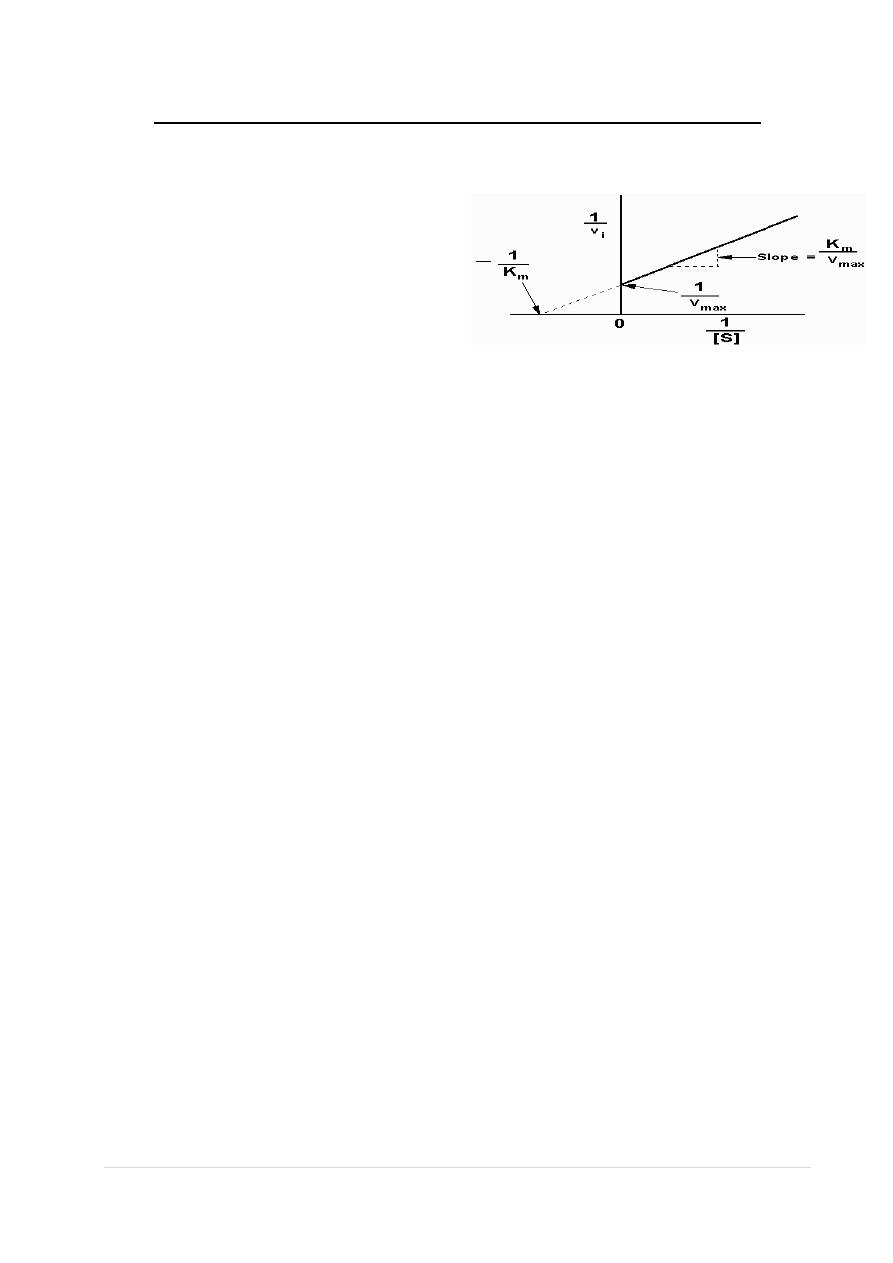
Inhibition of Enzyme Catalyzed Reactions
To avoid dealing with curvilinear plots of enzyme catalyzed reactions,
biochemists Lineweaver and Burk
introduced an analysis of enzyme
kinetics based on the following
rearrangement of the Michaelis-
Menten equation:
A Lineweaver-Burk Plot
[1/v] = [K
m
(1)/ V
max
[S] + (1)/V
max
]
Plots of 1/v versus 1/[S] yield straight lines having a slope of K
m
/V
max
and an intercept on the ordinate at 1/V
max
.
The Lineweaver-Burk transformation of the Michaelis-Menton equation
is useful in the analysis of enzyme inhibition. Since most clinical drug
therapy is based on inhibiting the activity of enzymes, analysis of
enzyme reactions using the tools described above has been
fundamental to the modern design of pharmaceuticals.
Many Drugs Acts As Enzyme Inhibitors
o
Many drugs, including antibiotics and antiviral agents, operate by
inhibiting critical enzyme-catalyzed reactions or serve as
alternative dead-end substrates of such reactions.
o
The antibiotic activity of penicillin is due to its ability to inhibit
transpeptidases responsible for crosslink formation in construction
of bacterial cell walls, leading to lysis of the weakened cells.

6
|
P a g e
o
Sulfanilamides (sulfa drugs) are antibiotics that serve as
structural analogs of para-aminobenzoic acid (PABA), a
substrate in the formation of folic acid by many bacteria.
Substitution of the sulfanilamide compound in place of PABA in the
reaction prevents formation of the critical coenzyme folic acid.
o
Inhibitors of the HIV protease are useful in antiviral therapy
strategies because this enzyme is absolutely required for processing
of proteins needed for synthesis of the viral coat.
o
the use of methotrexate in cancer chemotherapy to semi-
selectively inhibit DNA synthesis of malignant cells,
o
the use of aspirin to inhibit the synthesis of prostaglandins
which are at least partly responsible for the aches and pains of
arthritis.
Examples of irreversible (suicidal) inhibitors
Organophosphorous Pesticides: Suicide Inhibitors of Acetylcholinesterase
Organophosphates form stable phosphoesters with the active site
serine of acetylcholinesterase, the enzyme responsible for hydrolysis
and inactivation of acetylcholine at cholinergic synapses.
Irreversible inhibition of the enzyme leads to accumulation of
acetylcholine at these synapses and consequent neurologic impairment.
Poisoning by pesticides that contain organophosphate compounds
produces a variety of symptoms, including nausea, blurred vision,
fatigue, muscle weakness and, potentially, death caused by paralysis of
respiratory muscles.

7
|
P a g e
In addition, many poisons, such as cyanide, carbon monoxide and
polychlorinated biphenols (PCBs), produce their life- threatening
effects by means of enzyme inhibition.
Enzyme inhibitors fall into two broad classes:
1. Those causing
irreversible
inactivation of enzymes: Inhibitors of
the first class usually cause an inactivating, covalent modification
of enzyme structure . Cyanide is a classic example of an
irreversible enzyme inhibitor: by covalently binding mitochondrial
cytochrome oxidase, it inhibits all the reactions associated with
electron transport. The kinetic effect of irreversible inhibitors
is to decrease the concentration of active enzyme, thus
decreasing the maximum possible concentration of ES complex.
Since the limiting enzyme reaction rate is often k
2
[ES], it is clear
that under these circumstances the reduction of enzyme
concentration will lead to decreased reaction rates. Irreversible
inhibitors are usually considered to be poisons and are generally
unsuitable for therapeutic purposes.
2. Those whose inhibitory effects can be
reversed
. Reversible
inhibitors can be divided into two main categories; competitive
inhibitors and noncompetitive inhibitors, with other three
categories, , rarely encountered, partially completive inhibitors
uncompetitive inhibitors and mixed inhibitors.

8
|
P a g e
Inhibitor Type
Binding Site on Enzyme
Kinetic effect
Competitive Inhibitor
Specifically at the catalytic site,
where it competes with substrate
for binding in a dynamic
equilibrium- like process. Inhibition
is reversible by substrate.
V
max
is unchanged; K
m
, as
defined by [S] required
for 1/2 maximal
activity, is increased.
Noncompetitive
Inhibitor
Binds E or ES complex other than
at the catalytic site. Substrate
binding unaltered, but ESI complex
cannot form products. Inhibition
cannot be reversed by substrate.
K
m
appears unaltered;
V
max
is decreased
proportionately to
inhibitor concentration.
Partially competitive
Inhibitor
similar to that of non-competitive,
except that the EIS-complex has
catalytic activity, which may be
lower or even higher (partially
competitive activation) than that
of the enzyme-substrate (ES)
complex
.
lower V
max
, but an
unaffected K
m
value
Uncompetitive Inhibitor
Binds only to ES complexes at
locations other than the catalytic
site. Substrate binding modifies
enzyme structure, making
inhibitor- binding site available.
Inhibition cannot be reversed by
substrate.
Apparent V
max
decreased; K
m
, as
defined by [S] required
for 1/2 maximal
activity, is decreased.
Mixed inhibition
Inhibitor bind to both the enzyme
and the ES complex. It has the
properties of both competitive and
uncompetitive inhibition.
Both a decrease in V
max
and an increase in the
K
m
value are seen in
mixed inhibition.

9
|
P a g e
The feature of all the reversible inhibitors is that when the inhibitor
concentration drops, enzyme activity is regenerated. Usually these
inhibitors bind to enzymes by non-covalent forces and the inhibitor
maintains a reversible equilibrium with the enzyme. The equilibrium
constant for the dissociation of enzyme inhibitor complexes is known
as K
I
:
K
I
= [E][I]/[E--I--complex]
The effects of K
I
are best observed in Lineweaver-Burk plots.
Probably the best known reversible inhibitors are competitive
inhibitors, which always bind at the catalytic or active site of the
enzyme. Most drugs that alter enzyme activity are of this type.
Competitive inhibitors are especially attractive as clinical modulators
of enzyme activity because they offer two routes for the reversal of
enzyme inhibition:
1. First, as with all kinds of reversible inhibitors, a decreasing
concentration of the inhibitor reverses the equilibrium
regenerating active free enzyme.
2. Second, since substrate and competitive inhibitors both bind at
the same site they compete with one another for binding. Raising
the concentration of substrate (S), while holding the
concentration of inhibitor constant, provides the second route
for reversal of competitive inhibition. The greater the proportion
of substrate, the greater the proportion of enzyme present in
competent ES complexes.
10
|
P a g e
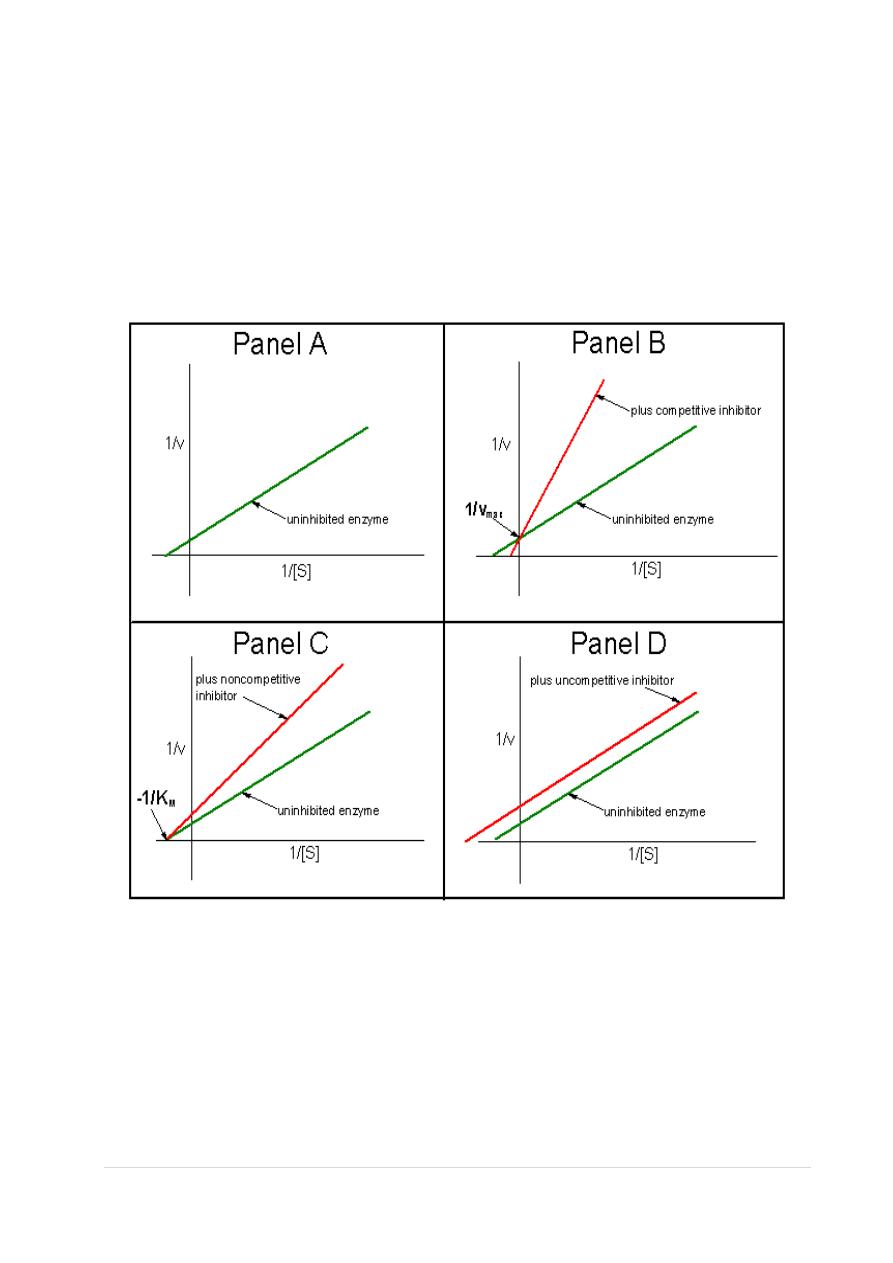
High concentrations of substrate can displace virtually all competitive
inhibitor bound to active sites. Thus, it is apparent that V
max
should be
unchanged by competitive inhibitors. This characteristic of competitive
inhibitors is reflected in the identical vertical-axis intercepts of
Lineweaver-Burk plots, with and without inhibitor. panel B.
Lineweaver-Burk Plots of Inhibited Enzymes
Analogously, panel C illustrates that noncompetitive inhibitors appear
to have no effect on the intercept at the x-axis implying that
noncompetitive inhibitors have no effect on the K
m
of the enzymes
they inhibit.

11
|
P a g e
Since noncompetitive inhibitors do not interfere in the equilibration of
enzyme, substrate and ES complexes, the K
m
's of Michaelis-Menten
type enzymes are not expected to be affected by noncompetitive
inhibitors, as demonstrated by x-axis intercepts in panel C. However,
because complexes that contain inhibitor (ESI) are incapable of
progressing to reaction products, the effect of a noncompetitive
inhibitor is to reduce the concentration of ES complexes that can
advance to product. Since V
max
= k
2
[E
total
], and the concentration of
competent E
total
is diminished by the amount of ESI formed,
noncompetitive inhibitors are expected to decrease V
max
, as illustrated
by the y-axis intercepts in panel C.
A corresponding analysis of uncompetitive inhibition leads to the
expectation that these inhibitors should change the apparent values of
K
m
as well as V
max
. Changing both constants leads to double reciprocal
plots, in which intercepts on the x and y axes are proportionately
changed; this leads to the production of parallel lines in inhibited and
uninhibited reactions.

12
|
P a g e
Clinical Problems
A Polish man and his friend who is of Japanese descent are sharing
conversation over drinks at a party. After the Polish man finishes his
second bottle of beer, he notices that his friend, despite having drunk
only half his drink, appears flushed in the face. His friend then
complains of dizziness and headache and asks to be driven home.
1. The marked difference in tolerance to alcohol illustrated by these
men is most likely due to a gene encoding which of the following
enzymes?
A. Alcohol dehydrogenase
B. Acetate dehydrogenase
C. Alcohol reductase
D. Aldehyde dehydrogenas
E. Aldehyde aminotransferase
Comment: The answer is D. Many Asians lack a low-K
m
, form of
acetaldehyde dehydrogenase, which is responsible for detoxifying
acetaldehyde generated by oxidation of ethanol in the liver.
Acetaldehyde accumulation in the blood of such individuals leads to
the facial flushing and neurologic effects exhibited by the man of
Japanese descent.

13
|
P a g e
An alcoholic has consumed antifreeze as a substitute for ethanol.
Ethyleneglycol, an ingredient in antifreeze, is also a substrate for the
enzyme alcohol dehydrogenase (ADH), which normally converts ethanol
to acetaldehyde. Ethylene glycol, however, is converted by ADH to a
highly toxic product. Ethanol is administered as a treatment in this
case of poisoning.
2. Why is ethanol an effective treatment for ethylene glycol
poisoning?
A. ADH exhibits a much higher affinity (K
m
for ethanol than
for ethylene glycol
B. Ethanol is an allosteric effector of ADH
C. Ethanol combines with the toxic product formed by the
reaction of ADH with ethylene glycol and renders it harmless
D. Acetaldehyde is of therapeutic value.
E. Ethanol induces another enzyme that is capable of
metabolizing ethylene glycol
Comment: The answer is: 1-A: Aldehyde dehydrogenase (ADH),
which exhibits a broad substrate specificity for alcohols, has a
much higher affinity for ethanol [i.e., a lower Km] than for
ethylene glycol. Saturating ADH with ethanol by administration of
therapeutic levels prevents it from converting ethylene glycol to
the toxic aldehyde, and allows ethylene glycol to eventually be
excreted unmetabolized.

14
|
P a g e
Ethylene Glycol is a competitive inhibitor of alcohol dehydrogenase
(ADH) activity. Ethylene glycol is converted by ADH, to oxalic acid,
calcium oxalate crystals in kidney.
In Non-Asians, ethanol is administered as antidote to ethylene
glycol ingestion
In Asians, ethanol administration is not efficacious due to low,
non-inducible ADH activity.
Interesting story in Japanese press several years ago Drunk Japanese
businessman was spared from death due to ethylene glycol poisoning
siphoning antifreeze from a friend's car habitual alcohol user, had
higher steady-state ADH levels.

15
|
P a g e
3.
If one compares Lineweaver-Burk plots for the reactions of ADH
with ethanol and ethylene glycol, which of the following would be
observed?
A. They exhibit identical slopes.
B. They exhibit identical y-intercepts.
C. They exhibit identical x-intercepts.
D. Only the plot for the reaction of ethanol is linear
E. Only the plot for the reaction of ethylene glycol is linear
Comment: The answer is 2-B: If ADH obeys Michaelis-Menten
kinetics, then the Lineweaver-Burk plot, which is a linear
transform of the Michaelis-Menten equation, will be linear for both
substrates. ADH exhibits different Km values for ethanol and
ethylene glycol. Therefore, the x-intercept (1/ K
m
and the slope
(K
m
/V
max
) are different. If only the affinity for the alternative
substrate is different, then the V
max
will be the same as will the
y-intercept (1/V
max
).

16
|
P a g e
4.
Blood was taken from this patient and analyzed for the serum levels
of certain enzymes. Which one of the following enzymes will most
likely be present at elevated levels?
(A) Amylase
(B) Creatine kinase
(C) Alanine aminotransferase
(D) Acid phosphatase
(E) Lactate dehydrogenase
Comment: he answer is 3-C :Chronic alcoholics are likely to exhibit
signs of liver damage. Alanine aminotransferase is present in the
cytosol of liver cells, and its release into the serum is diagnostic of
hepatocellular damage. Lactate dehydrogenase and creatine kinase
isozymes are analyzed to diagnose heart attacks. Amylase levels
are elevated in patients with acute pancreatitis, and elevated acid
phosphatase levels may be diagnostic of prostate cancer.

17
|
P a g e
5.
A noncompetitive enzyme inhibitor
A. Decreases
V
max
and increases
K
m
.
B. Decreases V
max
and has no effect on
K
m
.
C. Has no effect on
V
max
or
K
m
.
D. Has no effect on
V
m:K
and increases
K
m
.
E. Has no effect on
V
mxi
and decreases
K
m
.
Comment: The answer is B. A noncompetitive inhibitor binds to the
enzyme at a site other than the substrate binding site, so it has
little measurable effect on the enzyme's affinity for substrate, as
represented by the
K
m
.
However, the inhibitor has the effect of
decreasing the availability of active enzyme capable of catalyzing
the reaction, which manifests itself as a decrease in V
max
.

18
|
P a g e
6.
A 47-year-old man is evaluated for a 12-hour history of nausea,
vomiting and, more recent, difficulty breathing. His past medical history
is unremarkable, and he takes no medications. However, he is a farmer
who has had similar episodes in the past after working with agricultural
chemicals in his fields. Just yesterday he reports applying diazinon, an
organophosphate insecticide, to his sugar beet field.
After consultation with the poison center, you conclude that this
patient's condition is most likely due to inhibition of which of the
following enzymes?
A. Acetate dehydrogenase
B. Alanine aminotransferase
C. Streptokinase
D. Acetylcholinesterase
E. Creatine kinase
Comment: The answer is D. Organophosphates react with the
active site serine residue of hydrolases such as
acetylcholinesterase and form a stable phosphoester modification
of that serine that inactivates the enzyme toward substrate.
Inhibition of acetylcholinesterase causes overstimulation of the end
organs regulated by those nerves. The symptoms manifested by
this patient reflect such neurologic effects resulting from the
inhalation or skin absorption of the pesticide diazinon.

19
|
P a g e
7.
Accidental ingestion of ethylene glycol, an ingredient of automotive
antifreeze, is fairly common among children because of the liquid's
pleasant color and sweet taste. Ethylene glycol itself is not very
toxic, but it is metabolized by alcohol dehydrogenase to the toxic
compounds glycolic acid, glyoxylic acid, and oxalic acid, which can
produce acidosis and lead to renal failure and death. Treatment for
suspected ethylene glycol poisoning is hemodialysis to remove the
toxic metabolites and administration of a substance that reduces the
metabolism of ethylene glycol by displacing it from the enzyme
.
Which of the following compounds would be best suited for this
therapy?
A. Acetic acid
B. Ethanol
C. Aspirin
D. Acetaldehyde
E. Glucose
Comment: The answer is B. The therapeutic rationale for ethylene
glycol poisoning is to compete for the attention of alcohol
dehydrogenase by providing a preferred substrate, ethanol, so that
the enzyme is unavailable to catalyze oxidation of ethylene glycol
to toxic metabolites. Ethanol will displace ethylene glycol by mass
action for a limited time, during which hemodialysis is used to
remove ethylene glycol and its toxic metabolites from the patient's
bloodstream.

20
|
P a g e
8.
Glucose taken up by liver cells is rapidly phosphorylated to glucose 6-
phosphate with ATP serving as the phosphate donor in the initial
step of metabolism and assimilation of the sugar. Two enzymes,
which may be considered isozymes, are capable of catalyzing this re-
action in the liver cell. Hexokinase has a low K
m
of -0.05 mM for
glucose, whereas glucokinase exhibits sigmoidal kinetics with an
approximate K
m
of ~5 mM. After a large meal, the glucose
concentration in the hepatic portal vein may approximate 5 mM.
After such a large meal, which of the following scenarios describes the
relative activity levels for these two enzymes?
Hexokinase
Glucokinase
A. Not active
Not active
B.
v
½V
max
Not active
C.
v
V
max
Not active
D.
v
V
max
v
½V
max
E.
v
V
max
v
V
max
Comment: The answer is D. This problem provides a practical
illustration of the use of the Michaelis-Menten equation. The high
concentration of glucose in the hepatic portal vein after a meal
would promote a high rate of glucose uptake into liver cells,
necessitating rapid phosphorylation of the sugar. The glucose
concentration far exceeds the
K
m
of hexokinase, ie, [S] >
K
m
,
meaning that the enzyme will be nearly saturated with substrate
and
v
V
max
. However, the [S] =
K
m
for glucokinase, which will be
active in catalyzing the phosphorylation reaction and
v
½V
max
