Prof. Dr. Hedef D. El-Yasin 2014
1
Hormones of the
adrenal gland
[Prof. Dr. H.D.El-Yassin 2013
1.
Hormones of the adrenal cortex
Prof. Dr. Hedef D. El-Yasin 2014
2
Lecture 7
Sunday 23/3/2014
Hormones of the adrenal gland
Objectives:
1. Describe the structure and function of the adrenal cortex
2. List the hormones synthesized by each specific zone of the adrenal cortex and state
their functions
3. Describe the following adrenal disorders:
a. Addison's disease
b. Conn's syndrome
c. Cushing syndrome
d. Congenital adrenal hyperplasia
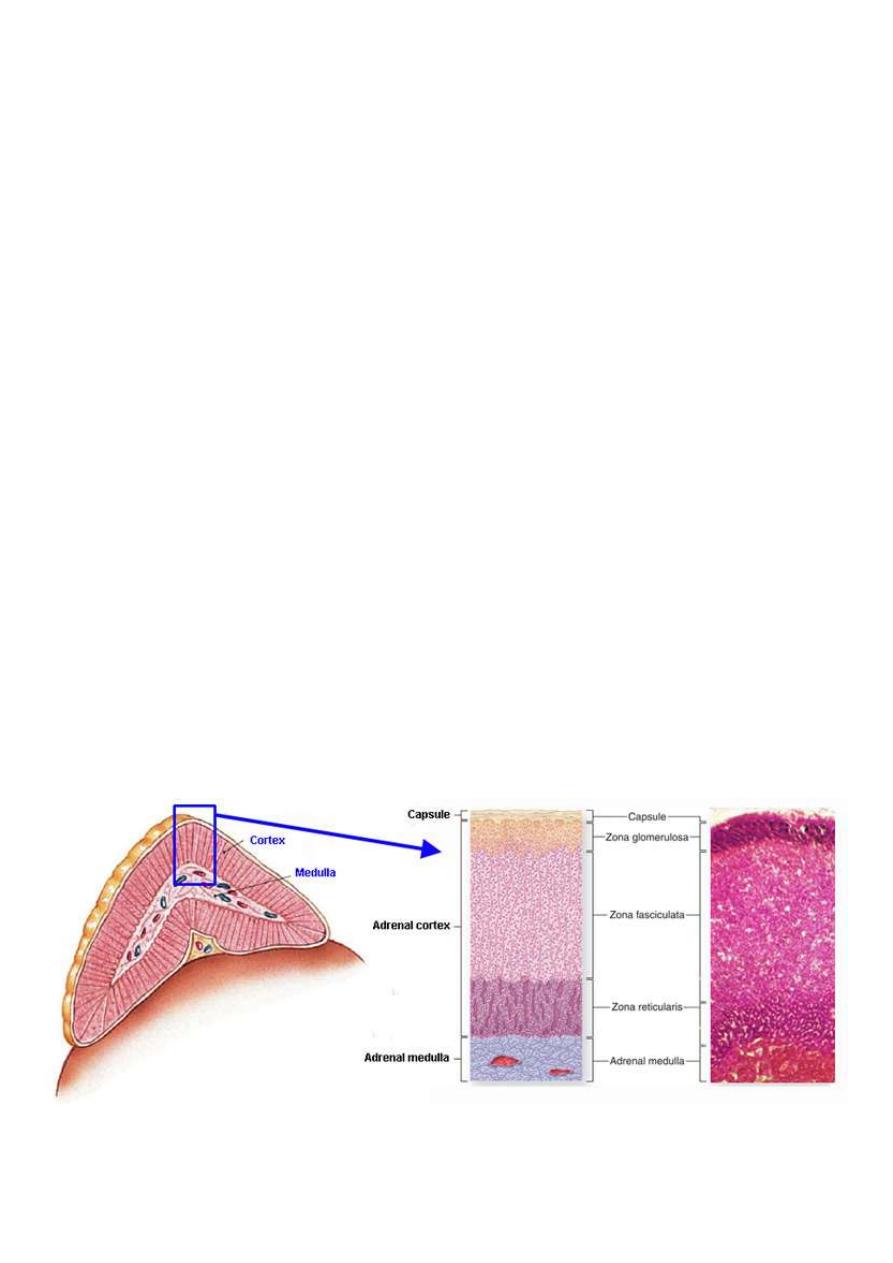
The structure of the adrenal gland
The two adrenal glands (also called the suprarenal glands) are situated in the abdomen,
on either side of the vertebral column, above the kidneys and below the diaphragm
.
When cut in half each gland consists of
1.
An outer cortex, yellow in color and
2.
An inner medulla, which is dark red, or grey
.
Prof. Dr. Hedef D. El-Yasin 2014
3
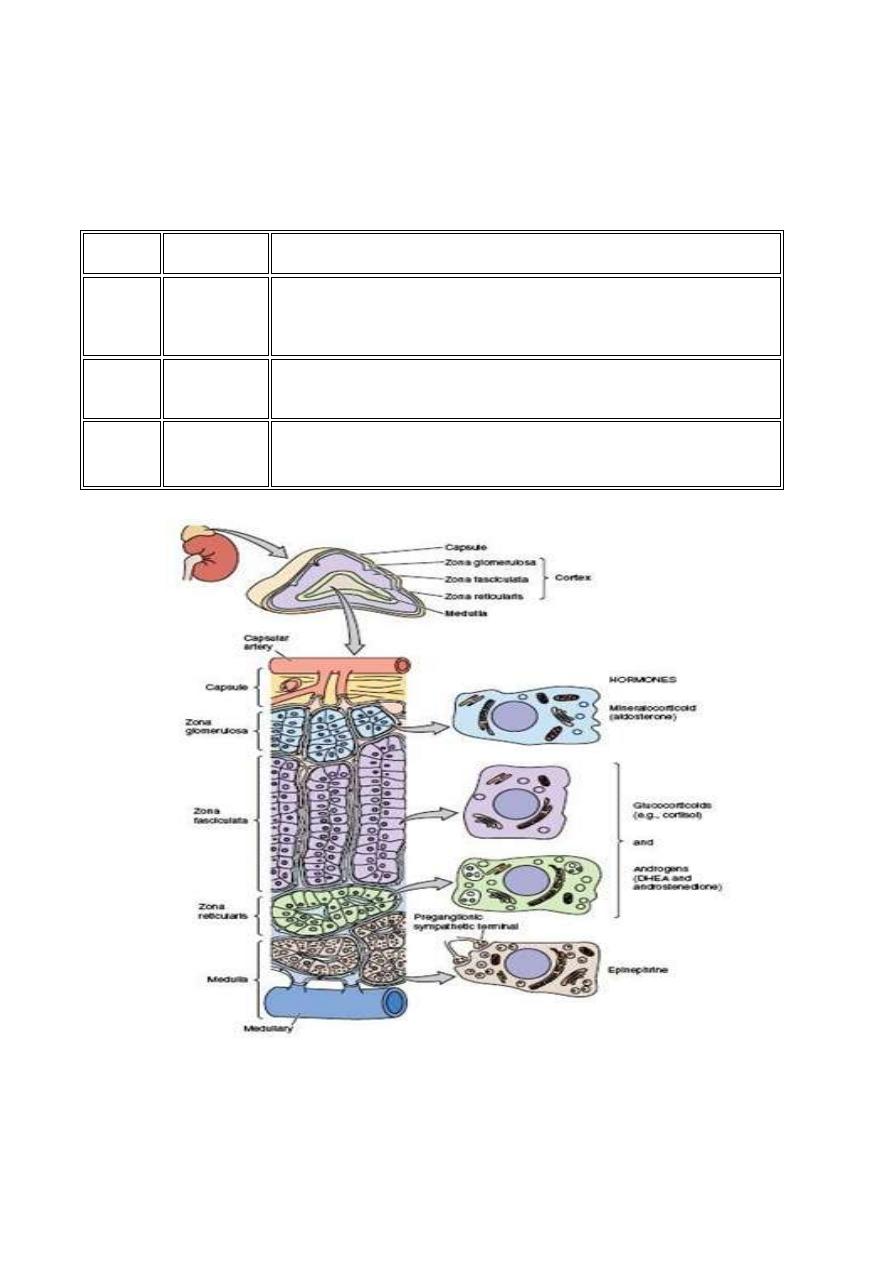
The cortex consists of three distinct zones
1.
Zona glomerulosa
2.
Zona fasciculata
3.
Zona reticularis
Each zone has a characteristic histology and secretes different types of hormones
The medulla consists of many large columnar cells called "chromaffin cells". These
synthesize and secrete catecholamines
when stimulated by the sympathetic nervous
system.
Layer
Name
Primary product
Most
superficial
cortical
layer
Zona
glomerulosa
mineralocorticoid (aldosterone) which is responsible for the
regulation of salt and water balance in the body
Middle
cortical
layer
Zona
fasciculata
glucocorticoid (cortisol) which regulates the level of
carbohydrate in the body
Deepest
cortical
layer
Zona
reticularis
sex hormones (progesterone, oestrogen precursors and
androgens) which have a role in the development of sexual
characteristics
Prof. Dr. Hedef D. El-Yasin 2014
4
Hormone synthesis
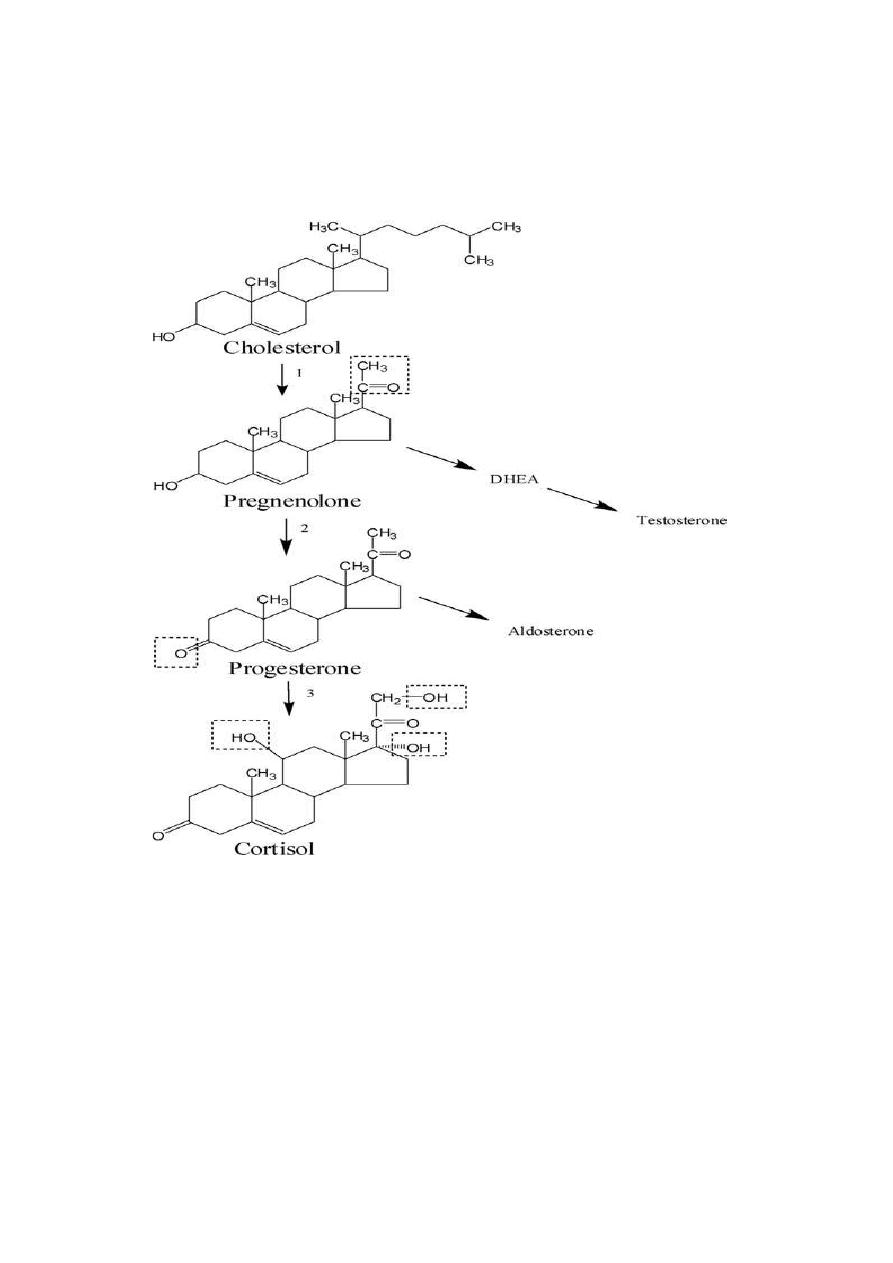
All adrenocortical hormones are synthesized from cholesterol. Cholesterol is transported
into the adrenal gland. Subsequent steps to generate aldosterone and cortisol, primarily
occur in the adrenal cortex:
Cholesterol is converted to pregnenolone, which is the precursor of all the other steroids
and stands at the first branch point in the adrenal steroidogenic network
Steroidogenic defects can cause congenital adrenal hyperplasia (CAH). This condition
may cause symptoms ranging from mild acne to salt wasting, depending on the nature of
the genetic mutation.
Quick quiz:
Which of the following is responsible for the biosynthesis of steroid hormones?
1. 7-dehydrocholesterol
2. 7-hydroxycholesterol
3. cholesterol
4. calciferol

Prof. Dr. Hedef D. El-Yasin 2014
5
CAH Due to 21-Hydroxylase Deficiency
Greater than 90% of the cases of CAH are the result of deficiency in the enzyme steroid
21-hydroxylase. Absolute or partial deficiency in this enzyme leads to two problems:
1. Deficiency in production of cortisol and aldosterone: Aldosterone is necessary for
normal retention of sodium by the kidney, and in its absense, a "salt wasting"
disorder occurs.
2. Shunting of steroid precursors to form androgens: In the absence of 21-
hydroxylase, concentrations of 17-hydroxyprogesterone increase substantially and
is converted to androgens including testosterone and dihydrotestosterone. The
resulting secretion of relative large quantities of androgens early in life leads to
virilization of female fetuses and abnormal development in male children

Prof. Dr. Hedef D. El-Yasin 2014
6
Hypoadrenocorticism (Addison's disease)results from idiopathic atrophy of the adrenal
cortex induced by autoimmune responses that will lead to decreased production of cortisol
and, in some cases, also results in decreased production of aldosterone.
If aldosterone levels are insufficient characteristic electrolyte abnormalities are evident
owing to increased excretion of Na+ and decreased excretion of K+ chiefly in urine but
also in sweat, saliva, and the GI tract. This condition leads to isotonic urine and decreased
blood levels of Na+ and Cl− with increased levels of K+. Left untreated, aldosterone
insufficiency produces severe dehydration, plasma hypertonicity, acidosis, decreased
circulatory volume, hypotension, and circulatory collapse.
Cortisol deficiency impacts carbohydrate, fat, and protein metabolism and produces
severe insulin sensitivity. Gluconeogenesis and liver glycogen formation are impaired, and
hypoglycemia results. As a consequence, hypotension, muscle weakness, fatigue,
vulnerability to infection, and stress are early symptoms. A characteristic
hyperpigmentation on both exposed and unexposed parts of the body is evident.
Hormones secreted by the Adrenal Cortex
1. Mineralocorticoids
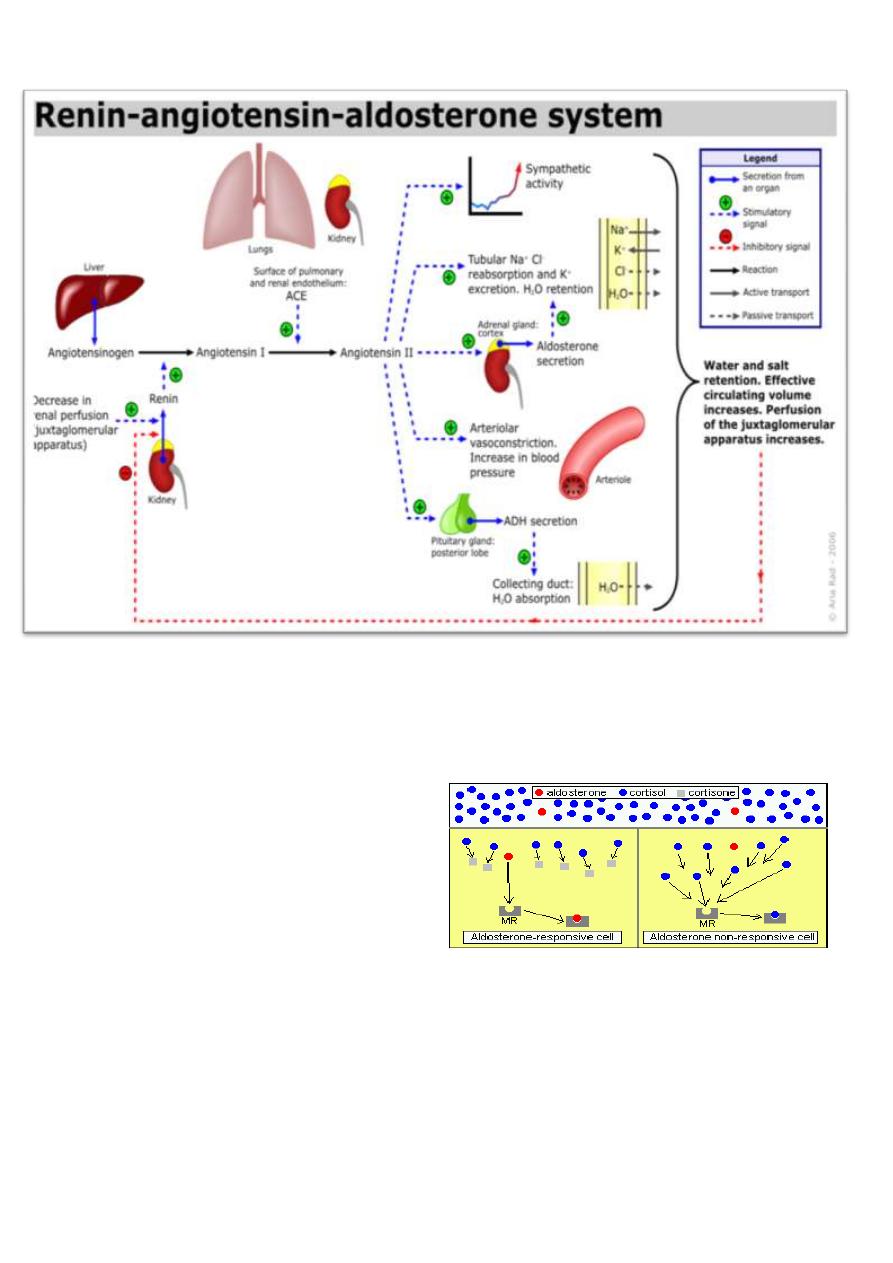
The primary mineralocorticoids aldosterone is aldosterone. Its secretion is regulated by the
oligopeptide angiotensin II (angiotensin II is regulated by angiotensin I, which in turn is
regulated by renin). Aldosterone is secreted in response to high extracellular potassium
levels, low extracellular sodium levels, and low fluid levels and blood volume. Aldosterone
affects metabolism in different ways:
a. It increases urinary excretion of potassium ions
b. It increases interstitial levels of sodium ions
c. It increases water retention and blood volume
Removal of the adrenal glands leads to death within just a few days. Due to:
1.
the concentration of potassium in extracelluar fluid becomes
dramatically elevated
2.
urinary excretion of sodium is high and the concentration of
sodium in extracellular fluid decreases significantly
3.
volume of extracellular fluid and blood decrease
4.
the heart begins to function poorly, cardiac output declines
and shock ensues
Clearly mineralocorticoids are acutely critical for maintenance of life!
Prof. Dr. Hedef D. El-Yasin 2014
7
Quick quiz
which of the following is negative statement for the actions of aldosterone
1.
most potent and active mineralocorticoid
2.
it retains Na+ and excretes K+
3.
acts at loop of Henle of the kidney
4.
it excretes H+ and NH
4
+ ions
Aldosterone and Mineralocorticoid
Receptors
Cortisol, have "weak mineralocorticoid
activity", which is of some importance
because cortisol is secreted very much
more abundantly than aldosterone. i.e. a
small fraction of the mineralocorticoid response in the body is due to cortisol rather than
aldosterone.
The mineralocorticoid receptor binds both aldosterone and cortisol with equal affinity.
Moreover, the same DNA sequence serves as a
activated (steroid-bound) forms of both mineralocorticoid and glucocorticoid receptors.

Prof. Dr. Hedef D. El-Yasin 2014
8
Q:
How can aldosterone stimulate specific biological effects in this kind of
system, particularly when blood concentrations of cortisol are something like 2000-
fold higher than aldosterone?
A:
In aldosterone-responsive cells, cortisol is effectively destroyed, allowing
aldosterone to bind its receptor without competition. Target cells for aldosterone express
the enzyme 11-beta-hydroxysteroid dehydrogenase, which has no effect on aldosterone,
but converts cortisol to cortisone, which has only a very weak affinity for the
mineralocorticoid receptor. In essence, this enzyme "protects" the cell from cortisol and
allows aldosterone to act appropriately.
Control of Aldosterone Secretion
The two most significant regulators of aldosterone secretion are:
Concentration of potassium ions in extracellular fluid: Small increases in blood
levels of potassium strongly stimulate aldosterone secretion.
Angiotensin II: Activation of the renin-angiotensin system as a result of decreased
renal blood flow (usually due to decreased vascular volume) results in release of
angiotensin II, which stimulates aldosterone secretion.
Factors which suppress aldosterone secretion include atrial naturetic hormone, high
sodium concentration and potassium deficiency.
Disease States: (refer to the clinical cases supplement)
1. A deficiency in aldosterone can occur by itself or, more commonly, in conjunction
with a glucocorticoid deficiency, and is known as hypoadrenocorticism or Addison's
disease
2. Primary aldosteronism (Conn's syndrome) is caused by the overproduction of
aldosterone
2. Glucocorticoids
Cortisol and Glucocorticoid Receptors
Cortisol binds to the glucocorticoid receptor in the
cytoplasm and the hormone-receptor complex is then
translocated into the nucleus, where it binds to its DNA
response element and modulates transcription from a
battery of genes, leading to changes in the cell's
phenotype.
Prof. Dr. Hedef D. El-Yasin 2014
9
Only about 10% of circulating cortisol is free. The remaining majority circulates bound to
plasma proteins, particularly corticosteroid-binding globulin (transcortin).
Quick quiz:
glucocorticoids are transported in blood by:
1. Albumin
2. Transcortin
3. Free form
4. All the above
Metaboilc Effects of Glucocorticoids
There seem to be no cells that lack glucocorticoid receptors and as a consequence, these
steroid hormones have a huge number of effects on physiologic systems.
The name glucocorticoid derives from early observations that these hormones were
involved in glucose metabolism.
Cortisol stimulates several processes that collectively serve to increase and maintain
normal concentrations of glucose in blood. These effects include:
Stimulation of gluconeogenesis, particularly in the liver: This pathway results in
the synthesis of glucose from non-hexose substrates such as amino acids and
lipids . Enhancing the expression of enzymes involved in gluconeogenesis is
probably the best known metabolic function of glucocorticoids.
Mobilization of amino acids from extrahepatic tissues: These serve as
substrates for gluconeogenesis.
Inhibition of glucose uptake in muscle and adipose tissue: A mechanism to
conserve glucose.
Stimulation of fat breakdown in adipose
tissue: The fatty acids released by lipolysis
are used for production of energy in tissues
like muscle, and the released glycerol provide
another substrate for gluconeogenesis.
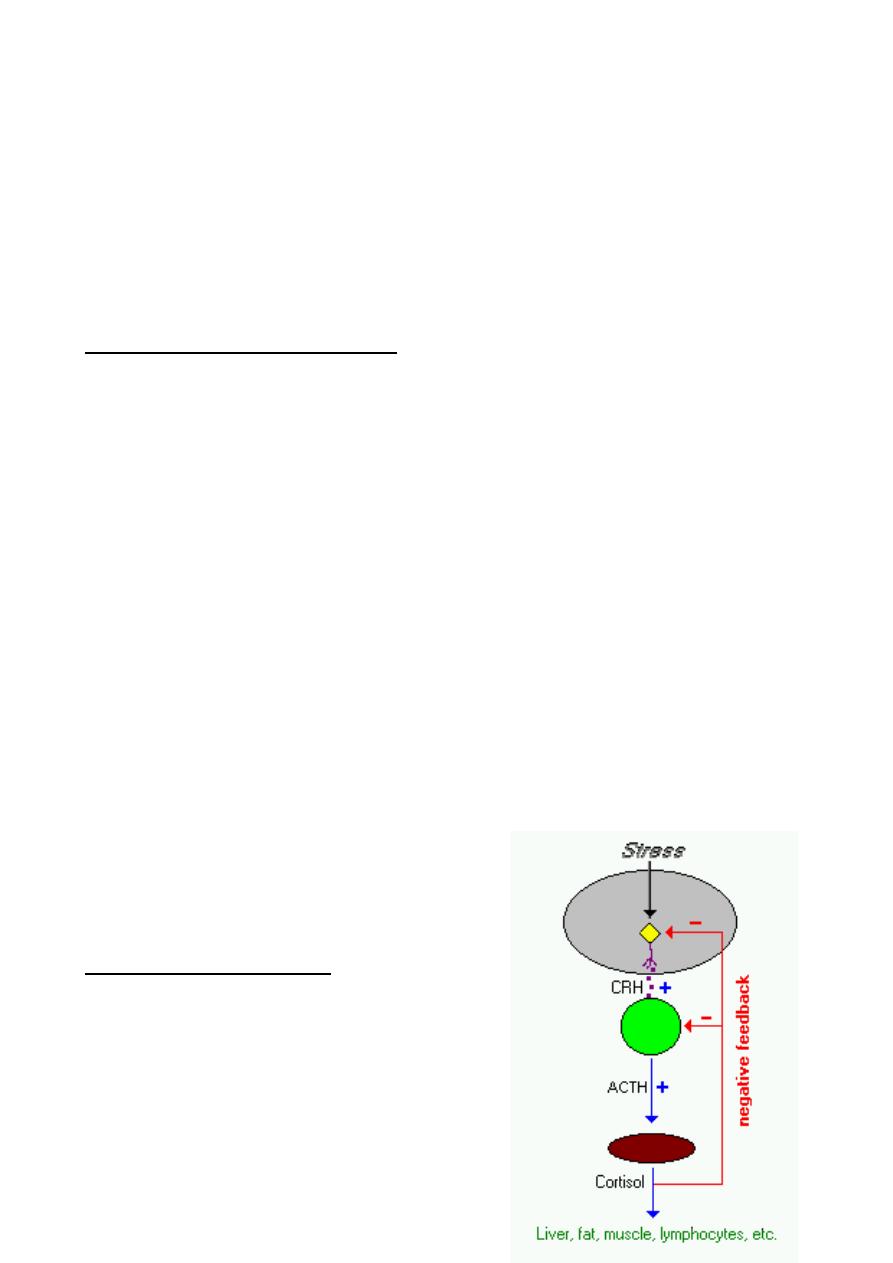
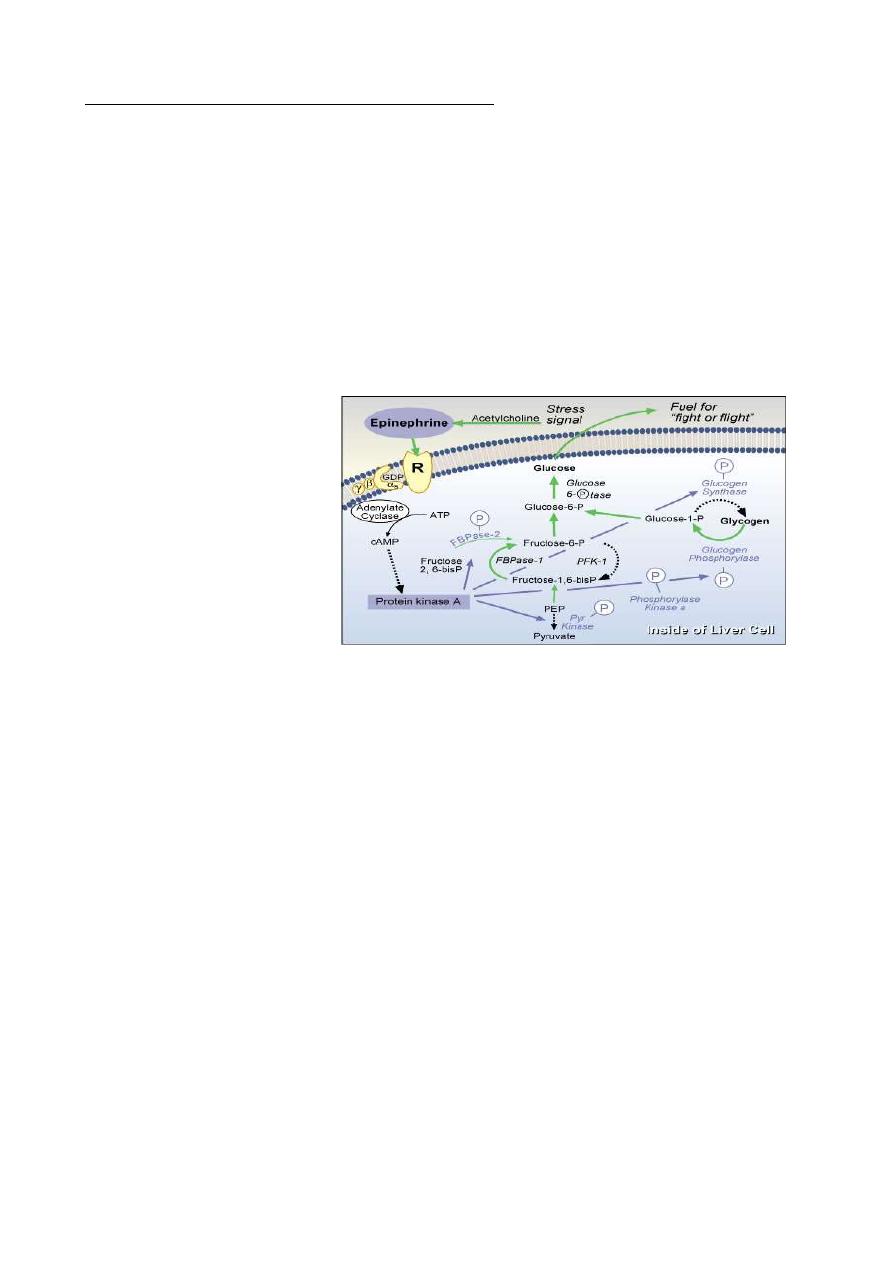
Control of Cortisol Secretion
Cortisol and other glucocorticoids are secreted
in response to a single stimulator:
adrenocorticotropic hormone (ACTH) from the
anterior pituitary. ACTH is itself secreted under
control of the hypothalamic peptide corticotropin-
releasing hormone (CRH).

Prof. Dr. Hedef D. El-Yasin 2014
10
Virtually any type of physical or mental stress results in elevation of cortisol
concentrations in blood due to enhanced secretion of CRH in the hypothalamus. This
fact sometimes makes it very difficult to assess glucocorticoid levels, especially being
restrained for blood sampling, is enough stress to artificially elevate cortisol levels several
fold!
Cortisol secretion is suppressed by classical negative feedback loops. When blood
concentrations rise above a certain threshold, cortisol inhibits CRH secretion from the
hypothalamus, which turns off ACTH secretion, which leads to a turning off of cortisol
secretion from the adrenal. The combination of positive and negative control on CRH
secretion results in pulsatile secretion of cortisol. Typically, pulse amplitude and frequency
are highest in the morning and lowest at night.
, also known as corticotropin, binds to receptors in the plasma membrane of cells in
the adrenal. Hormone-receptor engagement activates adenyl cyclase, leading to elevated
intracellular levels of cyclic AMP which leads ultimately to activation of the enzyme
systems involved in biosynthesis of cortisol from cholesterol.
Disease States(refer to the clinical cases supplement)
1. Cushings disease or hyperadrenocorticism.
2. Insufficient production of cortisol, often accompanied by an aldosterone deficiency,
is called Addison's disease or hypoadrenocorticism.
3. Androgens
The most important androgens include:
1. Testosterone: a hormone with a wide variety of effects, ranging from enhancing
muscle mass and stimulation of cell growth to the development of the secondary
sex characteristics.
2. Dihydrotestosterone (DHT): a metabolite of testosterone, and a more potent
androgen than testosterone in that it binds more strongly to androgen receptors.
3. Androstenedione (Andro): an androgenic steroid produced by the testes, adrenal
cortex, and ovaries. While androstenediones are converted metabolically to
testosterone and other androgens, they are also the parent structure of estrone.
4. Dehydroepiandrosterone (DHEA): It is the primary precursor of natural estrogens.
DHEA is also called dehydroisoandrosterone or dehydroandrosterone.
Prof. Dr. Hedef D. El-Yasin 2014
11
[Hormones of the
Adrenal Gland]
[Prof.Dr.H.D.El-Yassin]
2. Hormones of the adrenal Medulla
Prof. Dr. Hedef D. El-Yasin 2014
12
Hormones secreted by the Adrenal Medulla
Objectives
1. List the hormones synthesized by the adrenal medulla and state their
functions and clinical significance
2. define phaeochromocytoma and the laboratory results obtained in the
assessment of the disease
Cells in the adrenal medulla synthesize and secrete epinephrine and norepinephrine.
Following release into blood, these hormones bind adrenergic receptors on target cells,
where they induce essentially the same effects as direct sympathetic nervous stimulation.
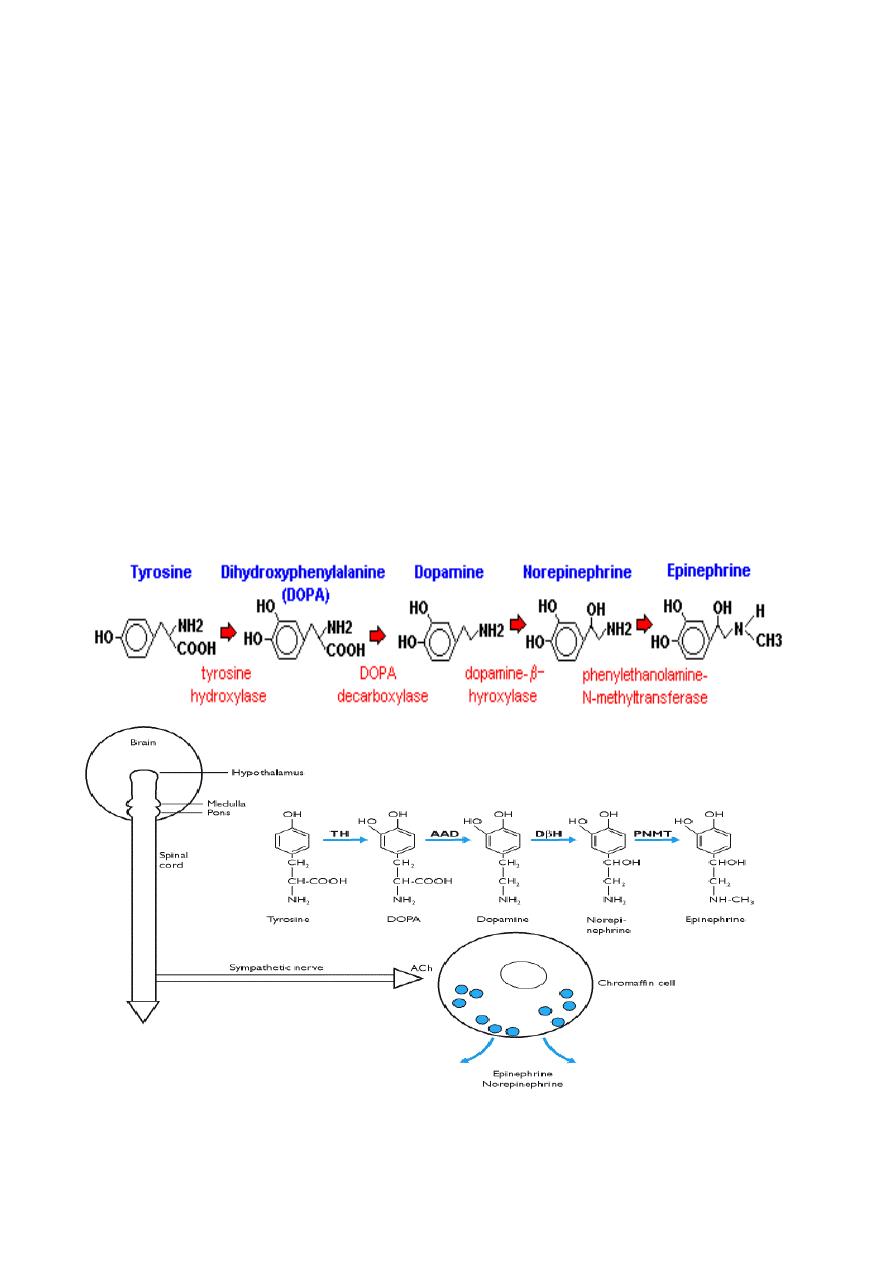
Synthesis Catecholamines
Synthesis of catecholamines begins with the amino acid tyrosine, which is taken up
by chromaffin cells in the medulla and converted to norepinephrine and epinephrine
through the following steps:
Norepinephine and epinephrine are stored in electron-dense granules which also contain
ATP and several neuropeptides. Secretion of these hormones is stimulated by
Prof. Dr. Hedef D. El-Yasin 2014
13
acetylcholine release. Many types of "stresses" stimulate such secretion, including
exercise, hypoglycemia and trauma. Following secretion into blood, the catecholamines
bind loosely to and are carried in the circulation (50%) by albumin and other serum
proteins. Once secreted their half life in the circulation is short (approximately 12 min) but
they have a large effect on heart, vessels, metabolism, brain, muscles etc. all as part of
stress responses.
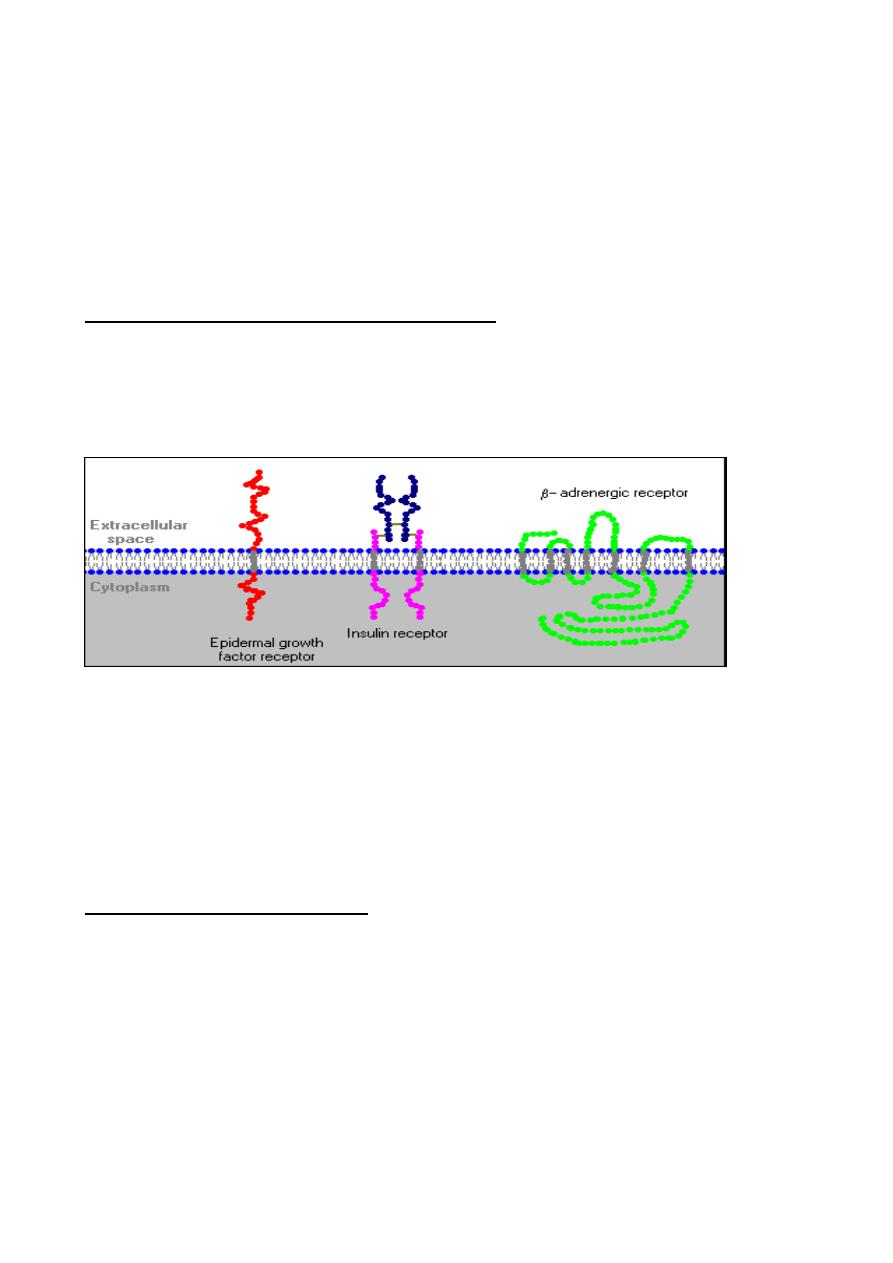
Adrenergic Receptors and Mechanism of Action
The physiologic effects of epinephrine and norepinephrine are initiated by their binding to
adrenergic receptors on the surface of target cells. These receptors are prototypical
examples of seven-pass transmembrane proteins that are coupled to G proteins which
stimulate or inhibit intracellular signaling pathways.
There are two major classes of adrenergic receptors these are:
1.
α adrenergic receptor (epinephrine and norepinephrine)
a.
α
1
b.
α
2
2.
β adrenergic receptor (epinephrine )
a.
β
1
b.
β
2
Control of catecholamine release
The release of the catecholinamines is controlled from nerve cells within the posterior
hypothalamus which can ultimately stimulate acetylcholine release from nerve terminals of
the sympathetic nerves. This induces depolarization of the chromaffin cells and exocytosis
of the catecholamine containing granules following a rise in intracellular calcium
concentration.
Prof. Dr. Hedef D. El-Yasin 2014
14
Metabolic Effects of catecholamines Hormones
In general, circulating epinephrine and norepinephrine released from the
adrenal medulla have the same effects on target organs as direct stimulation
by sympathetic nerves, although their effect is longer lasting.
glycogenolysis to provide extra sources of glucose
Stimulation of lipolysis in fat cells to provided fatty acids for energy production in
many tissues and aids in conservation of dwindling reserves of blood glucose.
Increased metabolic rate due to increased oxygen consumption and heat
production increase throughout the body in response to epinephrine binding beta
receptors.
Increased breakdown
of glycogen in skeletal
muscle to provide
glucose for energy
production.
Water and electrolytes
metabolism
Decreased sodium
excretion and glomerular
filtration due to direct effects on the kidney
effects on renin secretion leads to increased aldosterone production with effects on
distal sodium handling
Serum potassium may be increased
Catecholamine Degradation
All catecholamines are rapidly eliminated from target cells and the circulation by three
mechanisms:
1. reuptake into secretory vesicles
2. uptake in non-neural cells (mostly liver)
3. degradation.
Degradation relies on two enzymes:
1. catechol O-methyltransferase (COMT) in non-neuronal tissues
2. and monoamine oxidase (MAO) within neurons.
to produce metabolites (metanephrines and vanillylmandelic acid (VMA)) from free
catecholamines.

Prof. Dr. Hedef D. El-Yasin 2014
15
Metabolites and free catecholamine are eliminated by direct filtration into the urine and
excreted as:
1) free norepinephrine,
2) conjugated norepinephrine
3) metanephrines and
4) VMA
Phaeochromocytoma
Catecholamine-secreting tumors arise from the chromaffin cells of the adrenal medulla.
The condition is relatively rare, occurring in up to 0.5% of hypertensive patients in hospital
clinics. The symptoms are variable, and it is not uncommon for years to elapse before the
diagnosis is made. Adrenal phaeochromocytomas secrete mainly noradrenaline.
Episodes of increased catecholamine secretion cause hypertension, palpitation, headache
and sweating.
The most widely used screening test is urinary metanephrines. Measurement of
fractionated metanephrines (metadrenaline and normetadrenaline) has a sensitivity of 97%
and a specificity of 69% for the diagnosis of phaeochromocytoma.
Plasma free metaphrine and normetanephrine measurement has a sensitivity approaching
100% and specificity of 90%. Plasma catecholamine measurements should be undertaken
in the resting state through an indwelling cannula

Prof. Dr. Hedef D. El-Yasin 2014
16
Questions
1) Glucocorticoid receptors are in the cytoplasm. AII of the following statements about the
process by which the hormone influences transcription arc correct except:
a) The hormone must be in the free state to cross the cell membrane.
b) Cytoplasmic receptors may be associated with heat shock proteins.
c) The receptor-hormone complex is not activated/transformed until it is
translocated to the nucleus.
d) In the nucleus, the activated/transformed receptor-hormone complex searches for
specific sequences on DNA called HREs (hormone receptor elements).
e) The activated receptor-hormone complex may either activate or repress
transcription of specific genes (only one activity per gene).
C
Dissociation of the heat shock protein from the receptor- hormone complex in the
cytosol activates the complex. A: Steroid hormones travel bound to plasma proteins, but
some is always free. D: These are consensus sequences in DNA. E: Activation is more
common, but glucocorticoids repress transcription of the proopiomelanocortin gene.
2) All of the following are normal events leading to secretion of aldosterone from the
adrenal gland except:
a) Renin is released by the kidney in hypovolemia.
b) Angiotensinogen binds to membrane receptors.
c) Ca
2+
levels in the cell rise.
d) aldosterone is secreted into the blood.
B
Angiotensinogen is cleaved by renin to angiotensin I, which must further be cleaved
by converting enzyme to active angiotensin II. A: This is a major signal. C: This lead to
increased Ca
2+
and activation of protein kinase C.
