NEOPLASIA

OBJECTIVES
DEFINITION.
NOMECLATURE OF NEOPLASMS.
BIOLOGY OF TUMOR GROWTH.
PRECANCEROUS CONDITIONS.
HOST DEFENCE AGAINST CANCERS.
EFFECTS OF TUMORS ON THE HOST.
GRADING AND STAGING OF CANCERS.
NEOPLASIA
•
Neoplasm
= a new growth/ interchangeable with
Tumor
•
Oncology
(Gr. oncos = tumor): study of neoplasms
•
Cancer
: all malignant tumors
•
Neoplasm:
- an abnormal tissue proliferation
- exceeds that of adjacent normal tissue
- Proliferation continues even after removing inciting stimulus
(Tumor autonomous)
Heritable genetic changes in stem cell (T-IC)
Progeny of tumor cells (growth advantage)
NOMENCLATURE
• Tumors c/o two basic components
1. Proliferating neoplastic cells
2. Stroma:
CT + BVs:
vital
Providing B. supply
Offering support
Cross-talk with neoplastic cells influence growth
• Variable proportions of two components
Determines consistency
↑↑Neoplastic cells
↑↑fibrotic stroma
Desmoplasia: hard tumor
Soft/fleshy (encephaloid)
• Nomenclature based on neoplastic cells
NOMENCLATURE OF BENIGN TUMORS
• By attaching suffix
-oma
to cell of origin
• Tumors of mesenchymal cells follow this rule
-
fibroma
- chondroma
- osteoma
• Benign epithelial tumors more complex
- variously classified according to
Cells of origin
Microscopic &/or macroscopic
appearance

•
Adenoma
1. Forming glandular structures e.g.
Renal cell adenoma
Thyroid follicular adenoma
2. Tumors derived from glands but not necessarily reproducing
glandular structures e.g.
Thyroid follicular adenoma
• Papilloma
: producing micro- or macro- visible finger-like (warty)
projections from epithelial surfaces, e.g.
laryngeal papilloma
•
Cystadenoma
: adenoma forming large cystic space (es) e.g.
ovarian cystadenoma
•
Papillary cystadenoma
as above + papillary projections e.g.
ovarian papillary cystadenoma
•
Polyp:
benign/producing macro. visible projection above mucosa e.g.
Adenomatous polyp of stomach & colon
• Malignant polyps are designated polypoid cancers
Follicular adenoma thyroid
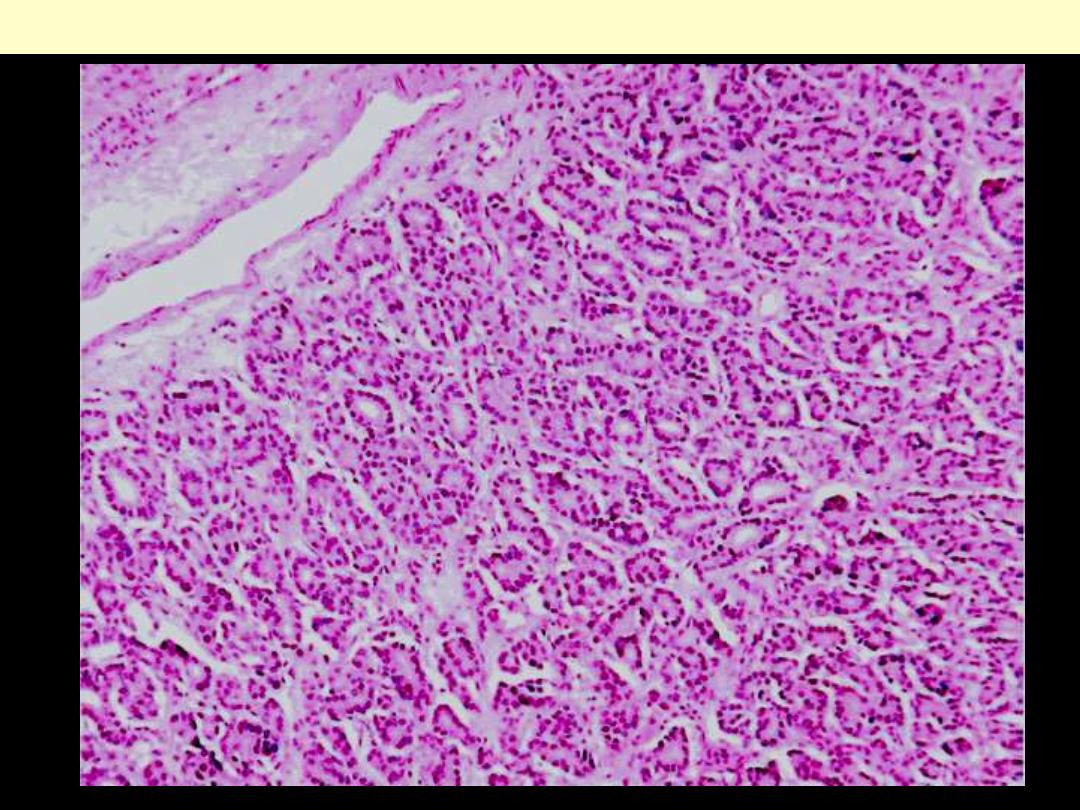
Follicular adenoma thyroid
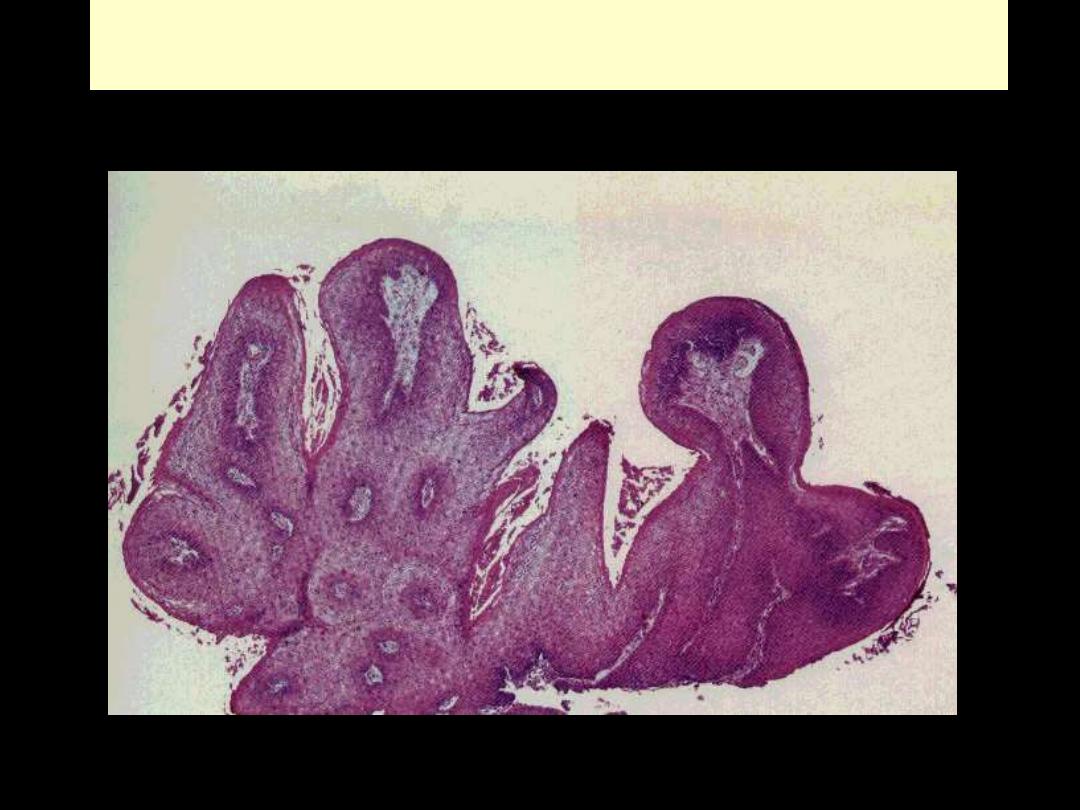
Papilloma
Squamous papilloma larynx
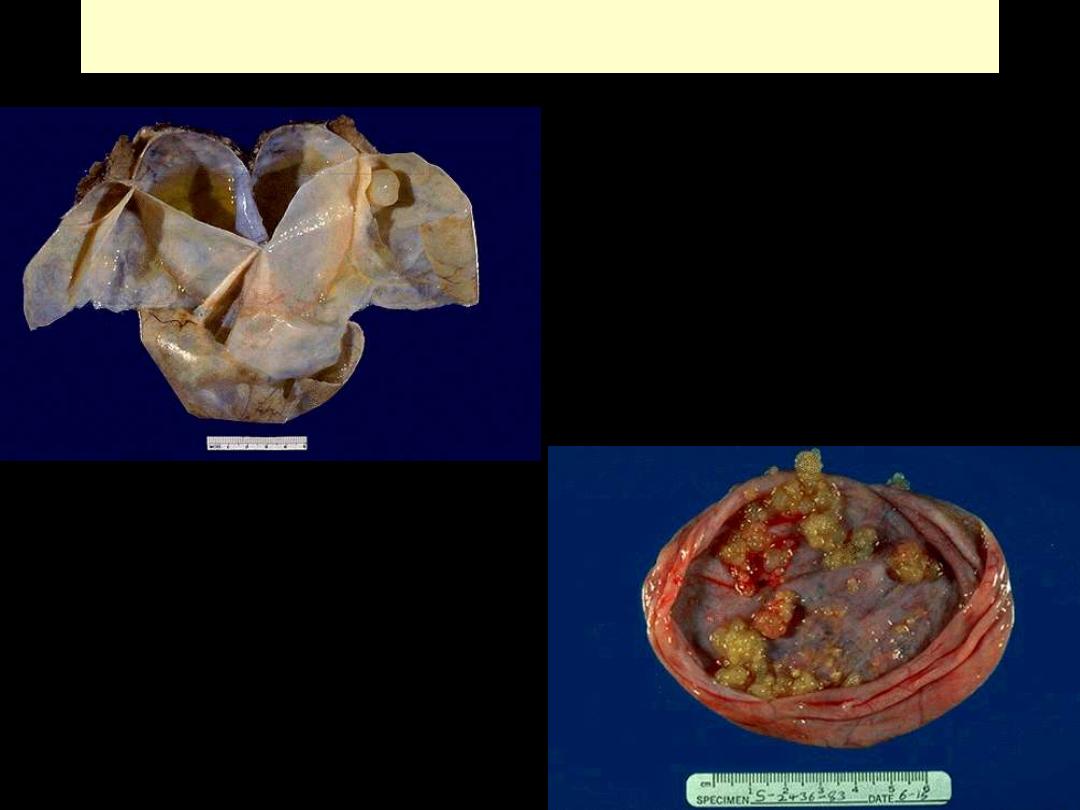
Ovarian cystadenoma and papillary cystadenoma
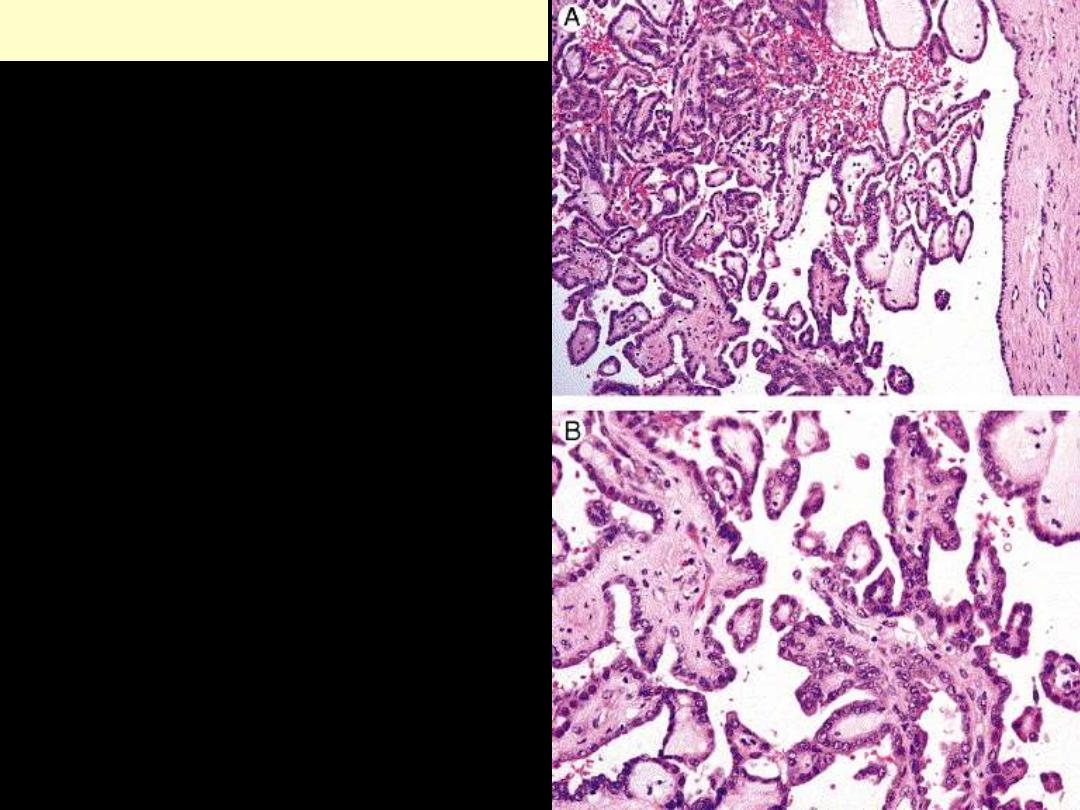
Papillary cystadenoma
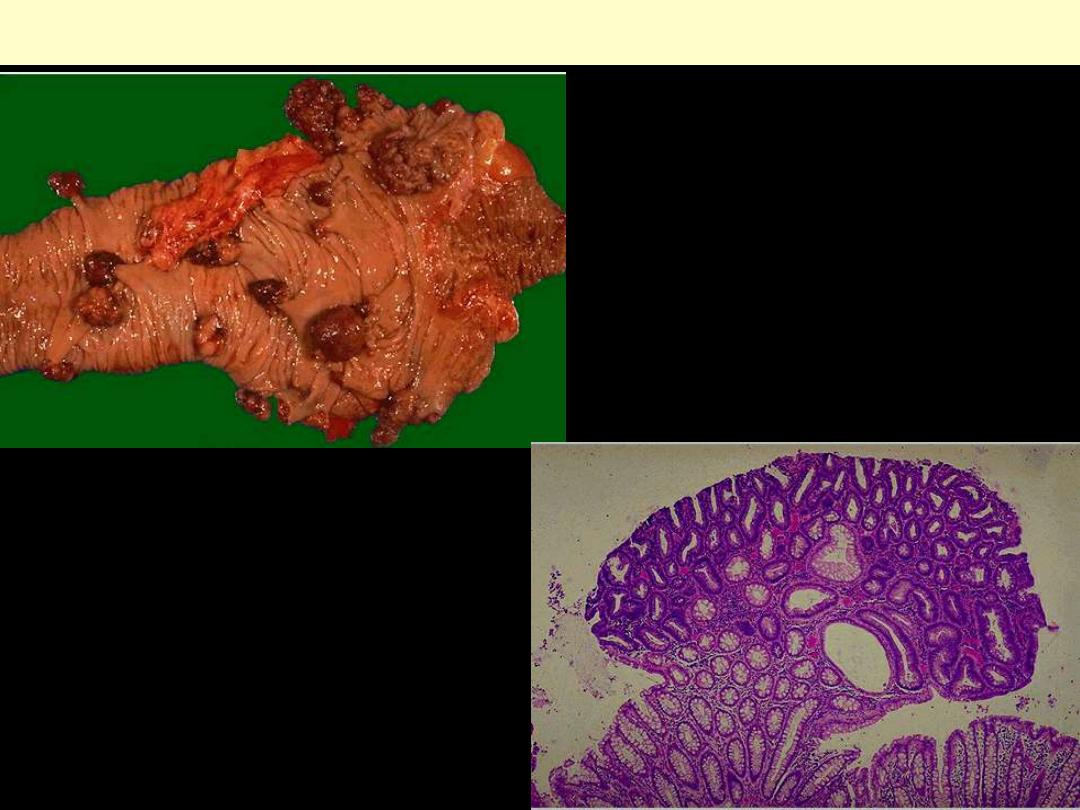
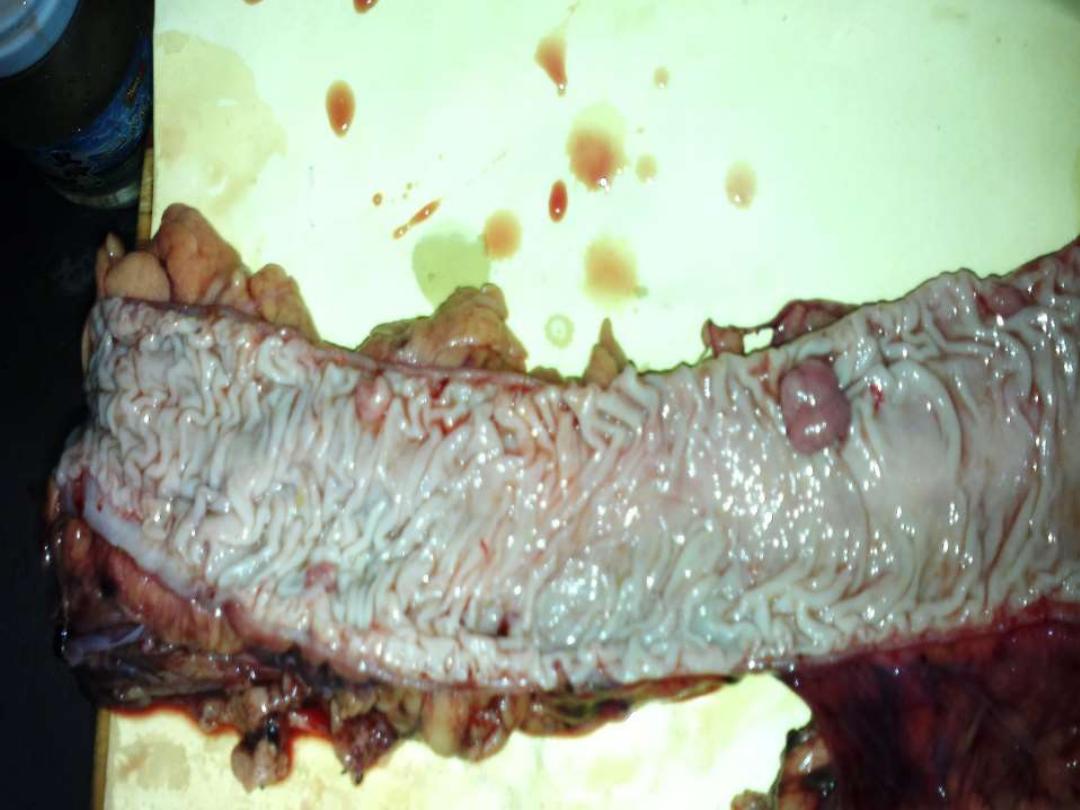
Adenomatous polyps large intestine

NOMENCLATURE OF MALIGNANT TUMORS
• Follows essentially same scheme used for benign neoplasms
+ certain additions
• Sarcomas
(Greek sar = fleshy):
- malignant tumors arising from or differentiating towarsd
mesenchymal cells
- generally scant CT stroma
fleshy consistency
• Nomenclature of sarcomas relies on either
a. cell of origin
b. differentiation
- fibrosarcoma (fibroblasts)
- liposarcoma (lipocytes)
- leiomyosarcoma (SMCs)
- rhabdomyosarcoma (striated muscle cells)

• Carcinoma:
malignant neoplasm of epithelial cell origin derived from
any one of three germ layers
- arising in epidermal epithelial cells (ectoderm)
- derived from renal tubules (mesoderm)
- originating from epithelial cells line GIT (endoderm)
• Further qualified according to morphology e.g.
- with a glandular growth pattern: adenoca
- with squamous cells arising in any epithelium: squamous cell ca.
• Specify organ of origin e.g.
- Renal cell Ca.
- Bronchogenic squamous cell Ca.
Undifferentiated malignant tumor
c/o undifferentiated cells (no
enough criteria to point to site of origin or differentiation
Mixed tumor:
due to divergent differentiations of a single line of
neoplastic cells into other tissues e.g.
e.g. mixed tumor of salivary glands
Benign epithelial/myoepithelial cells
glands/strands/sheets
scattered within
myxoid stroma
- They are in reality adenomas
(pleomorphic adenoma)
Squamous nests
Cartilage/bone
MIXED PAROTID TUMOR
Pleomorphic Adenoma
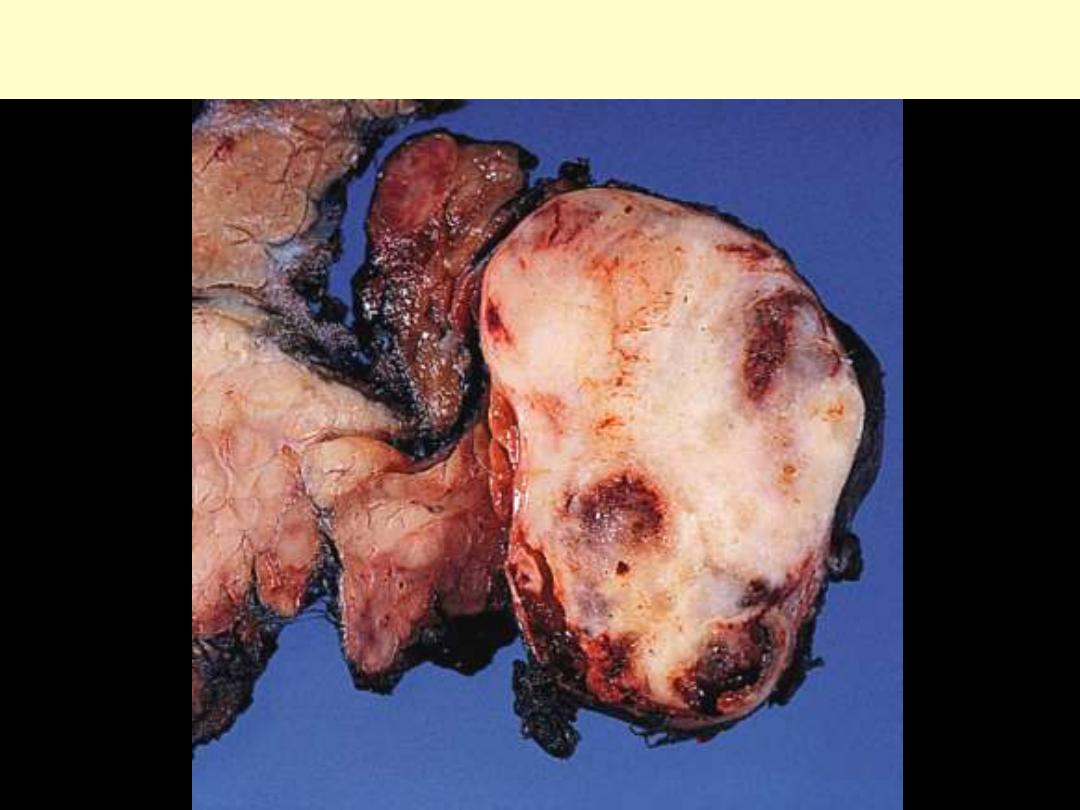
MIXED PAROTID TUMOR
(pleomorphic adenoma)
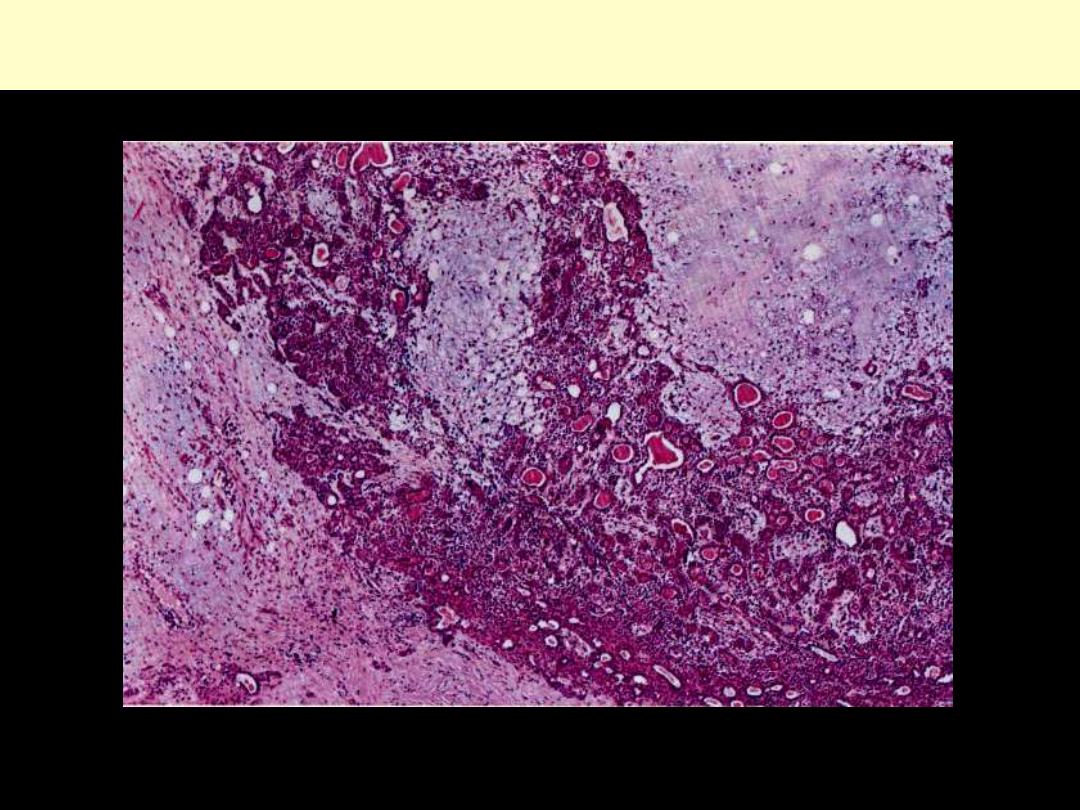
Mixed salivary gland tumor (Pleomorphic adenoma)
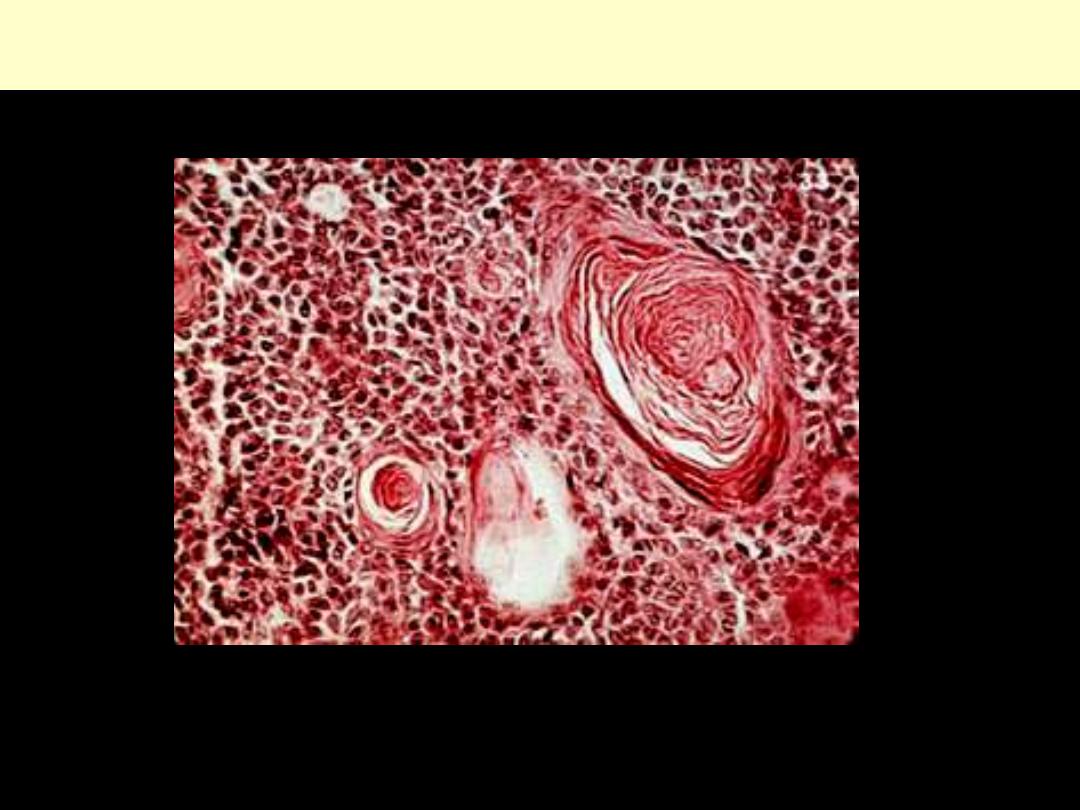
Mixed salivary gland tumor (Pleomorphic adenoma)
Teratomas
- c/o of variety of neoplastic cell types representative of > one germ
layer/usually all the three
- Arise from
totipotent cells
(located in gonads)
-
Gonads
principal site
-
Totipotent cells
differentiate along various germ lines
producing
different tissues
skin
(ectodermal)
muscle/fat
(mesodermal)
gut epith
(endodermal)
- tooth/brain tissues/bronchial structures etc,
• A common example
cystic teratoma (dermoid cyst)
- seen in ovary
- commonly cystic
- skin & adenexae predominant component
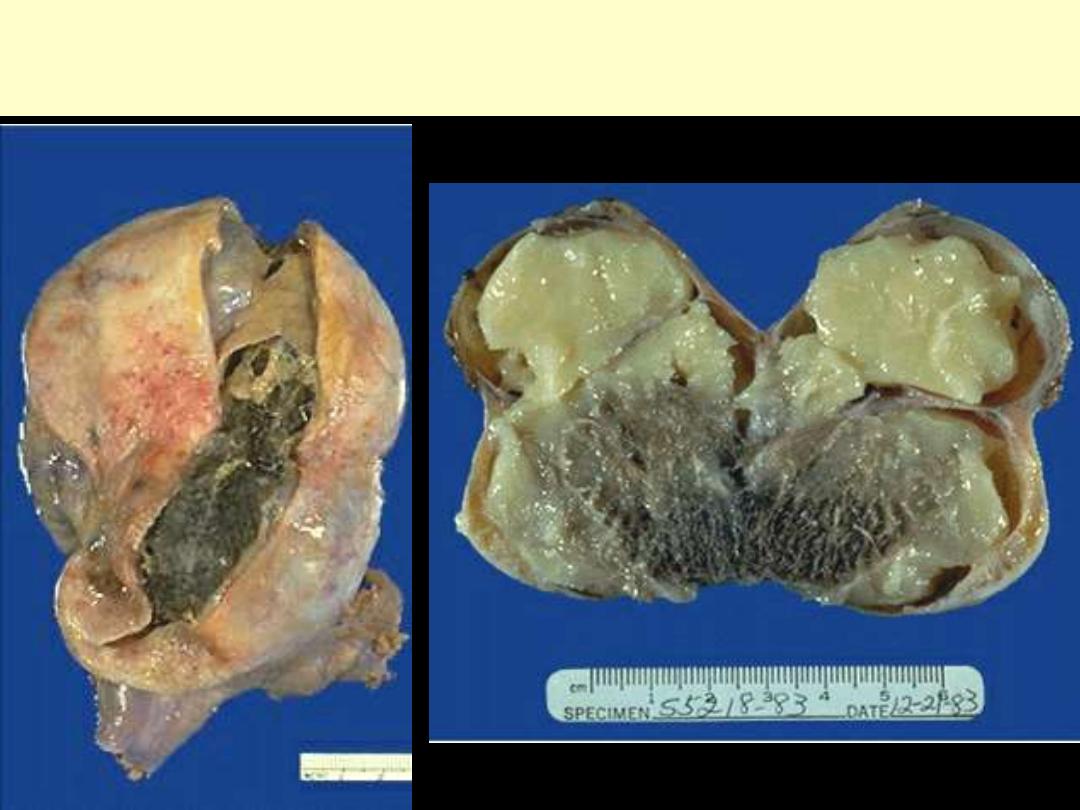
OVARIAN CYSTIC TERATOMA
Dermoid cysts

• Inappropriate designations/do not follow above principles
- usage continues conventionally e.g.
Melanoma
(melanocarcinoma)
Seminoma
(type of testicular carcinoma)
Hepatoma
(hepatocellular carcinoma)
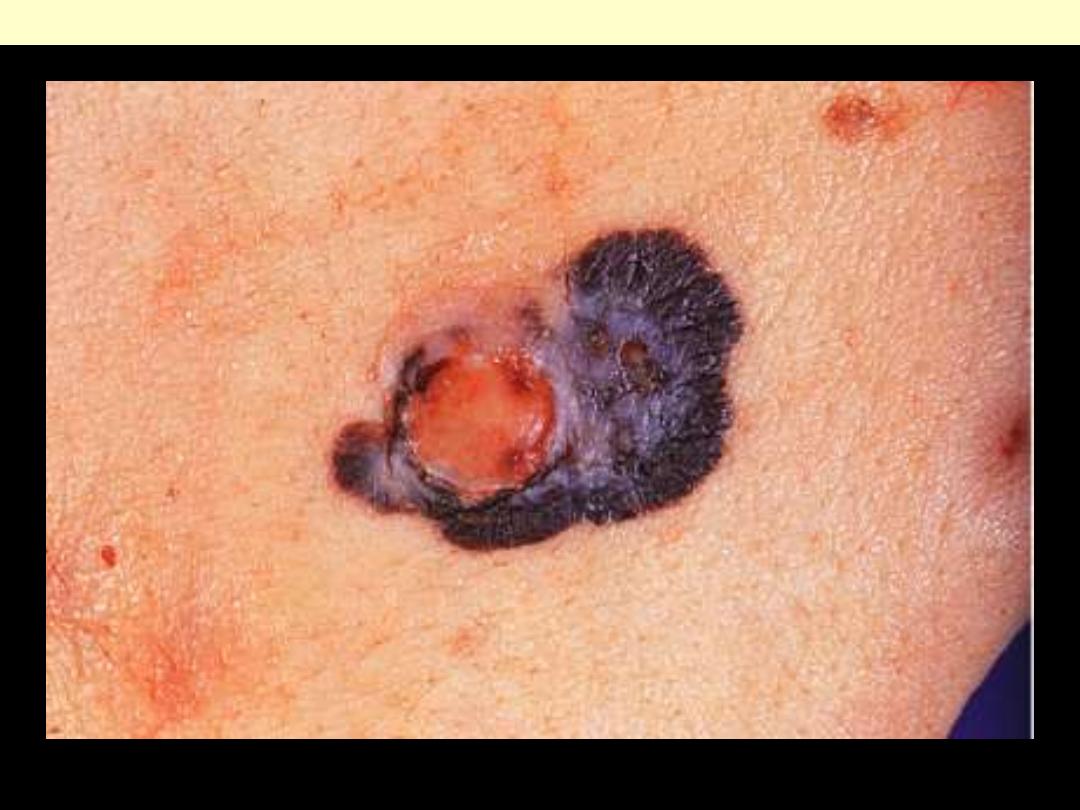
Melanoma skin
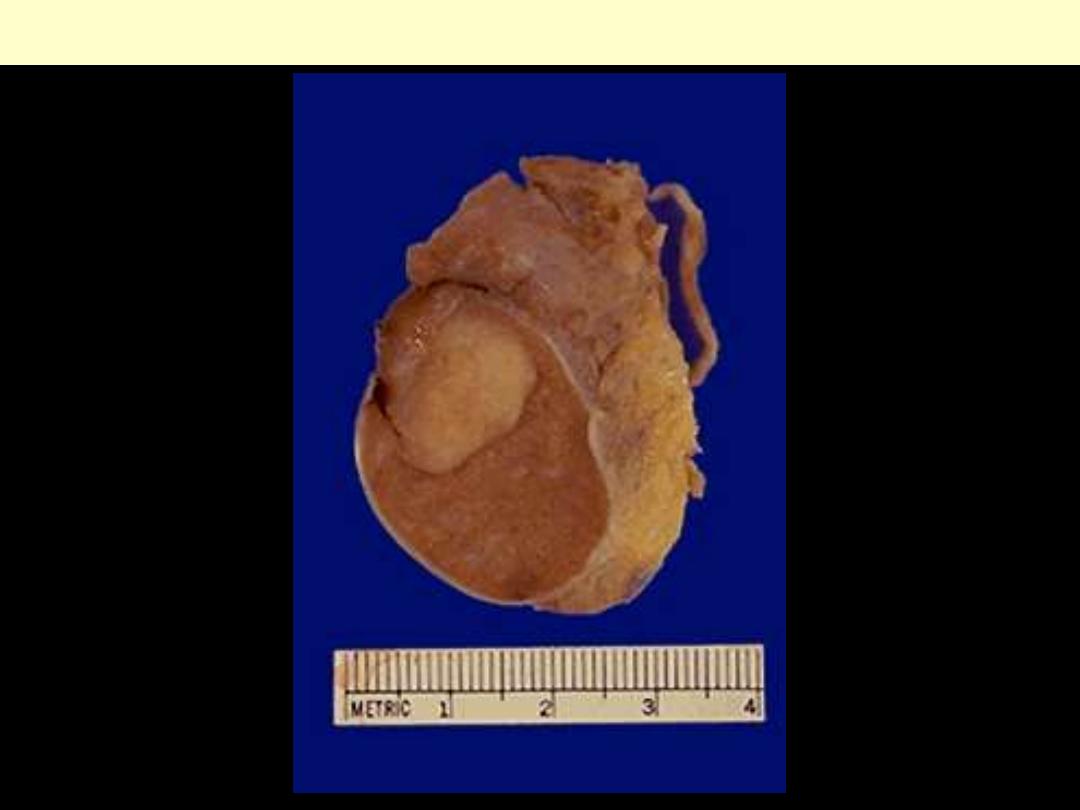
Testicular Seminoma
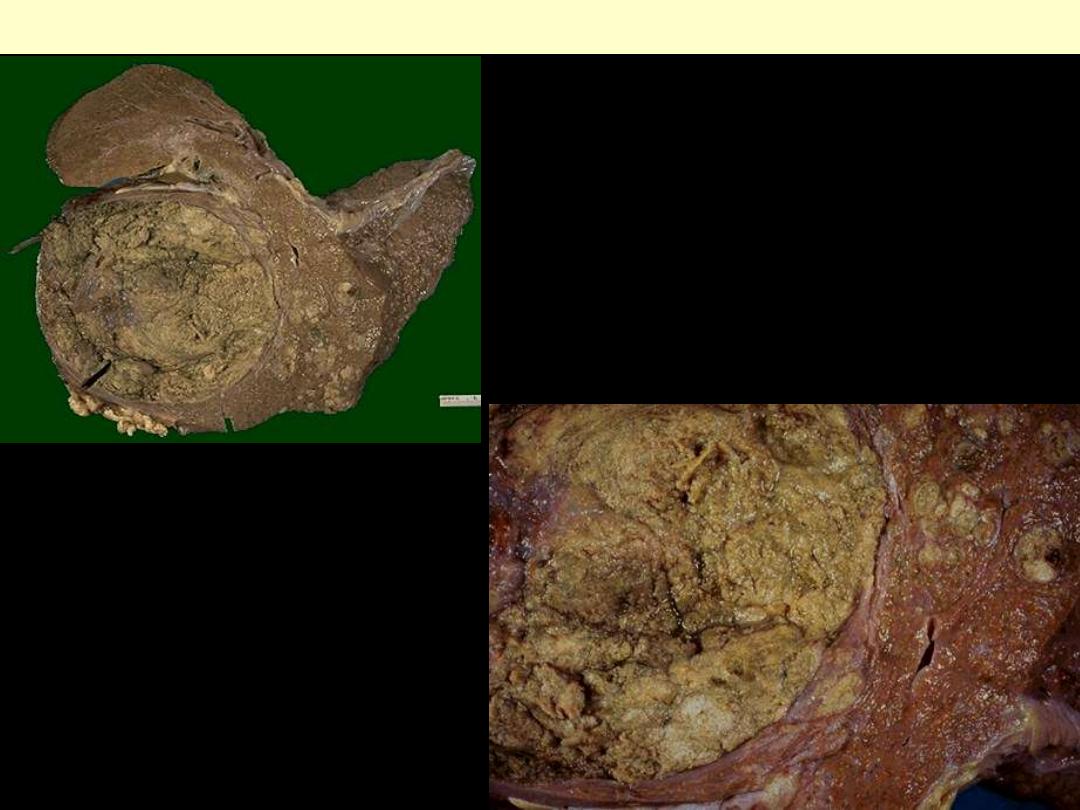
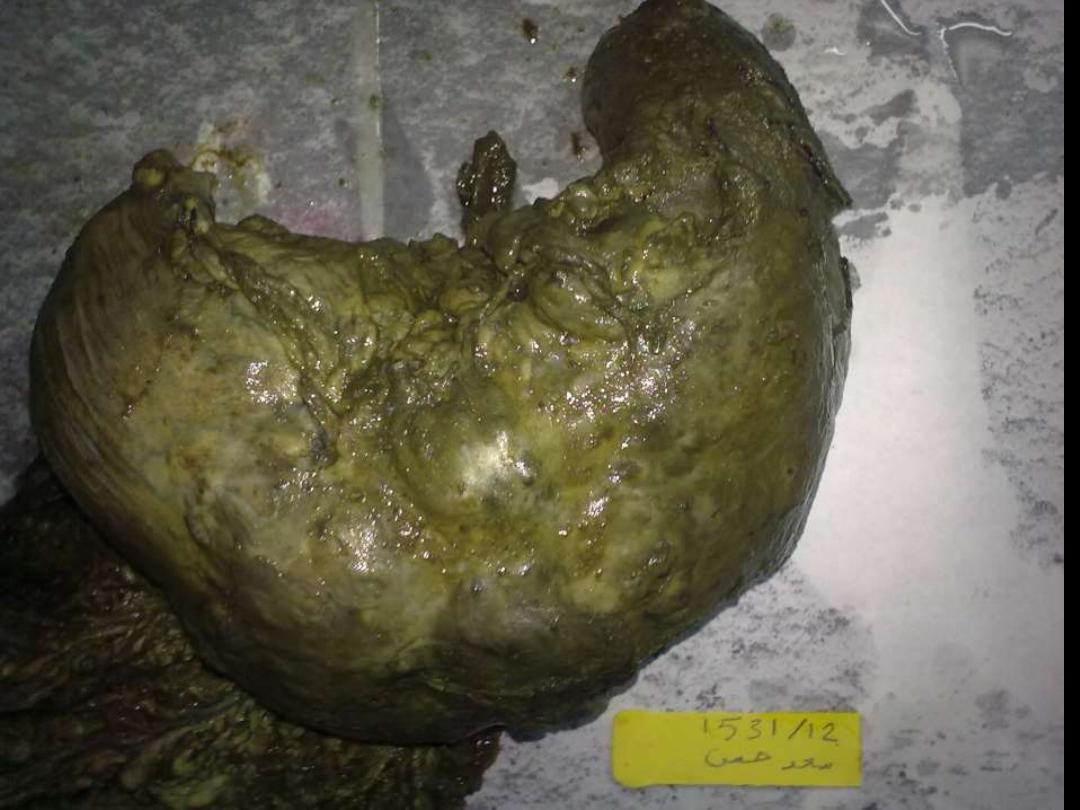
Hepatoma (Hepatocellular ca)
The neoplasm is large and bulky and has a greenish
cast because it contains bile. To the right of the main
mass are smaller satellite nodules.

Two entities ending with –oma
but not true neoplasms
:
anomalous
development
1. Choristoma
(ectopia; heterotopia)
(Gr. choristos: separated):
- presence of a normal tissue in an unexpected location e.g.
pancreatic tissue in wall of esophagus/stomach/ SI.
- may form masse mimicking neoplasm grossly
2. Hamartoma:
aberrant differentiation produce mass
1. c/o disorganized but mature tissues
2. Tissues related to site of origin
-
Lung hamartoma
: islands of cartilage/blood vessels/bronchial mucosa
- One element can predominate
purely cartilaginous/angiomatous
Ectopic pancreas wall of jejunum
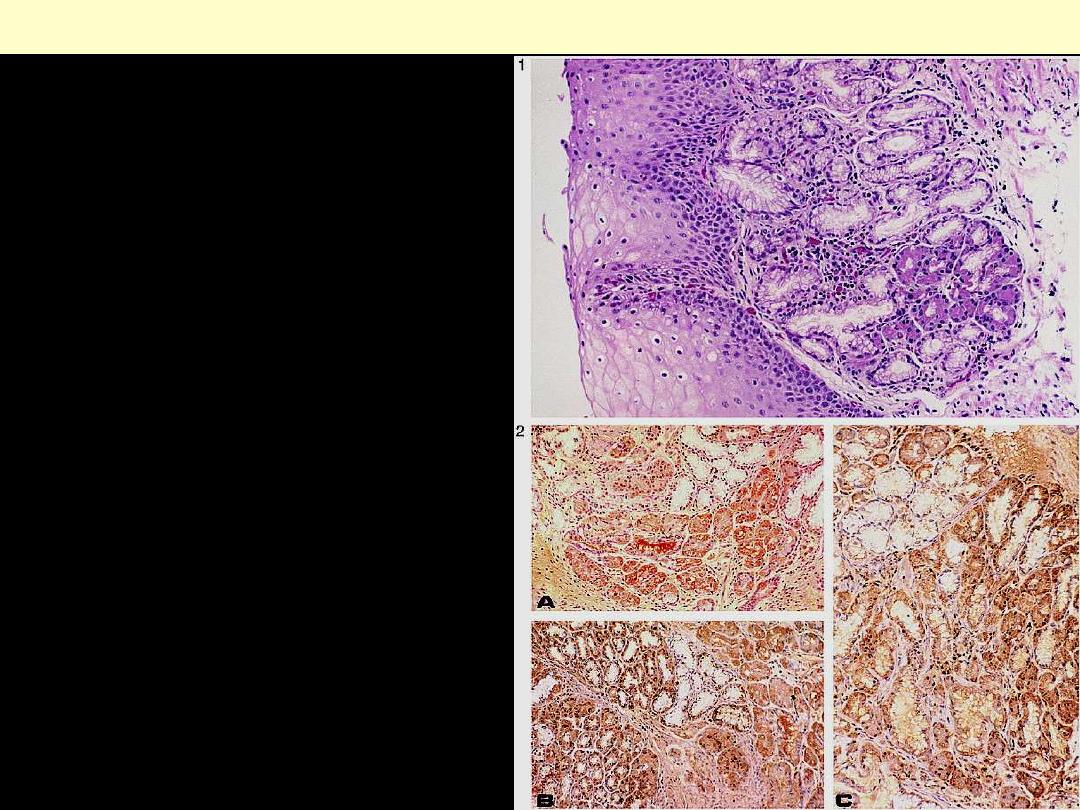
Figure 1.Nest of pancreatic acinar tissue
covered by squamous esophageal mucosa
(hematoxylin-eosin, original magnification
×250).
Figure 2.Immunostaining for the pancreatic
exocrine component of PAT. Yellow-brown–
stained cells represent positive staining for
trypsin (A), lipase (B), and amylase (C)
Ectopic pancreatic tissue esophagus
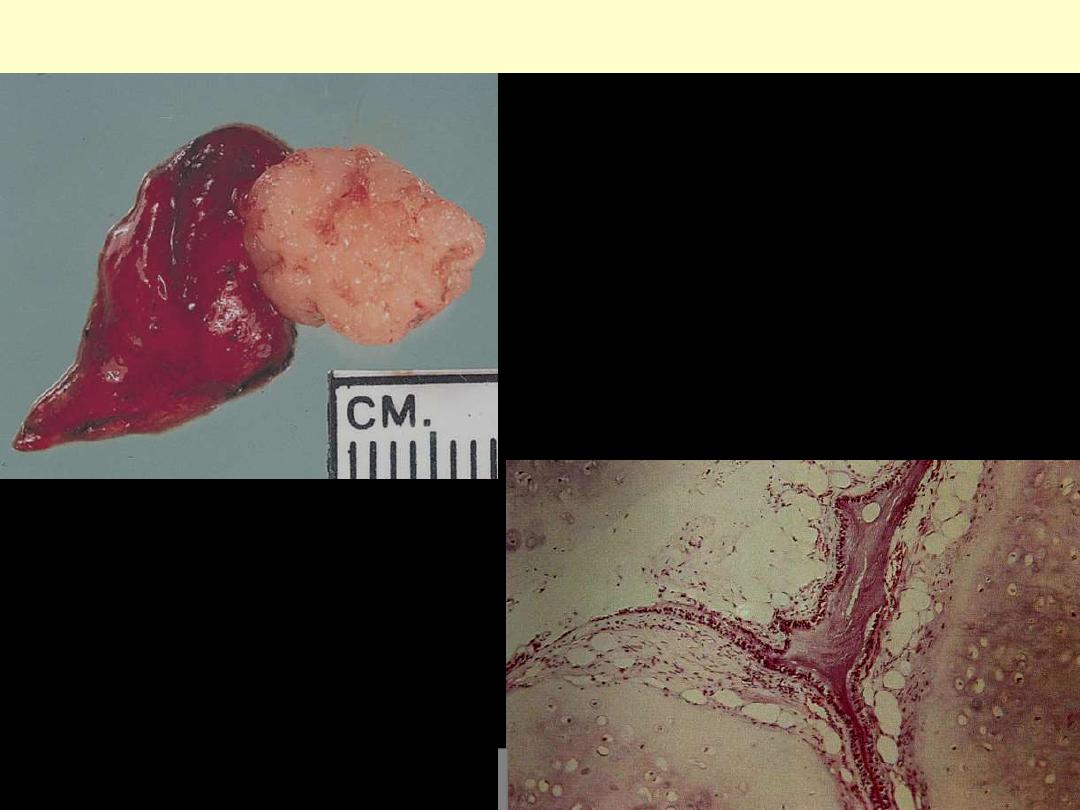
Pulmonary hamartoma. The lesion is subpleural, is
well circumscribed, and has a glistening cut surface.
PULMONARY HAMARTOMA
A mixture of cartilage, respiratory epithelium
and fat

IMPORTANCE OF NOMENECLATURE
• Specific names have specific clinical implications
-
Seminoma
- tends to remain localized to testis for some time
- Spreads to para-aortic LNs
- Extremely radiosensitive/radiotherapy
eradication
-
Embryonal ca
- more aggressive
- disseminates rapidly
- invades locally beyond testis
- spreads extensively throughout body
- not radiosensitive
Tissue of Origin
Benign
Malignant
COMPOSED OF ONE PARENCHYMAL CELL TYPE
Tumors of Mesenchymal Origin
Connective tissue and
derivatives
Fibroma
Fibrosarcoma
Lipoma
Liposarcoma
Chondroma
Chondrosarcoma
Osteoma
Osteogenic sarcoma
Endothelial and Related Tissues
Blood vessels
Hemangioma
Angiosarcoma
Lymph vessels
Lymphangioma
Lymphangiosarcoma
Synovium
Synovial sarcoma
Mesothelium
Mesothelioma
Brain coverings
Meningioma
Invasive meningioma
Blood Cells and Related Cells
Hematopoietic cells
Leukemias
Lymphoid tissue
Lymphomas
Muscle
Smooth
Leiomyoma
Leiomyosarcoma
Striated
Rhabdomyoma
Rhabdomyosarcoma
Tumors of Epithelial Origin
Stratified squamous
Squamous cell papilloma Squamous cell carcinoma
Basal cells of skin or
adnexa
Basal cell carcinoma
Epithelial lining of
glands or ducts
Adenoma
Adenocarcinoma
Papilloma
Papillary carcinomas
Cystadenoma
Cystadenocarcinoma
Respiratory passages
Bronchial adenoma
Bronchogenic carcinoma
Renal epithelium
Renal tubular adenoma
Renal cell carcinoma
Liver cells
Liver cell adenoma
Hepatocellular carcinoma
Urinary tract
epithelium
(transitional)
Transitional-cell
papilloma
Transitional-cell carcinoma
Placental epithelium
Hydatidiform mole
Choriocarcinoma
Placental epithelium
Hydatidiform mole
Choriocarcinoma
Testicular epithelium
(germ cells)
Seminoma
Embryonal carcinoma
Tumors of Melanocytes Nevus
Malignant melanoma
MORE THAN ONE NEOPLASTIC CELL TYPE—MIXED TUMORS,
USUALLY DERIVED FROM ONE GERM CELL LAYER
Salivary glands
Pleomorphic adenoma
(mixed tumor of salivary
origin)
Malignant mixed tumor of
salivary gland origin
Renal anlage
Wilms tumor
MORE THAN ONE NEOPLASTIC CELL TYPE DERIVED FROM
MORE THAN ONE GERM CELL LAYER—TERATOGENOUS
Totipotential cells in
gonads or in embryonic
rests
Mature teratoma, dermoid
cyst
Immature teratoma,
teratocarcinoma

BIOLOGY OF TUMOR GROWTH
• Malignant tumors differ from benign ones by natural history
(expected behavior)
I. Malignant transformation
II. Growth rate
III. Local invasion
IV. Distant metastases

I. Malignant transformation
Morphological features
used to distinguish benign/malignant
Differentiation and Anaplasia

DIFFERENTIATION AND ANAPLASIA
• Differentiation:
extent to which neoplastic cells resemble comparable
normal cells
- Degree of differentiation represented by a spectrum
- very well differentiated
- well differentiated
- moderately differentiated
- poorly differentiated
- undifferentiated (Anaplastic)

Very well differentiated tumor
• Neoplastic cells almost identical to native normal cells.
• A feature of benign tumors
Examples
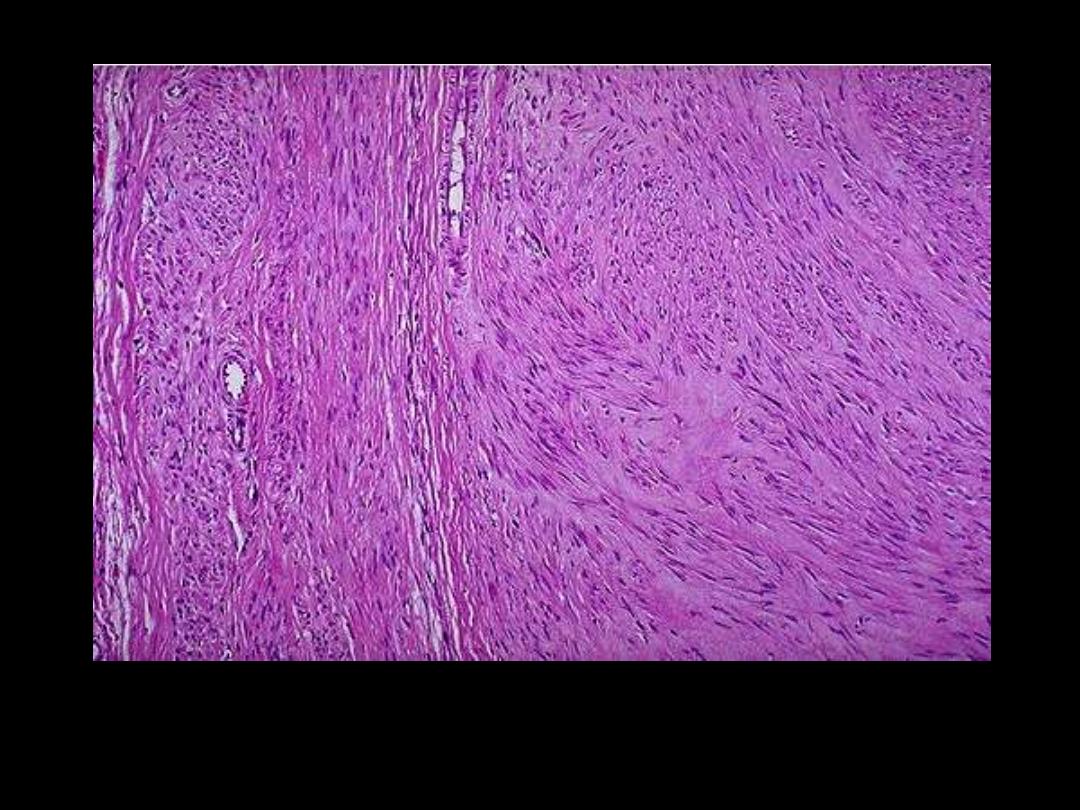
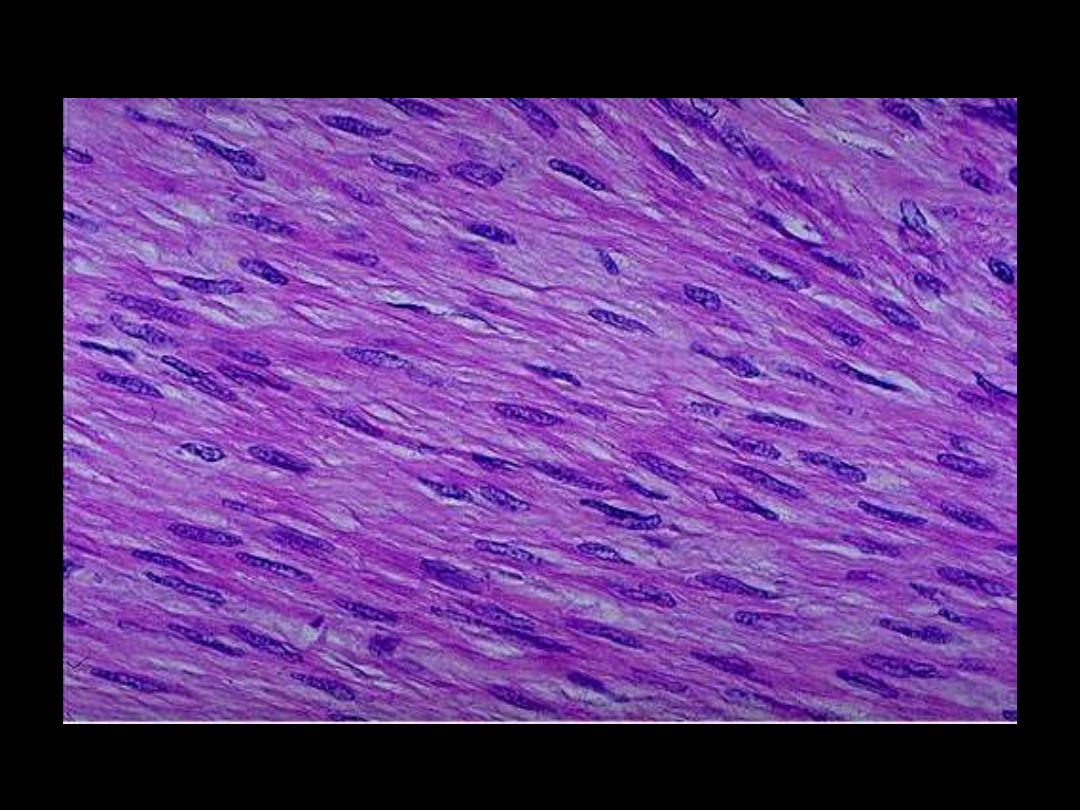
1. SMCs in leiomyoma
2. Adipocytes in lipoma
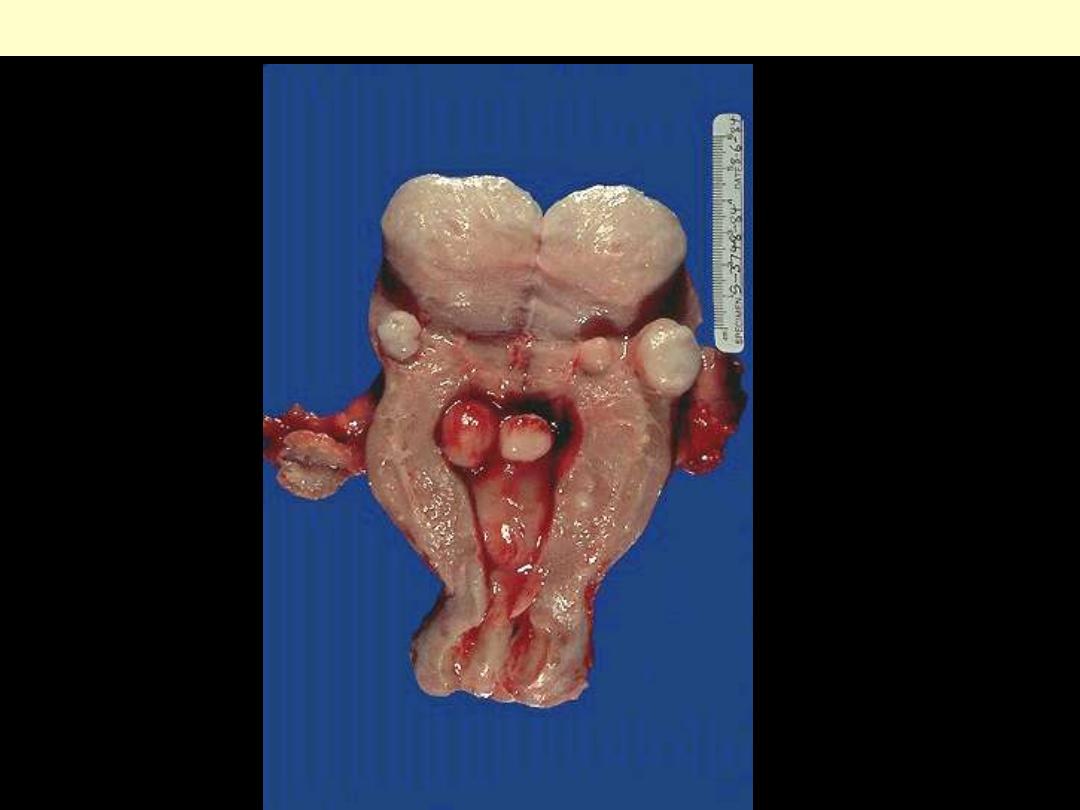
Leiomyomas uteri
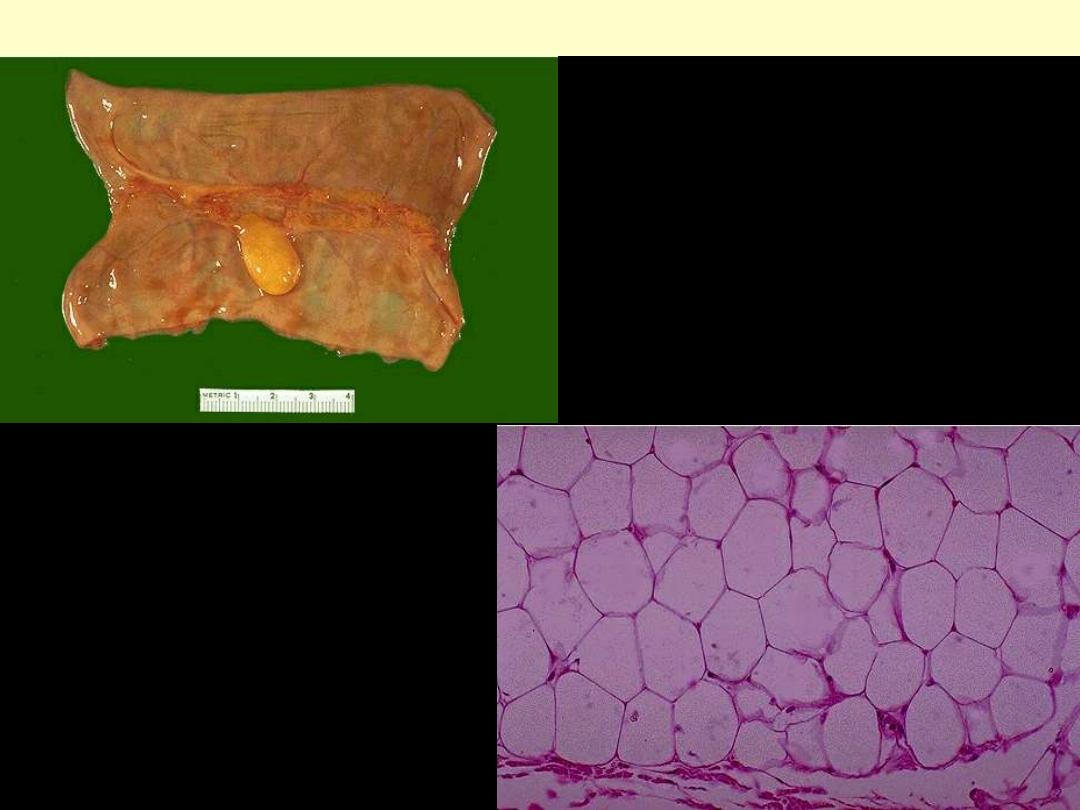
Lipoma small intestine

Malignant tumors divided into
1. Well-differentiated tumors:
-
C/O cells resembling comparable mature normal cells
- Certain WD follicular ca. thyroid follicles simulating normal
- Some SCC contain cells simulating normal squamous cells
• Morphologic Dx of malignancy in WD tumors can be difficult.
2. Poorly differentiated tumors
- C/O cells hardly resemble (& only focally) normal cells of origin

3. Moderately differentiated tumors
-
features in-between WD/PD tumors
4. undifferentiated tumors (anaplastic tumors)
- Anaplasia:
total
lack of differentiation
- Undifferentiated tumors
c/o primitive-appearing/unspecialized
cells/can not be assigned to any of normal cells

Morphologic features of anaplasia
(Anaplastic/undifferentiated tumors)
1. Pleomorphism:
variations in size/shape of cells (and nuclei)
- large cells adjacent to small cells
2. Abnormal nuclear morphology
a. hyperchromasia
b.
↑N/C
(1/1 Vs 1/4-1/6)
c. variations in shape/abnormal chromatin clumping & distrib.
d. Large nucleoli
3.
Mitoses:
↑/
atypical
4. Loss of polarity;
disturbed orientation of cells
5. Other changes.
a. Tumor giant cells
b. Large areas of ischemic necrosis
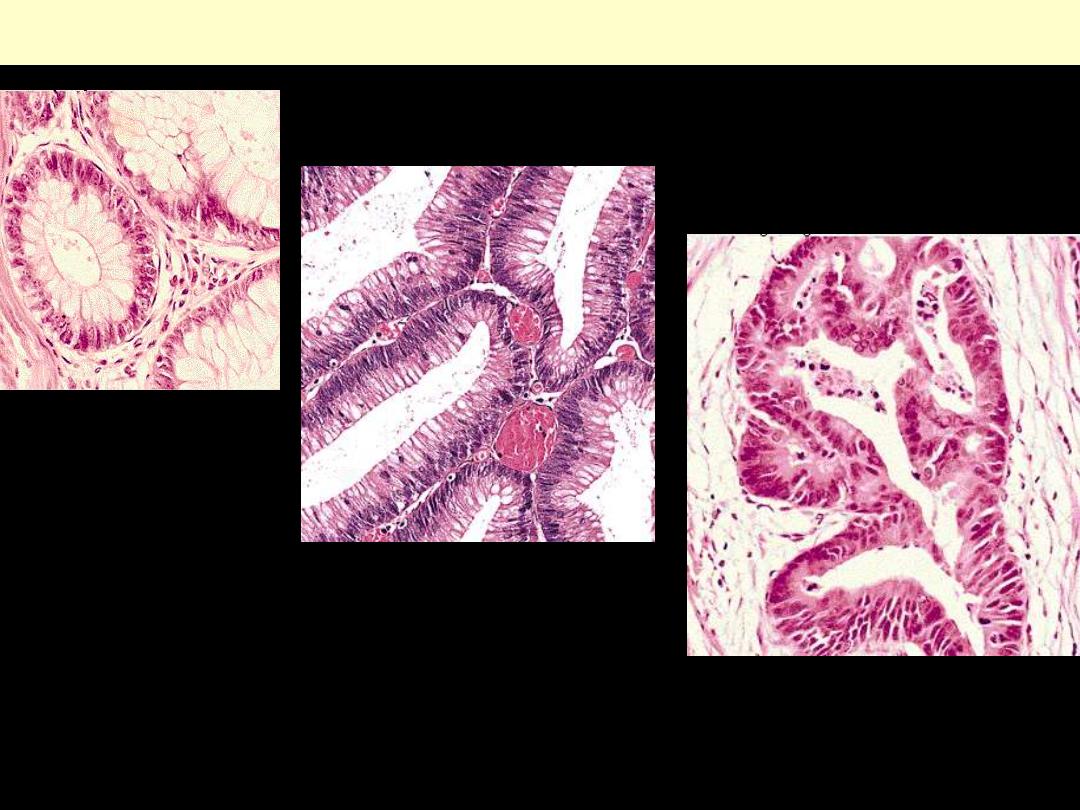
Degrees of differentiation
Normal
adenoma
carcinoma
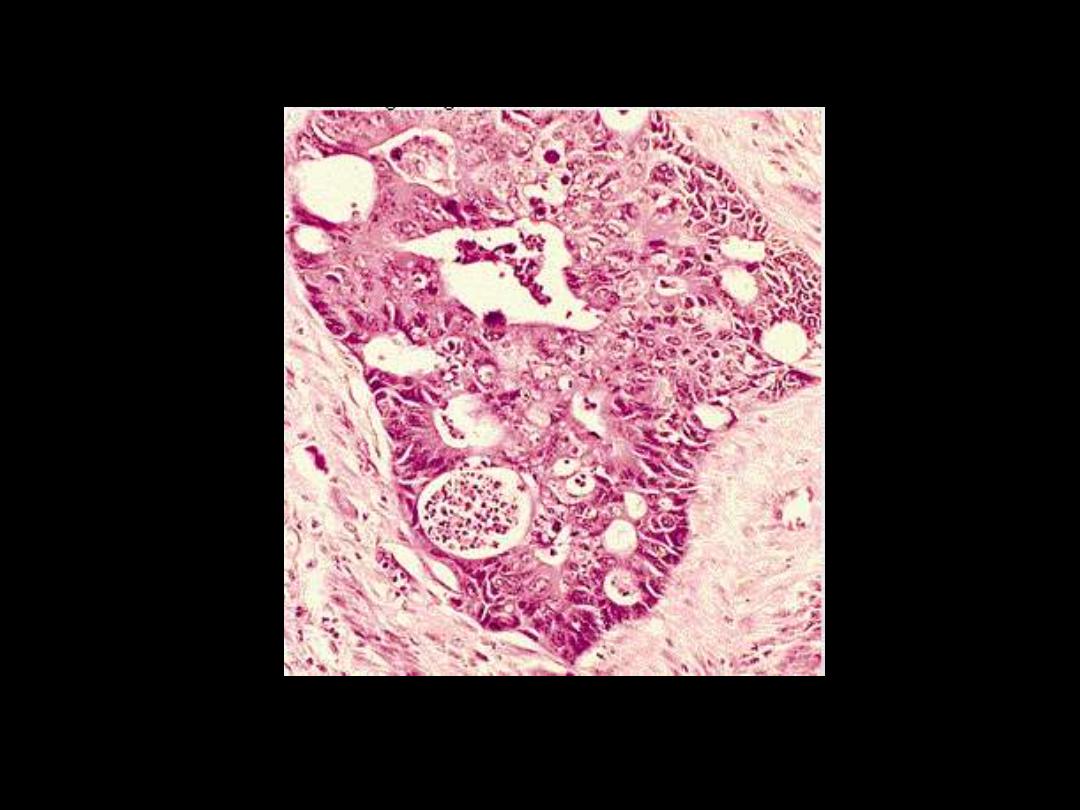
Poorly differentiated
Very little evidence to suggest site of origin
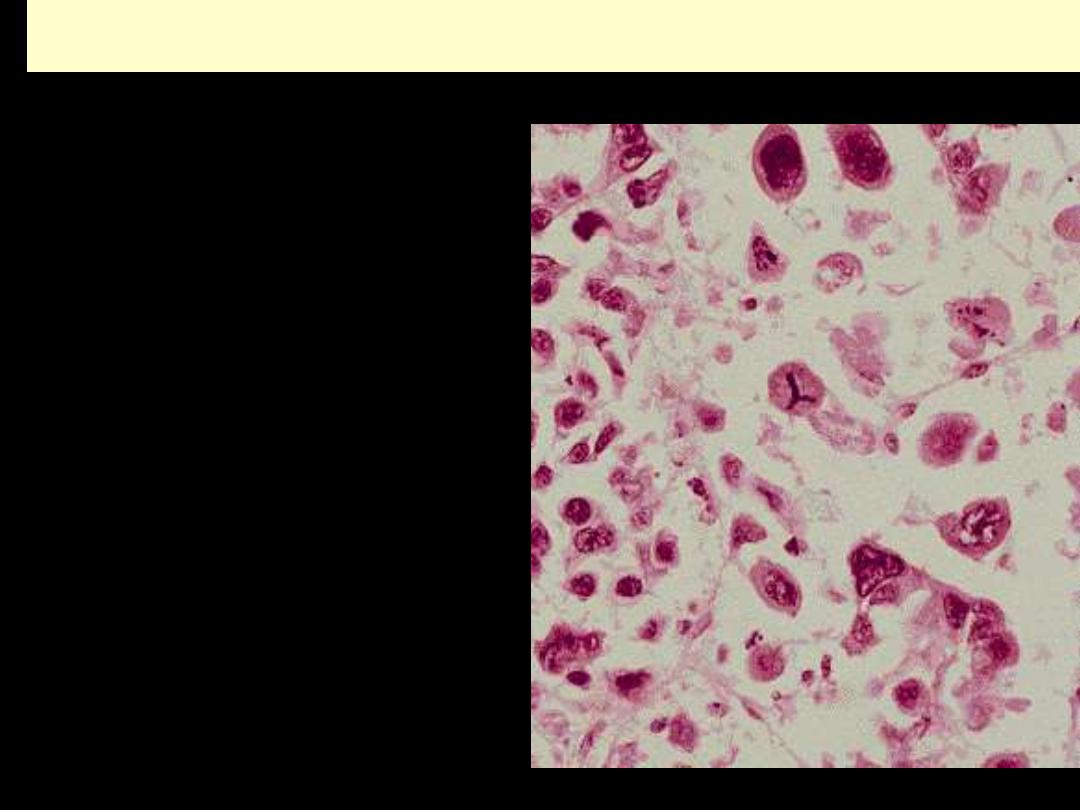
UNDIFFERENTIATED (ANAPLASTIC) CANCER
Complete loss of differentiation
(primitive cells).
Frequent mitoses including abnormal
ones
Cells/nuclei show marked
pleomorphism/sometimes
multinucleated tumor giant cells
Extreme nuclear hyperchromasia
Marked nuclear enlargement N:C may
reach 1:1 (instead of 1:4 or 1:6)
The chromatin is coarsely clumped and
irregularly distributed
Usually large, prominent nucleoli
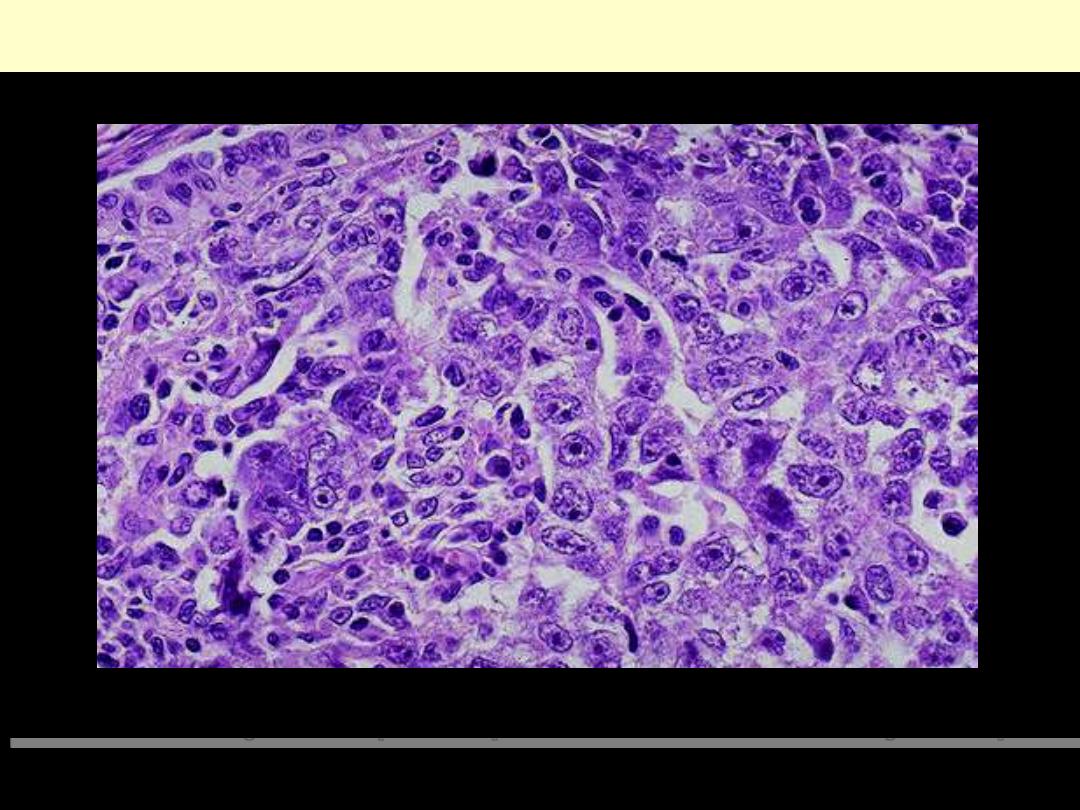
UNDIFFERENTIATED/ANAPLASTIC CARCINOMA
This neoplasm is so poorly differentiated that it is difficult to tell the cell of origin. Note that nucleoli
are numerous and large in this neoplasm. Neoplasms with no differentiation are designated anaplastic.
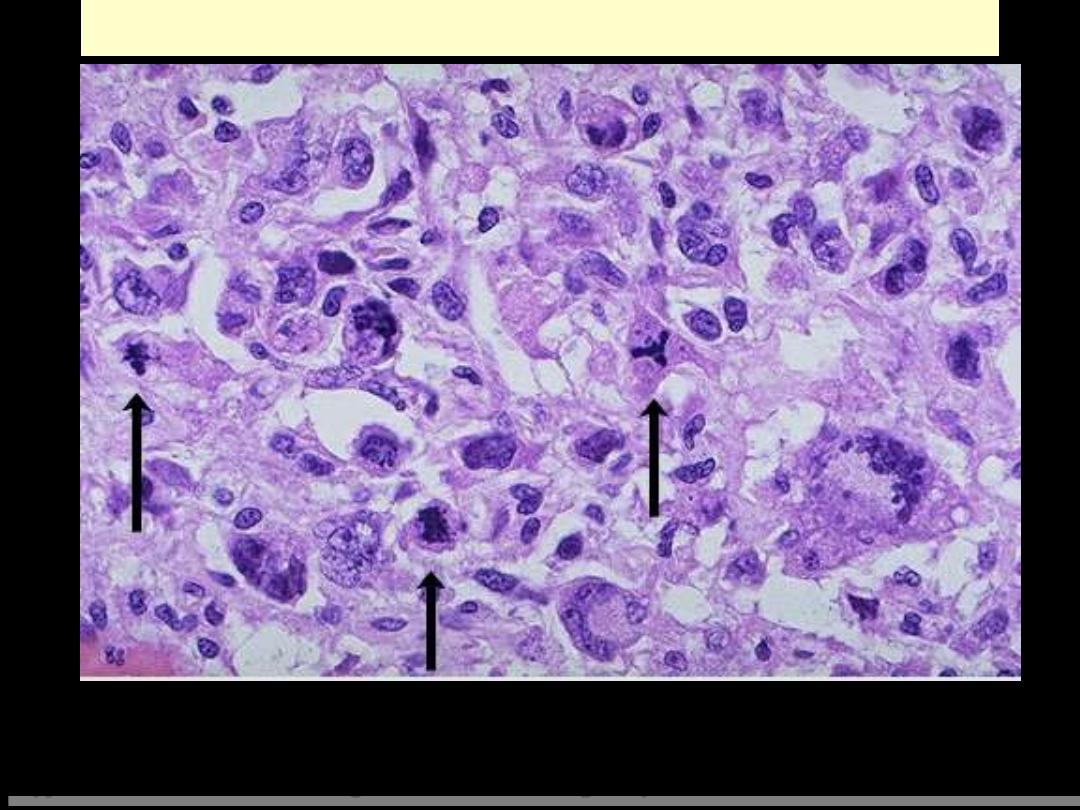
ABNORMAL MITOSES
Here are three abnormal mitoses. Mitoses by themselves are not indicators of malignancy. However,
abnormal mitoses are highly indicative of malignancy. The marked pleomorphism and
hyperchromatism of surrounding cells also favors malignancy.
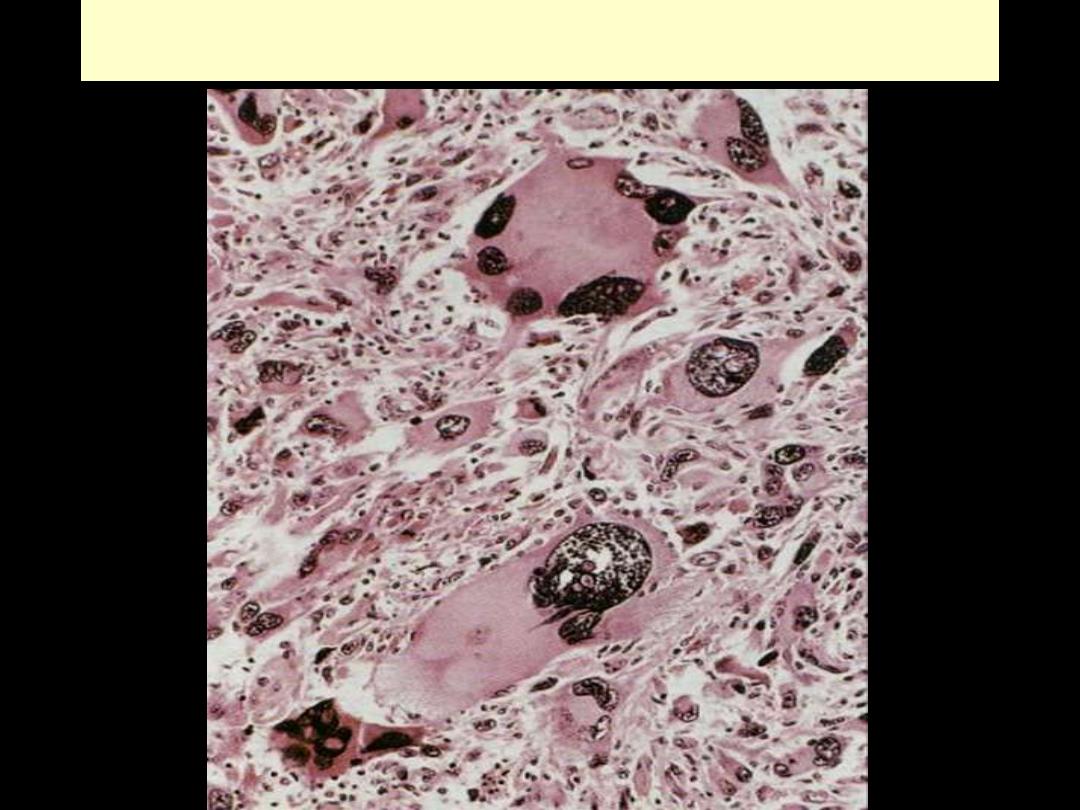
RHABDOMYOSARCOMA

DYSPLASIA
• “disordered growth.”
encountered principally in epithelial
T
membranes
ppally in
epithelial
(e.g. the squamous epithelium of the cervix, skin, and
bronchial mucosa) characterized by
1.
Pleomorphism
2.
Loss of polarity
3.
Nuclear Changes
a. hyperchromasia
b. ↑N/C
c. ↑Mitotic figures:
- Almost invariably normal
- Frequently appear in abnormal locations
• Mild/moderate/severe
CIS
invasion
•
Dysplastic changes often found adjacent to foci of invasive ca
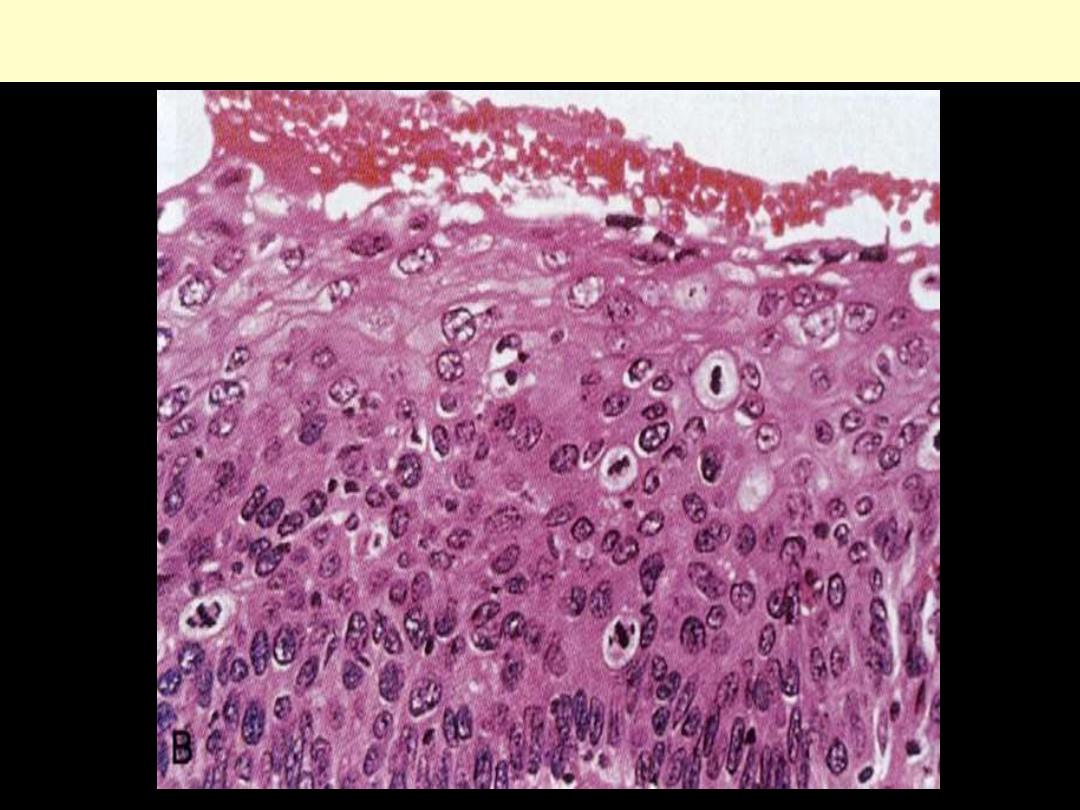
Cervix uteri severe dysplasia amounting to carcinoma in situ

II. GROWTH RATE OF THE TRANSFORMED CELLS
The growth rate of neoplasms (i.e. how rapidly they increase in size)
influences not only their clinical outcome but also their response to
therapy.
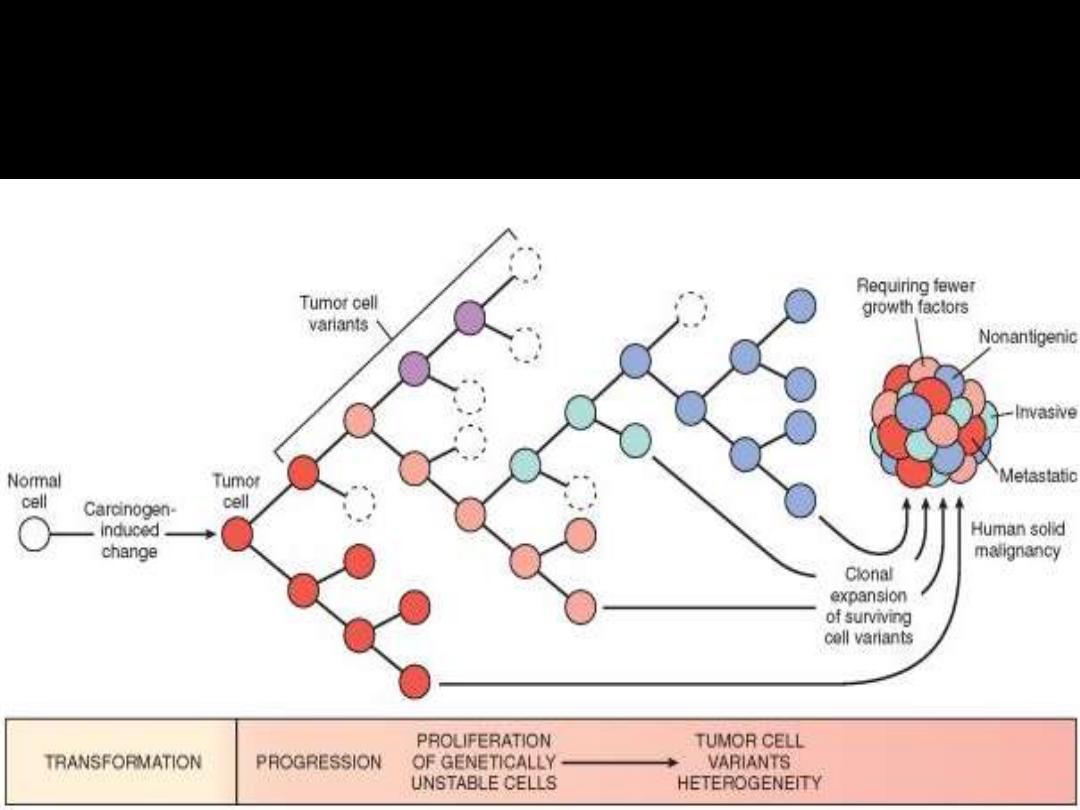
Any neoplasm is now considered clonal i.e. originating from one (or at
most few) initially transformed cells (I-TC).
For the tumor to be clinically detectable (at least 1 g in wt), the I-TC and
its progeny (collectively referred to as tumor cell population) must
undergo at least 30 population doublings.
Further 10 population doublings; however, are required to produce a
mass with a maximal size compatible with survival (a weight of 1 Kg).
These calculations mean that by the time a solid tumor is clinically
detected (at least 1 g in wt); it has already completed a major portion
(75%) of its life cycle.
The larger the cancer, the more difficult it becomes to treat and control.
Accordingly, diagnostic investigations are needed to detect early cancers
& this is the prime goal of screening programs e.g. that of the cervix (Pap
smear) & breast (mammography).
II. GROWTH RATE (GR) OF TRANSFORMED CELLS
• GR influence
Clinical outcome
Responses to therapy
• Neoplasm originates from
ITC
(Clonal)
1/4 life cycle
3/4 of life cycle
• The larger the T, the more difficult to treat/control
• SCREENING PROGRAMS DETECT EARLY CANCERS
Divisions X 30
detectable (1 g)
Max size (1 Kg)
Divisions X10
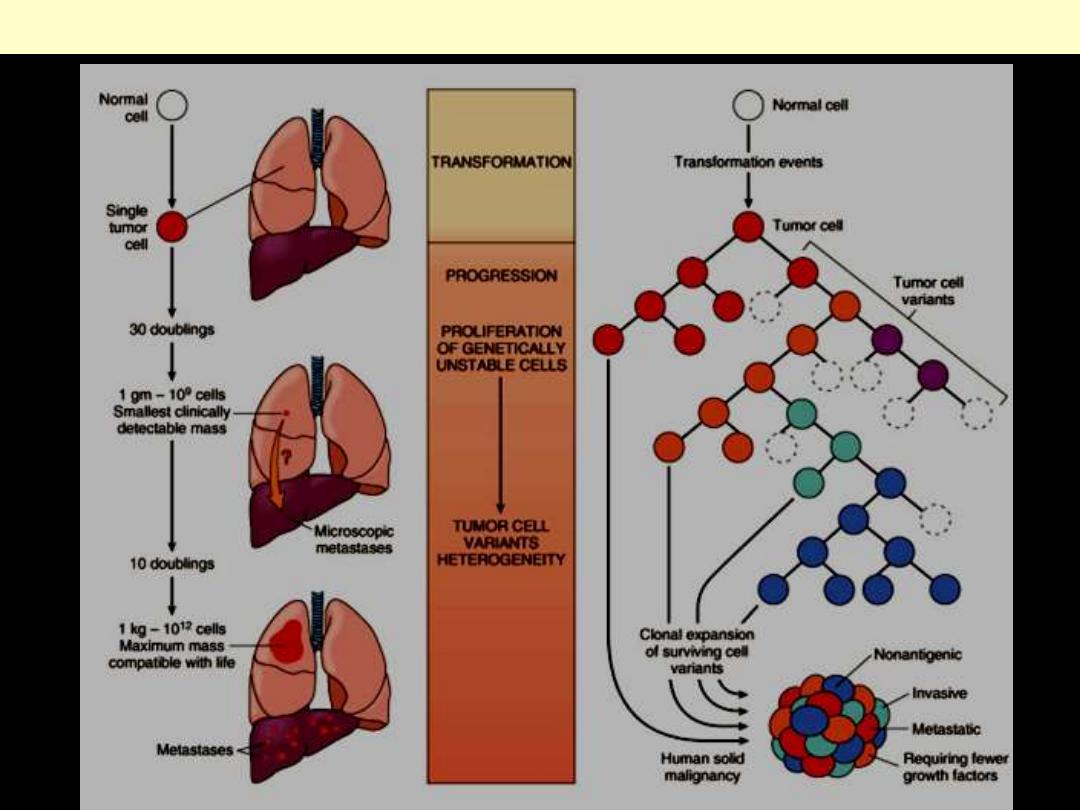
Biology of tumor growth and evolution

The cell-cycle controls are disturbed in most neoplasms and
this leads to an increase in the number of cells that enter into
the replicative pool.
The size of the replicative pool relative to the total size of the
tumor is referred to as the
growth fraction
because this
fraction is the prime determinant of tumor expansion.
Thus, a tumor with a large growth fraction grows more
rapidly than that with a small one.
Commonly, the growth of tumors is not due to a shortening of
cell-cycle time but because more cells enter into the replicative
pool of the cell cycle.
Studies suggest that during the early phase of tumor growth,
the vast majority of transformed cells are in the replicative
pool.

GR determined by
1. Doubling time of tumor cells (length of cell cycle)
2. Fraction of cells in replicative pool (dividing cells) (growth fraction)
3. Rate of cell loss
• Cell-cycle controls deranged in neoplasia
↑↑ cells enter
replicative pool
- Growth of most tumors due to
> cells entering replicative pool
• During early stages:
most transformed cells are in replicative pool
• As growth continues:
>
cells leave proliferative pool
1. Shedding
2. Lack of Blood (O
2
+ nutrients)
3. Apoptosis
4. Differentiation
5. Reversion to G0

Ultimately the rate at which a neoplasm grows is
determined by an excess of cell production over cell
loss.
Some leukemias, lymphomas and small cell
undifferentiated carcinomas
, have a high growth
fraction, and their clinical course are, therefore, rapid.
By comparison, many common tumors such as cancers
of the
colon and breast
have low growth fractions, and
cell production exceeds cell loss only marginally; that is
why they tend to grow relatively slowly.
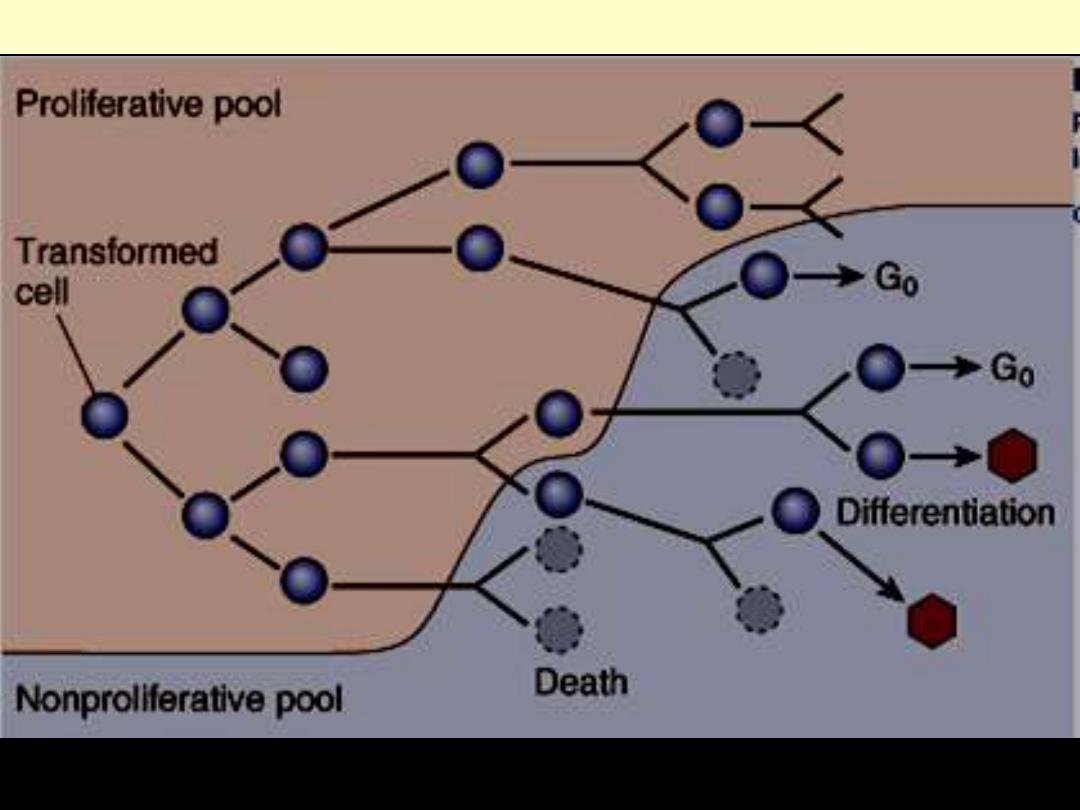
As the cell population expands, a progressive higher percentage of tumor cells leaves the replicative
pool by reversion to G
0
, differentiation and death.
Schematic representation of tumor growth
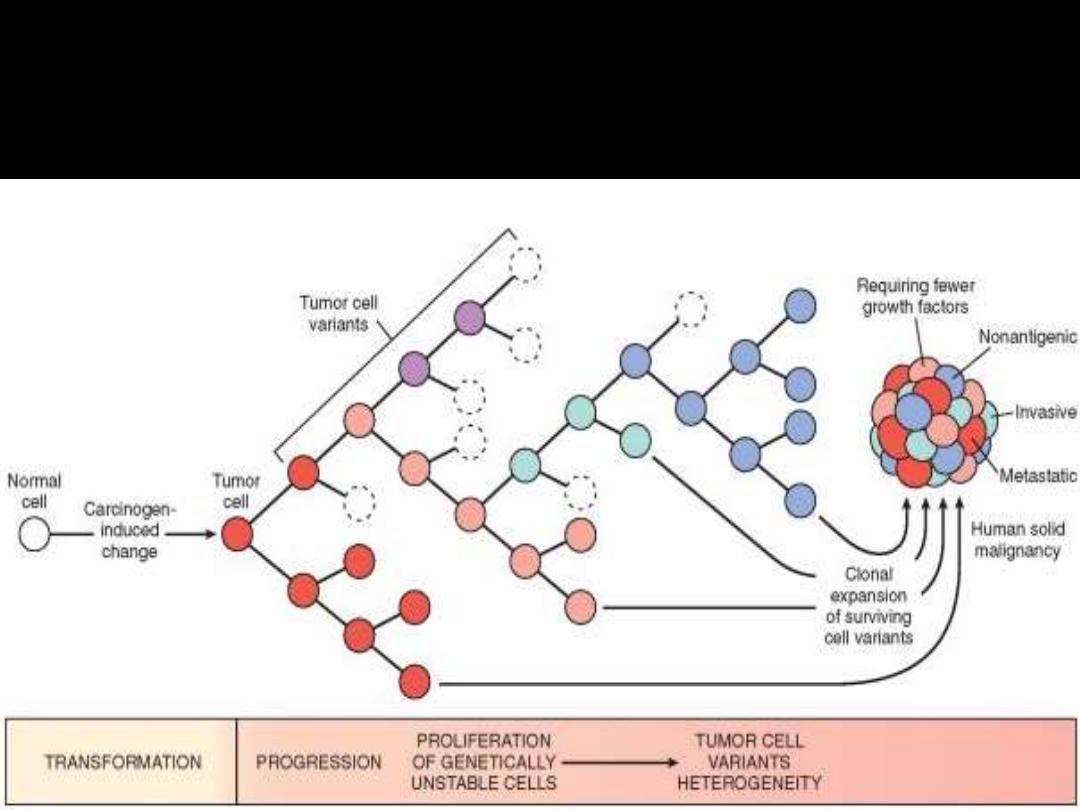
Multistep carcinogenesis

• Ultimate GR determinant:
excess of cell production over cell loss
• By time tumor detectable;
most cells left replicative pool
(
GF 20%)
- Tumors with large GF
*
Rapid course
- Tumors with small GF
**
Slow course

Practical lessons deduced from studies of tumor cell kinetics
1. Fast-growing tumors:
have a high cell turnover
-
High rates of proliferation & apoptosis
- Rate of proliferation > rate of apoptosis ↑↑tumor growth
2. Growth fraction
a determinant of susceptibility to chemotherapy
*
3. GR correlates inversely with level of differentiation
- most malignant Ts grow > rapidly than benign Ts
4. Factors affecting GR include
a. Hormonal stimulation b. Blood supply c. unknown influences
**
5. Cancers show wide variations of GR:
dedifferentiation phenomenon
CANCER STEM CELLS
• Cancer stem cell (T-IC)
mitoses
daughter cells (clonal)
• Stem cells
initiate & sustain tumor
• Cancer stem cells (T-IC)
- identified in breast cancers & AML
- constitute 1- 2% of cell population
- initial targets of neoplastic transformation
- have low rate of replication
- probably responsible for recurrence after treatment
Different./specialization
heterogeneous cells
III. LOCAL INVASION
Benign tumors
differ from malignant ones by the following
1. Grow as cohesive expansile masses
2. Remain localized to site of origin (no invasion or metastasis)
+ slow rate of growth
Rim of compressed CT (fibrous capsule)
Malignant tumors
characterized by
1. Progressive infiltration (invasion)/destruction of surrounding tissue
Makes surgical resection difficult
necessary to remove margin of apparently normal tissues adjacent
to cancer (margin of safety)
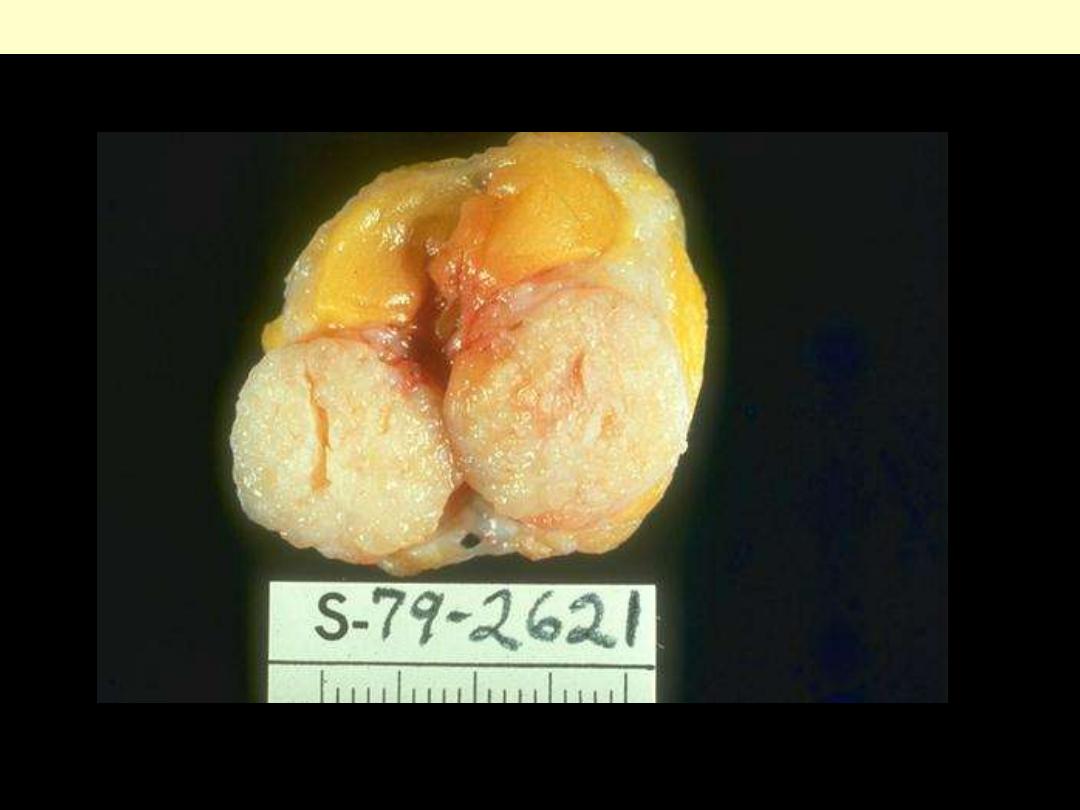
Sharply demarcated mass, about 3 cm in diameter. The cut surface is solid, grayish white.
Fibroadenoma Breast
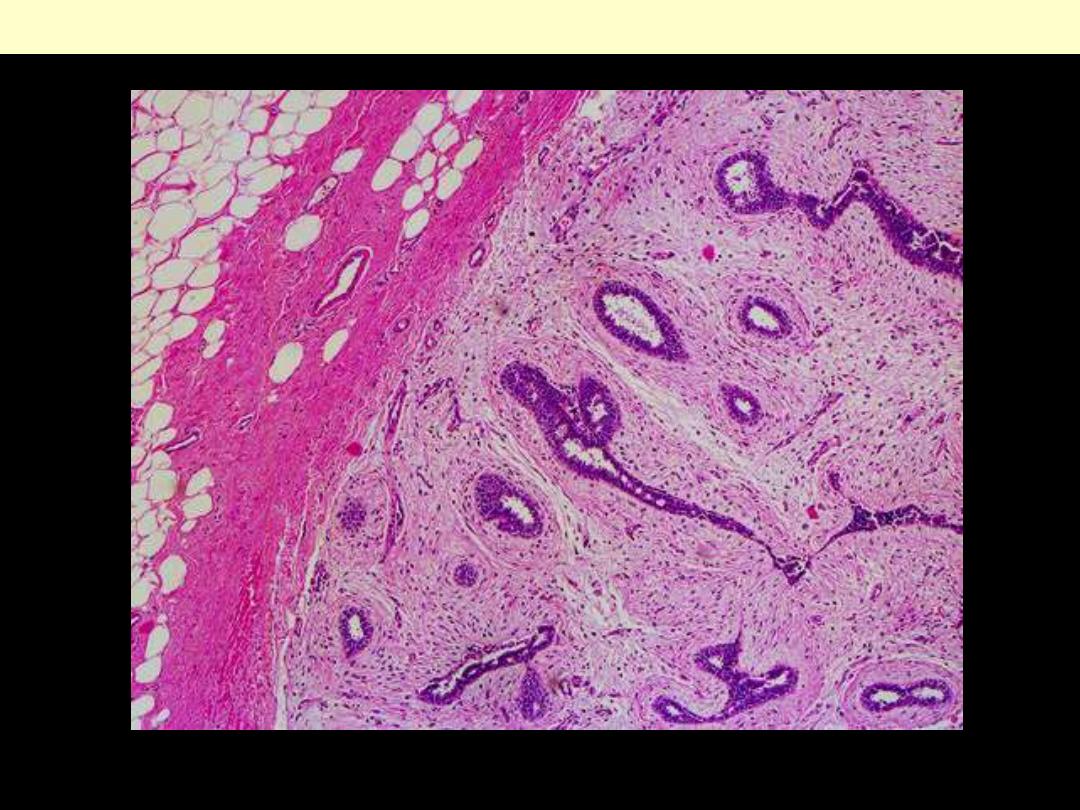
Well-defined fibrotic capsule surrounding the tumor. The latter consists of compressed ducts set within
fibroblastic stroma.
Fibroadenoma Breast
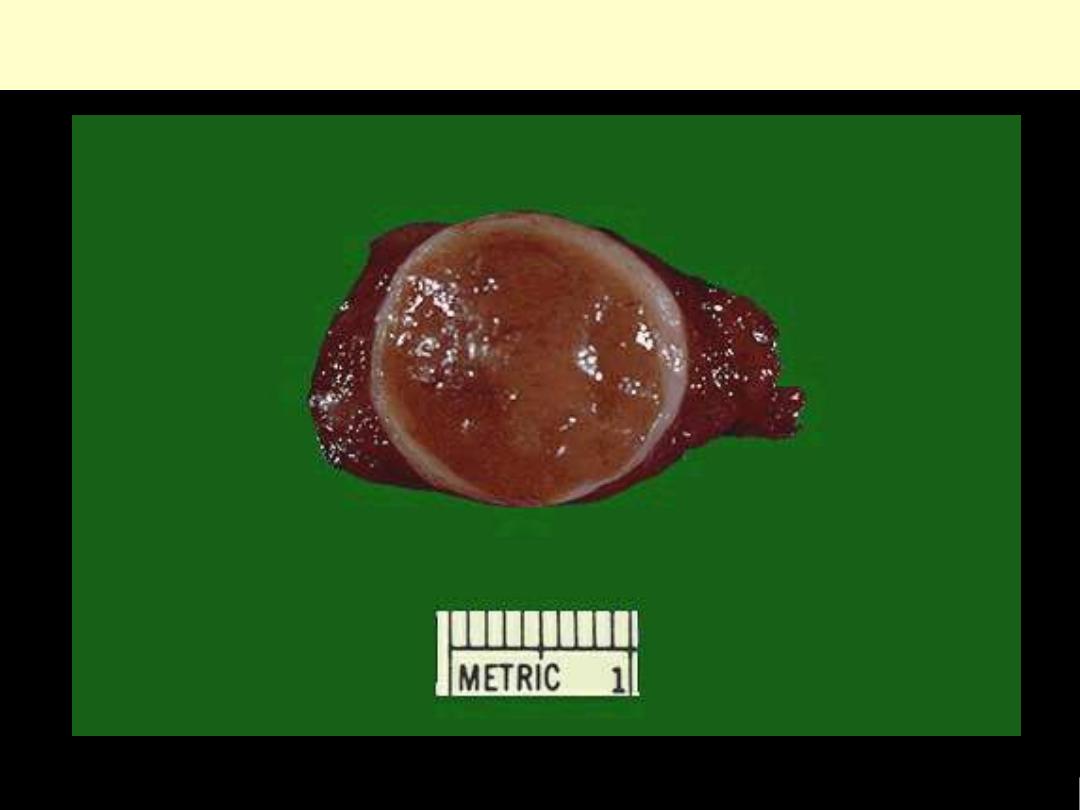
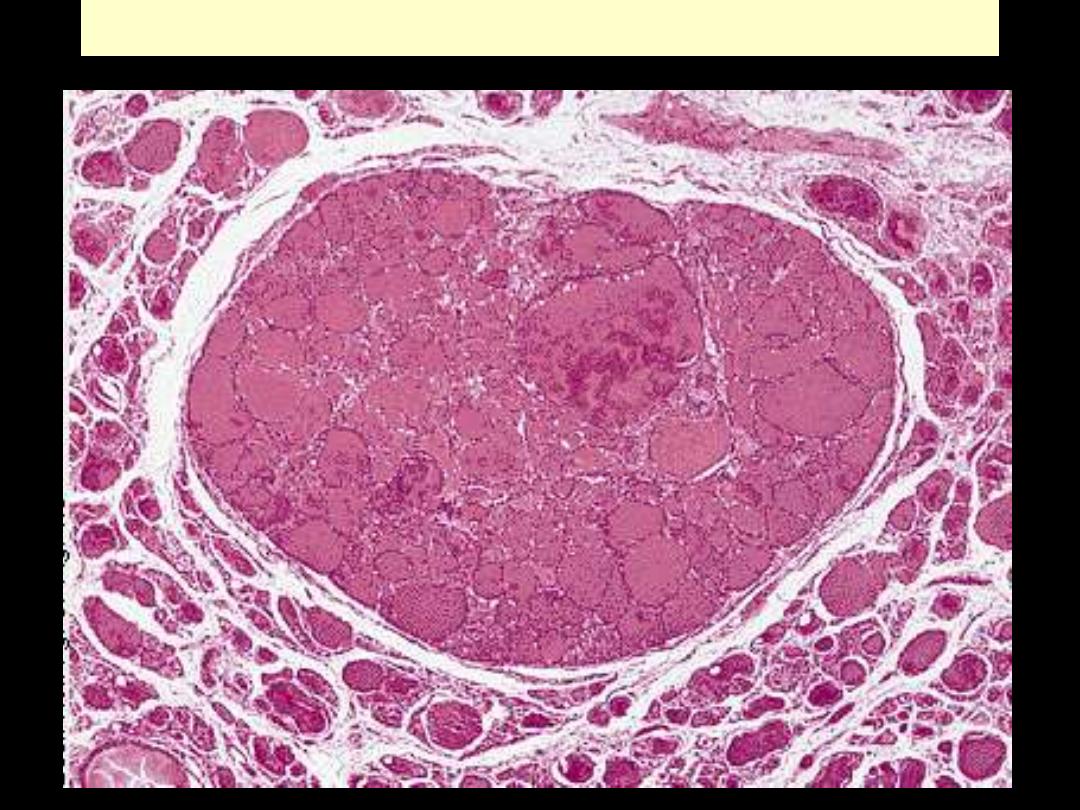
Follicular adenoma thyroid
This is a benign tumor of the thyroid gland. It is surrounded by a thin white capsule.
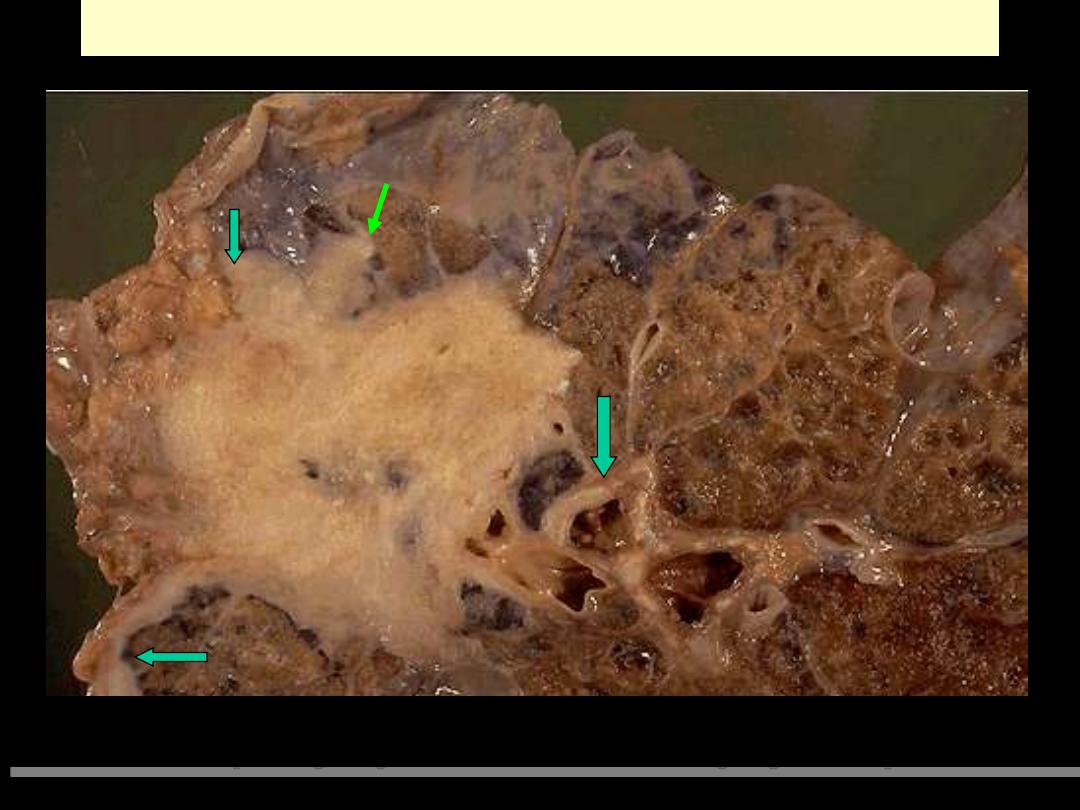
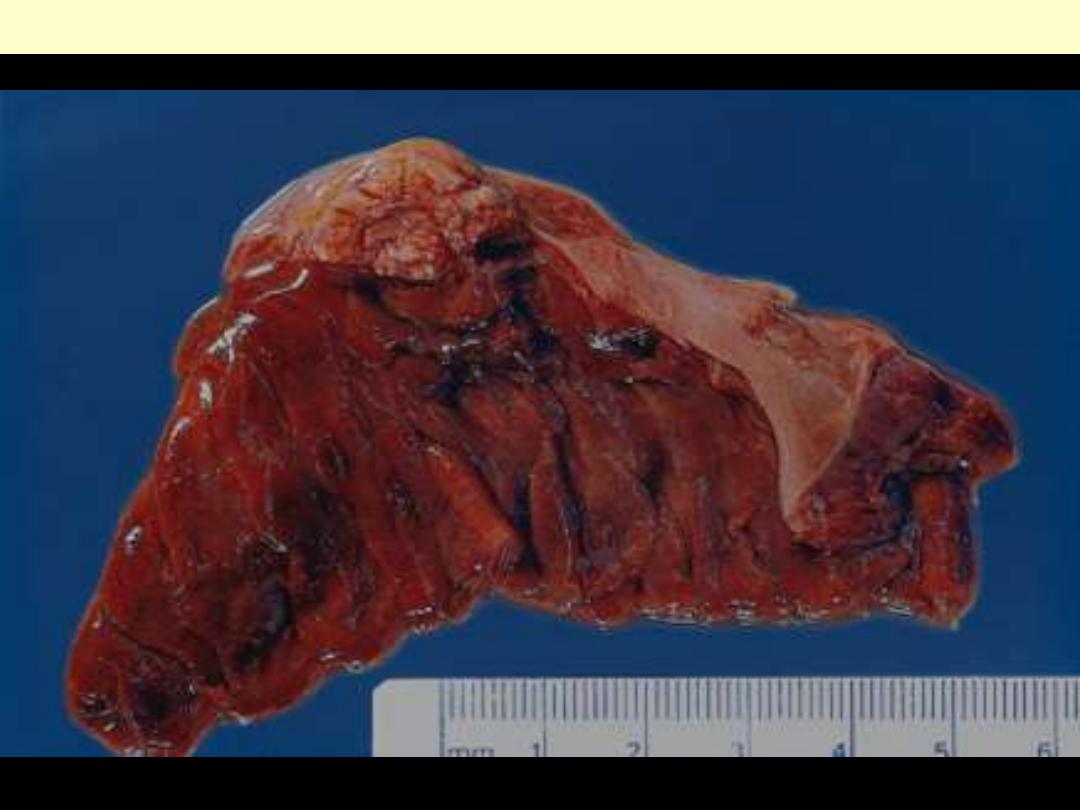
Carcinoma lung invasion
Malignant neoplasms are characterized by the tendency to invade surrounding tissues. Here, a lung
cancer is seen to be spreading along the bronchi into the surrounding lung tissues & pleura.
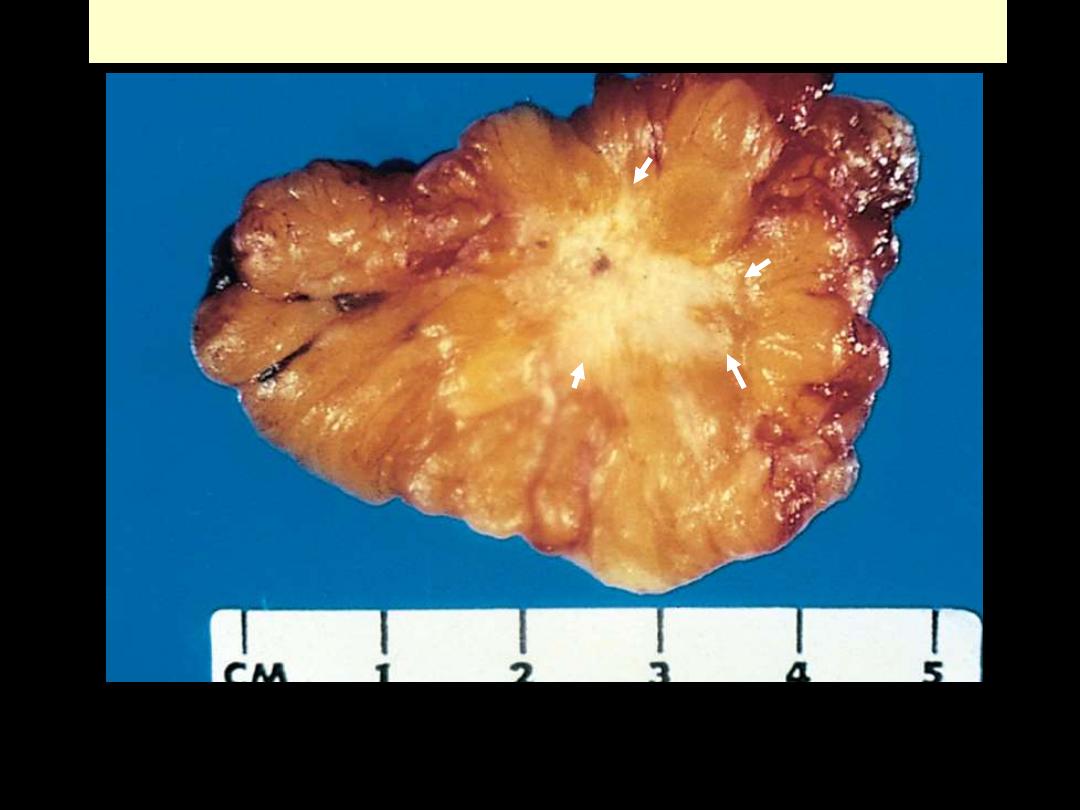
Ca breast invasion
This carcinoma of the breast is definitely infiltrating the surrounding breast. The central white area is
very hard in consistency and gritty on section, because the neoplasm is producing a desmoplastic
reaction with lots of collagen. This is often called a "scirrhous" appearance. There is also focal
dystrophic calcification leading to the gritty areas.
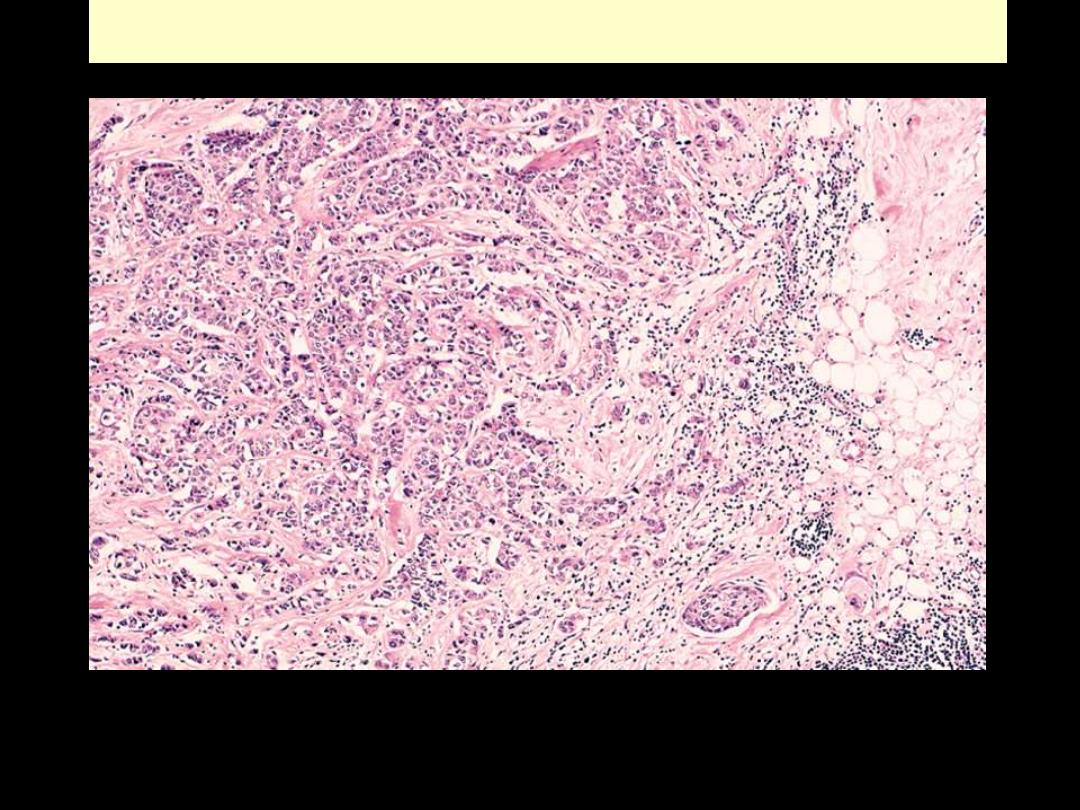
Ca breast invasion
On micrscopic examination, the infiltrating ductal carcinoma of the breast has pleomorphic cells
infiltrating through the stroma.
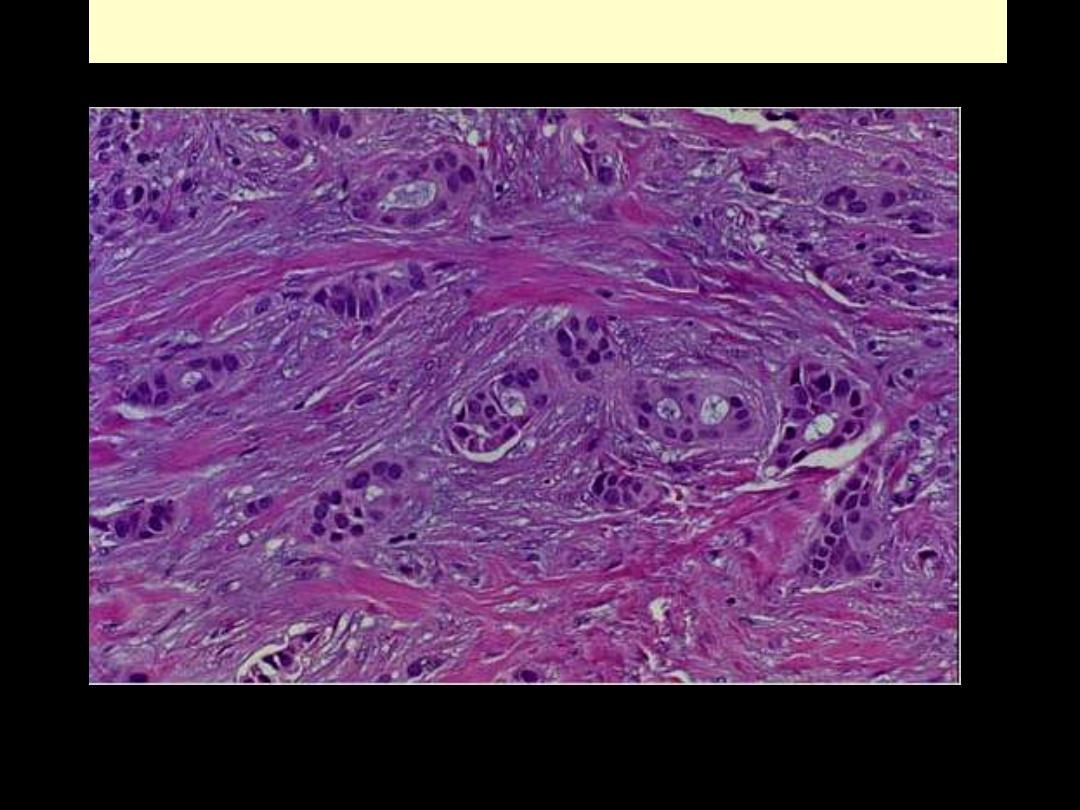
Ca breast invasion
On micrscopic examination, the infiltrating ductal carcinoma of the breast has pleomorphic cells
infiltrating through the stroma.

IV. METASTASIS
•
Metastases
:
“tumor implants discontinuous with primary tumor”
- The only definite criterion of malignancy
- The major exceptions are
1. Most malignant gliomas of CNS (derived from glial cells)
2. Basal cell carcinoma of the skin. (Rodent ulcer)
Cancers more likely to metastasize are
1. The more aggressive & more rapidly growing
3. The larger the size
•
Metastatic spread strongly reduces the possibility of cure
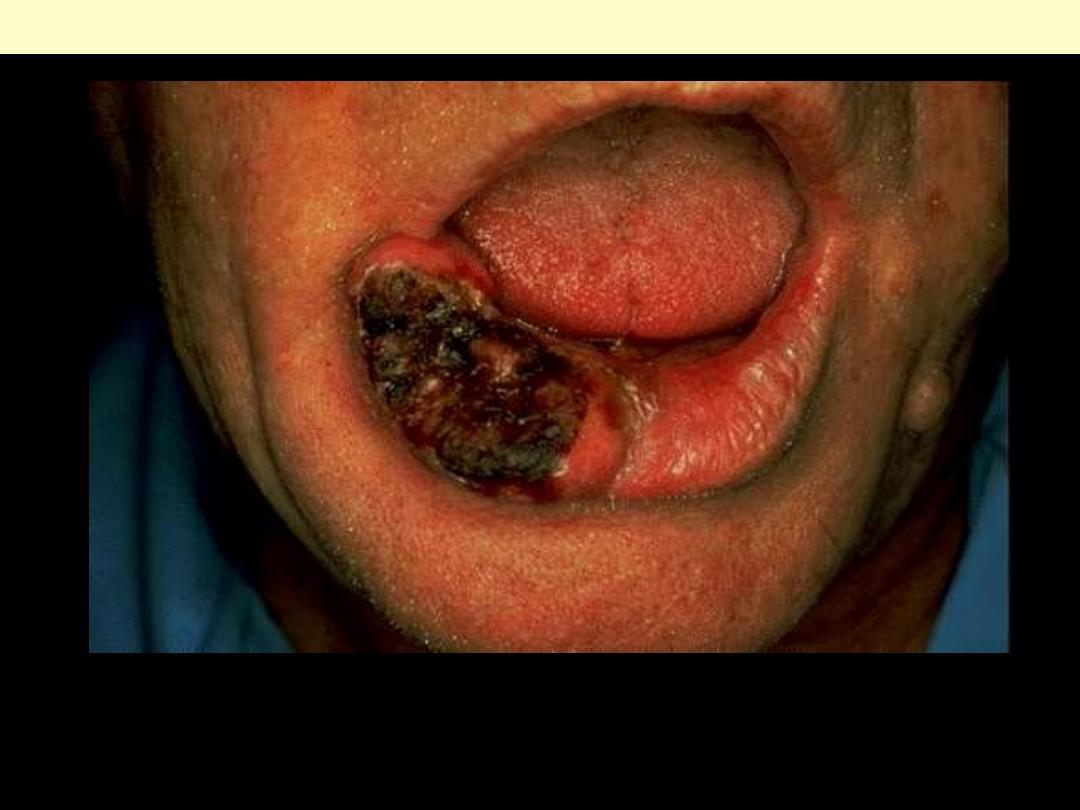
Basal cell carcinoma lower lip
These rarely metastasize, but are slow-growing and progressive over time. Leaving them to get larger
just makes the plastic surgeon's job much harder, with more disability to the patient, so early detection
and excision is a must. Most basal cell carcinomas occur in the head and neck area of adults with
prolonged sun exposure.

• The invasiveness of cancers permits penetration into
1. Blood vessels
2. Lymphatic vessels
3. Body cavities
Pathways of Spread
• Dissemination of cancers may occur through one of three
pathways:
1. Direct seeding of body cavities or surfaces
2. Lymphatic spread
3. Hematogenous spread
Seeding of Body Cavities and Surfaces
• Occurs when cancer penetrates into a natural "open field."
Peritoneal cavity/pleural/ pericardial/ subarachnoid/joint space
• Peritoneal cavity
-
Seeding is characteristic of ovarian carcinomas
-
Mucus-secreting carcinomas of appendix
pseudomyxoma
peritonei
•
pleural cavity
involved by lung carcinoma, Br. Ca etc.
Pouring of exudates (malignant pleural effusion)
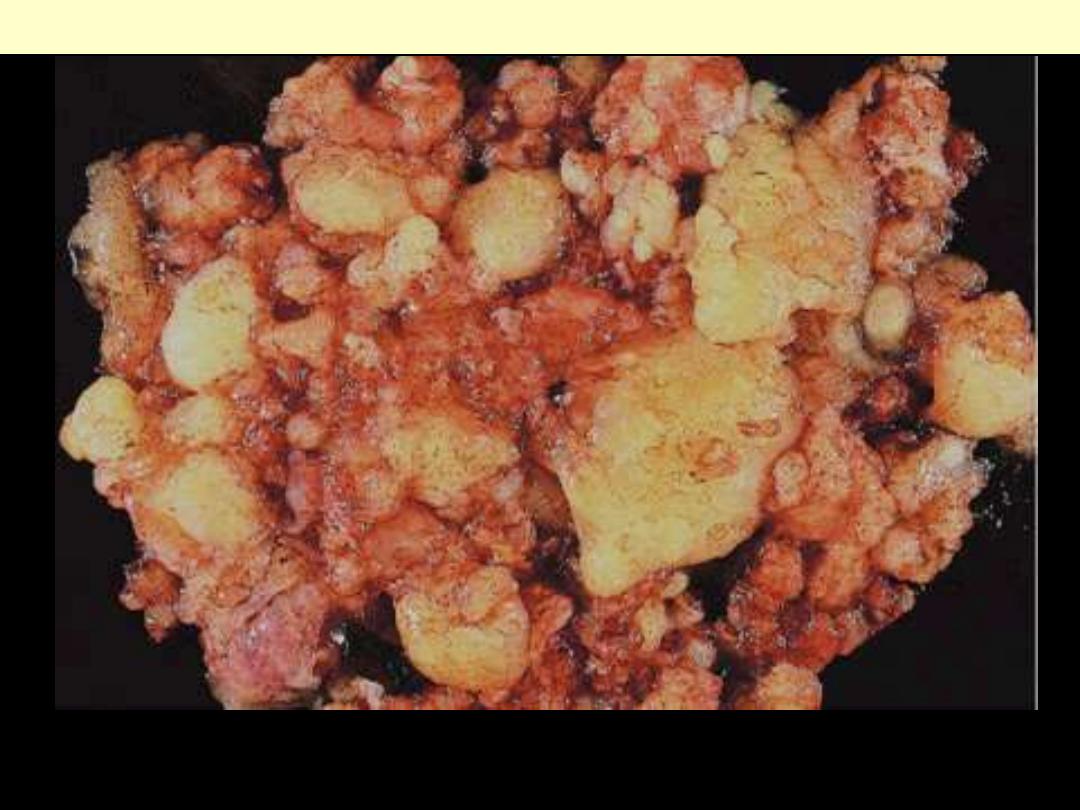
Pseudomyxoma peritonei
The entire peritoneal cavity is occupied by a multinodular mucinous mass
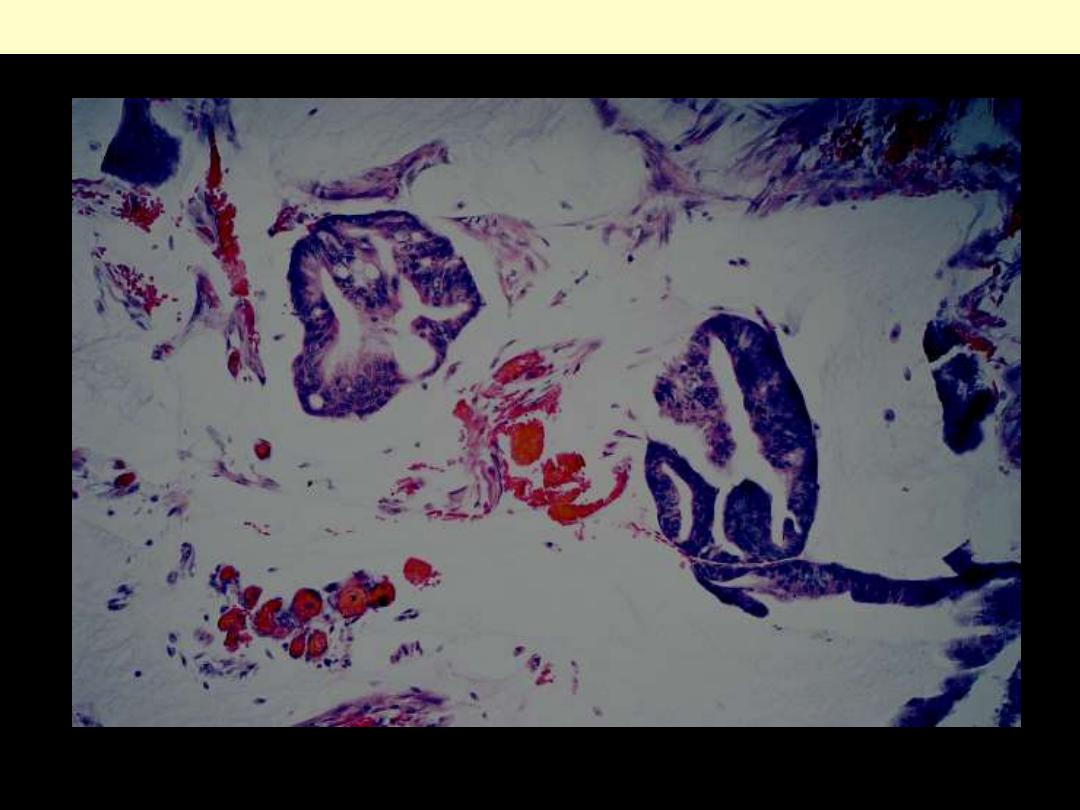
Pseudomyxoma peritonei
Clusters of well-differentiated mucin-producing glandular cells are seen floating in a sea of mucin.
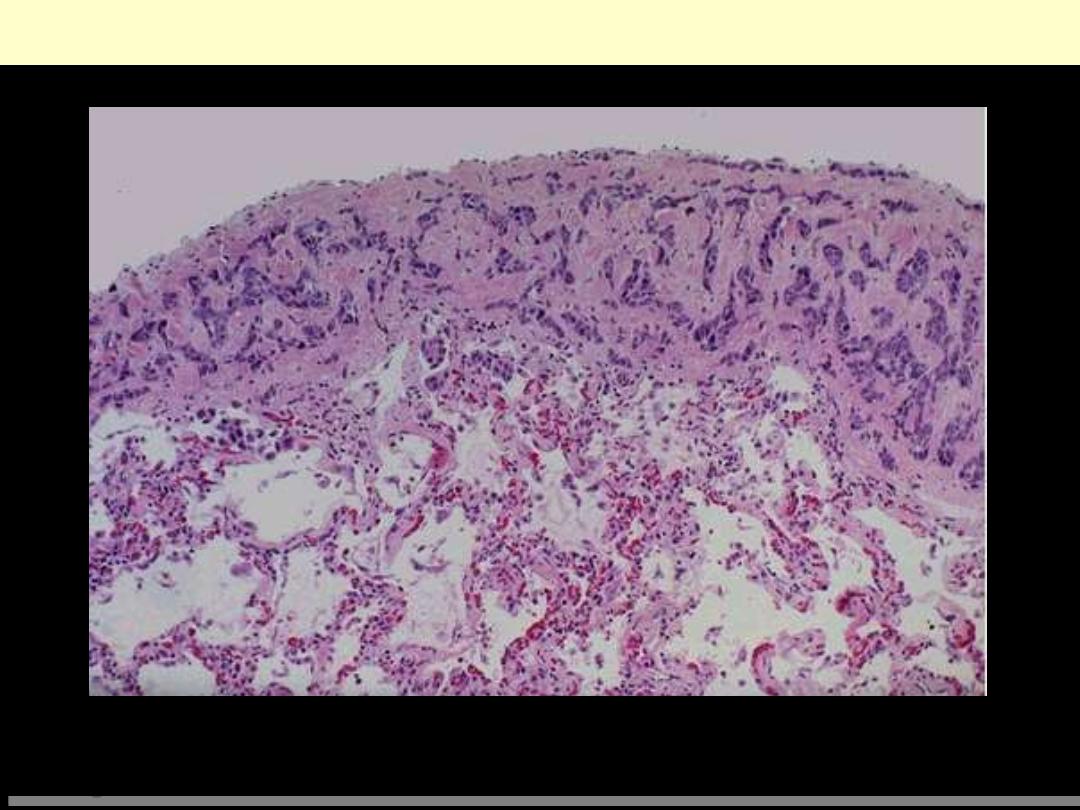
Metastatic breast carcinoma-pleura
Neoplasms can spread by seeding along body cavities, and this pattern is more typical for carcinomas
than other neoplasms. Here is a focus of metastatic breast carcinoma seen along the pleura overlying
the lung.
Lymphatic Spread
• Commonest pathway for initial spread of ca (some sarc.)
• LN involvement follows natural routes of lymphatic drainage
-
Br. Ca
usually in UOQ
axillary LNs.
- Br. Ca inner quadrants
LNs along internal mammary As
- Later
infra-clavicular & supra-clavicular nodes
-
Ca lung
tracheo-bronchial
mediastinal nodes
• Axillary LNs involvement in Br. Ca very important for
1. Assessing future course
2. Selecting suitable therapy.
- Assessment of LN involvement by
a. Full axillary LN dissection
morbidity
b. Sentinel node Bx
- also used for spread of melanomas, colon cancers, and others
- SLN "first node in a regional lymphatic basin that receives
lymph flow from primary tumor."
• Drainage of tumor cell antigens (no cells)
Reactive lymph node hyperplasia

• Enlargement of the regional nodes may be due to caused by either
1. The spread of cancer cells (metastasis) or
2. Reactive hyperplasia to tumor antigens
NODAL ENLARGEMENT NEAR A CANCER DOES NOT
NECESSARILY MEAN DISSEMINATION
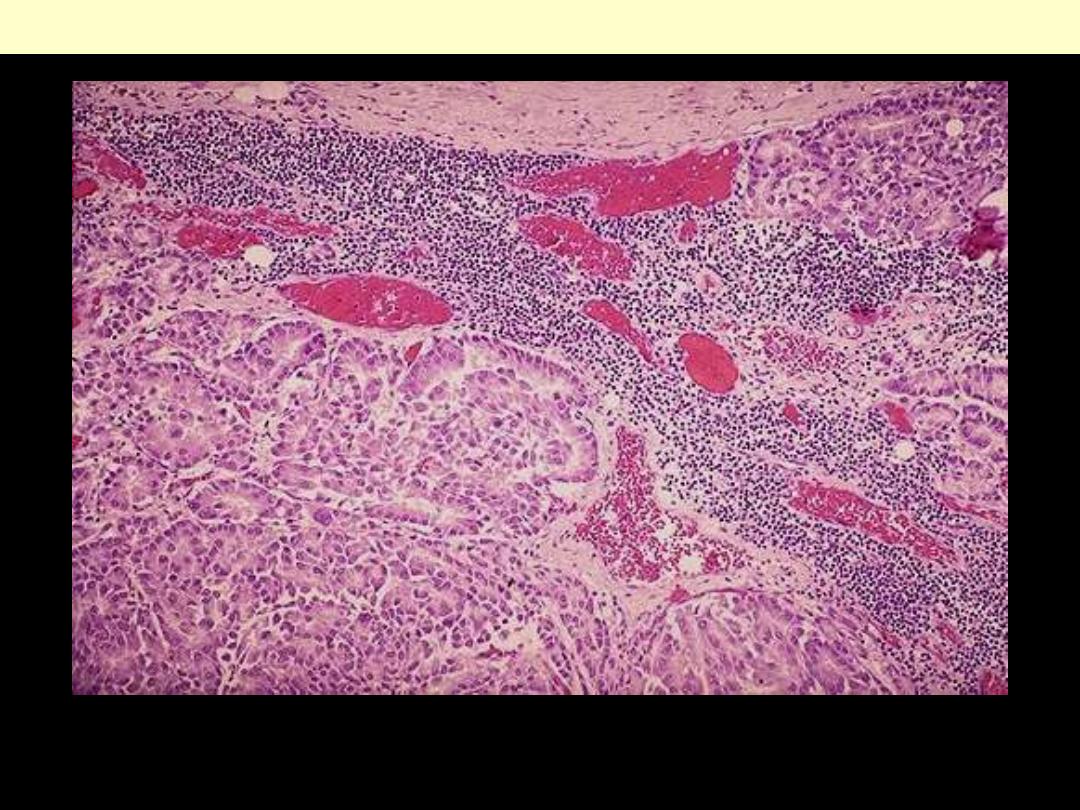
Microscopically, metastatic adenocarcinoma is seen in a lymph node here. It is common for carcinomas
to metastasize to lymph nodes. The first nodes involved are those draining the site of the primary.
Lymph node: metastatic adenocarcinoma
Hematogenous Spread
• Typical of sarcomas/ but seen with ca
• With venous invasion, spread follow venous flow draining site
• Liver & lungs most frequently involved by metastases
• Cancers close to vertebral column
Paravertebral plexus of veins
Vertebral (bone) metastases (ca thyroid/prostate)
• Certain cancers show remarkable tendency to invade veins
Renal cell ca
branches of the renal vein
Renal vein
IVC (snakelike fashion)
Rt. side of the heart

Hepatocellular carcinomas
portal and hepatic veins
main venous channels
•
Histologic evidence of penetration of small vessels at site of
primary neoplasm is ominous feature
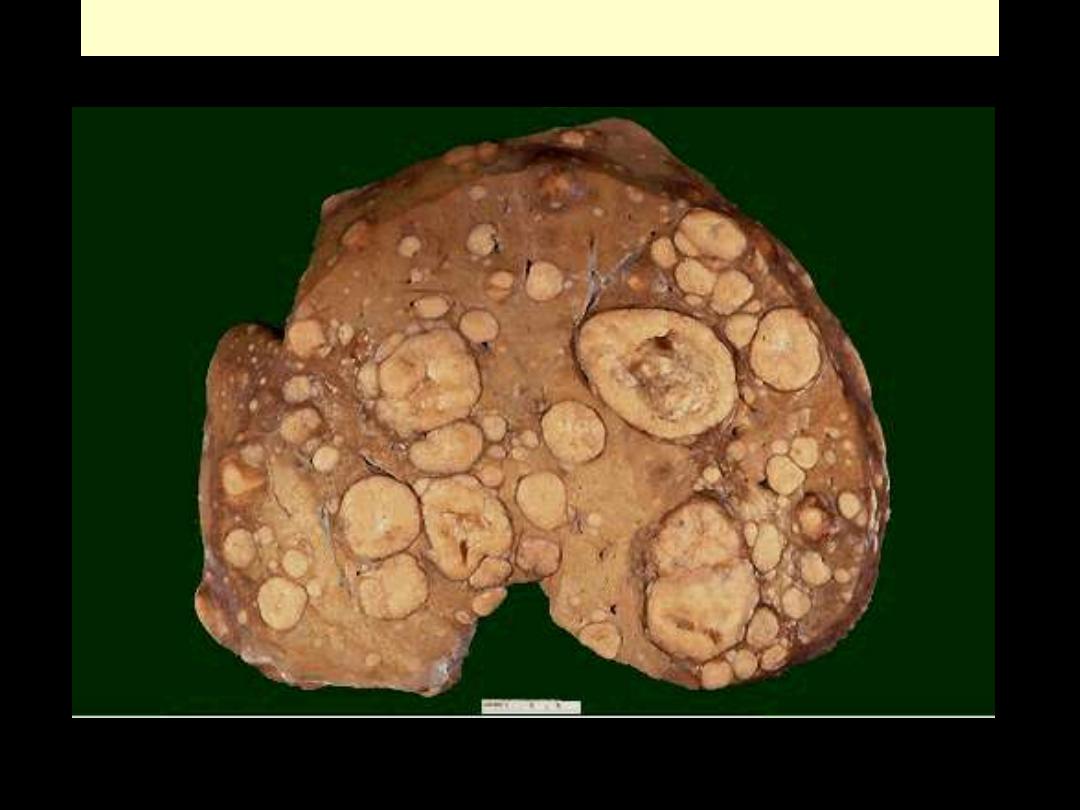
Liver metastases
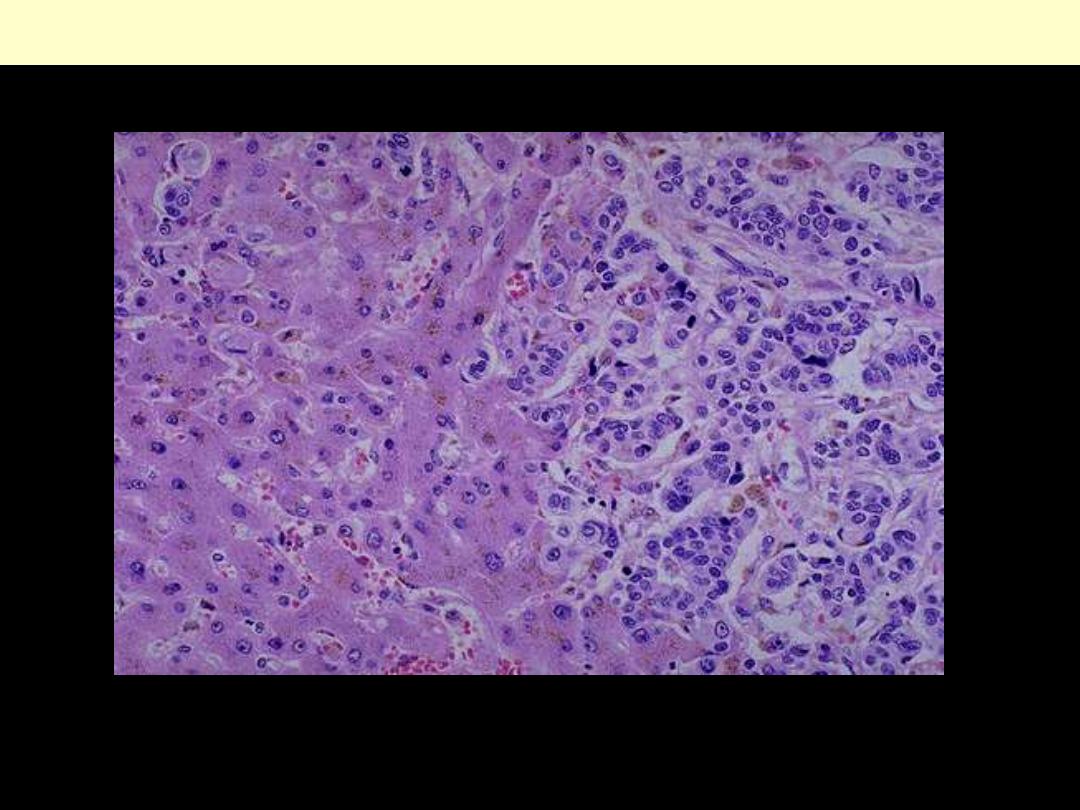
Liver metastasis by adenocarcinoma
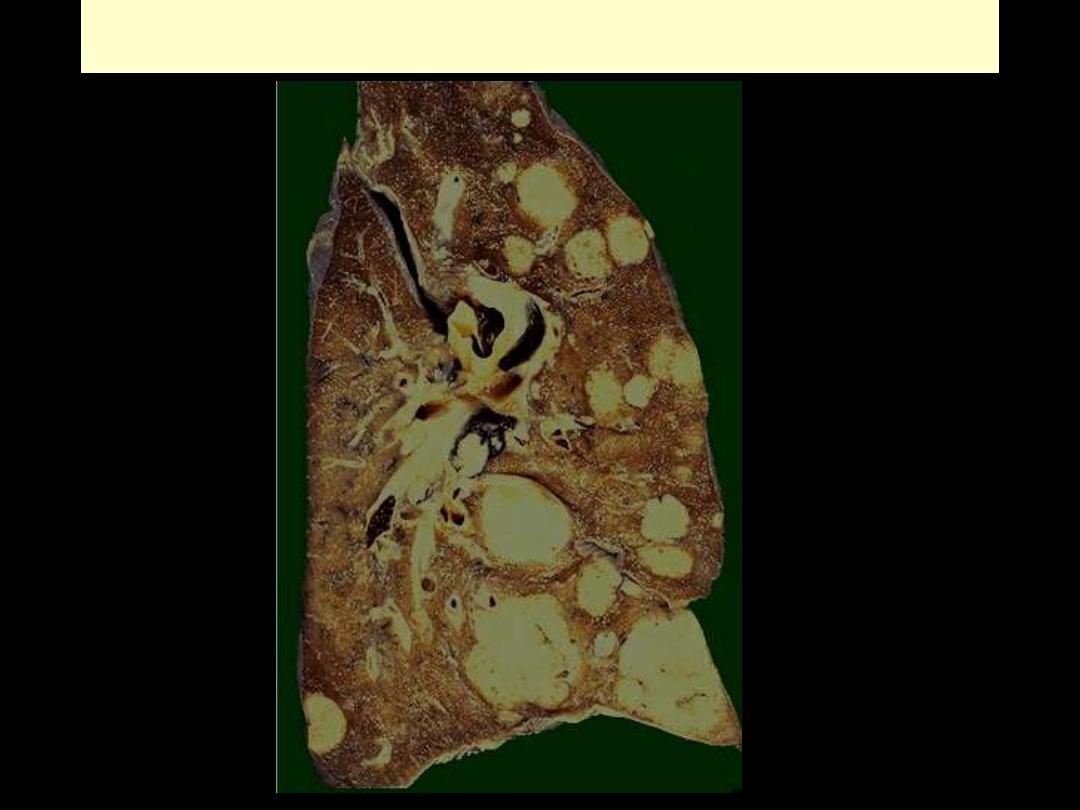
Pulmonary metastases
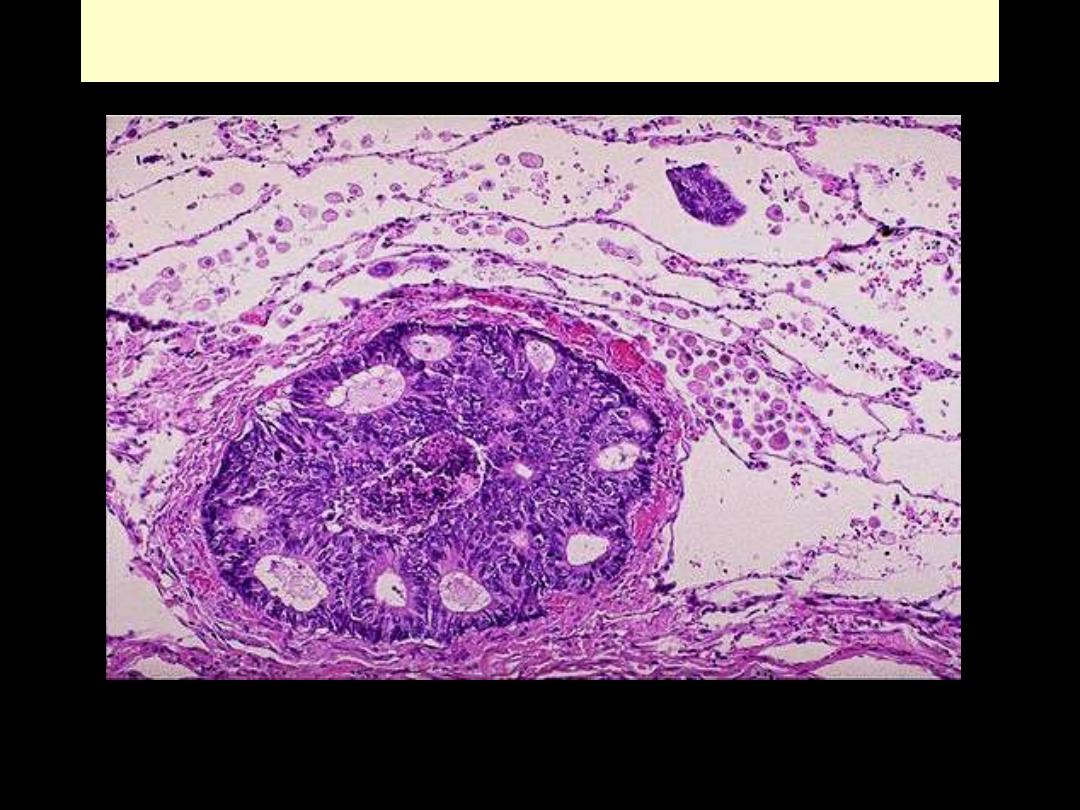
Metastatic adenocarcinoma lung

PRECANCEROUS CONDITIONS
• Conditions having ↑ risk of association with cancer
• Divided into two groups
A. Non-neoplastic conditions
; e.g.
1. Chronic atrophic gastritis
2. Actinic keratosis of skin
3. Chronic ulcerative colitis
4. Leukoplakia of oral cavity, vulva, and penis
5. Chronic viral B & C hepatitis
B. Benign neoplasms; e.g.
1. Villous adenoma of colon
*
2. Familial adenomatous polyposis (FAP) of colon
Host Defense against tumors—Immune Surveillance
• Normally, immune system inspects body for emerging malignant
cells to destroy them:
Immune Surveillance
• Strongest evidence for existence of IS:
↑frequency of cancers in
immunodeficient hosts
Congenital immunodeficiencies Acquired Immunodeficiences
(X200)
- transplant recipients
- AIDS
• Most neoplasms are lymphomas
•
Most cancers occur in immuno-competent persons:
mechanisms
developed by tumor cells to escape or evade immune system
1. Selective outgrowth of antigen-negative variants:
elimination of strongly immunogenic subclones
2. Loss/reduced expression of MHC molecules by tumor cells:
escaping attack by cytotoxic T cells.
3. Lack of costimulation:
- T-cells requires two signals to be sensitized
a. MHC molecules
b. Co-stimulatory molecules;
- failure to express costimulatory molecules
Prevents T-cell sensitization T cells anergy/undergo apoptosis
4. Immunosuppression:
through tumor products e.g. TGF-β,
secreted by many tumors (potent immunosuppressant
)

5. Antigen masking:
Surface antigens of tumors may be hidden from immune system
6. Apoptosis of cytotoxic T cells:
Melanomas/ HCC kill tumor- specific T lymphocytes encountering them
EFFECTS OF TUMORS ON THE HOST
• Neoplasms (Benign & malignant) may cause problems through
1. Physical progression
2. Functional activity
: hormone synthesis
3. Bleeding & infections
: ulceration through adjacent surfaces
4. Acute symptoms
: rupture/infarction
•
Metastases may produce same complications
•
Cancers may also produce
5. Cachexia
6. Paraneoplastic syndromes
Local and Hormonal Effects
• GIT tumors
Obstruction
Intussusception
*
• Tumors with critical locations e.g.
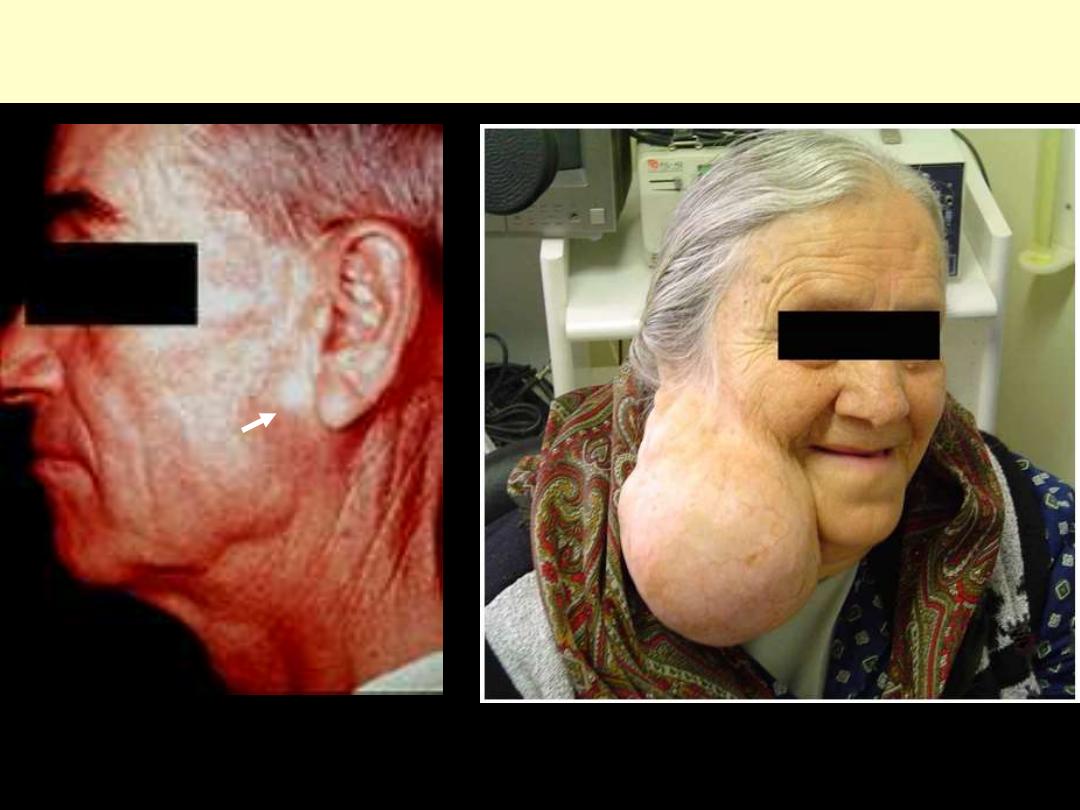
Pituitary adenoma:
enlargement/expansion
destruction remaining gland
panhypopituitarism
• Tumors of endocrine glands may be functional
-
A benign β-cell adenoma of pancreatic islets ↑↑insulin
fatal hypoglycemia
- Nonendocrine tumors may produce hormone-like substances
Paraneoplastic syndromes

•
Destructive growth of cancers/expansile pressure of benign
tumor on skin/mucosa of bronchi/ GIT/bladder
1. Ulcerations/secondary infections
2. Bleeding: hemoptysis/melena/hematuria

Cancer Cachexia
• Loss of weight + weakness + anorexia + anemia
• ? Origin
- ↓intake of food + tumor parasitism + Action of TNF
**
+ ↑BMR
*
• Cancer cachexia
equal loss of fat and muscle (protein)
*

PARANEOPLASTIC SYNDROMES
• Manifestations not related to the physical presence of cancer (or its
metastases)
• Excluded are genuine endocrine cell tumors
• Occur in 10% of patients with malignancy
• Important to recognize because
1.
Frequent (10%)
2. may be the earliest manifestations of occult cancer
3. may be serious/sometimes fatal
4. may simulate clinically metastatic disease thus confuse management

The more common syndromes are
I. Endocrinopathies
1. Cushing syndrome
2. Inappropriate ADH secretion
3. Hypercalcemia
4. Hypoglycemia
5. Polycythemia
II. Nerve and Muscle Syndromes
: Myasthenia/neuropathies
III. Dermatologic Disorders
1. Acanthosis nigricans
2. Dermatomyositis

IV. Osseous, articular, and soft tissue Changes:
Hypertrophic
osteoarthropathy
V. Vascular and Hematologic Changes
1. Venous thrombosis
2. Nonbacterial thrombotic endocarditis
VI. Others
1. Nephrotic synd
2. Amyloidosis

ENDOCRINOPATHIES
Cushing syndrome
Small-cell carcinoma of lung ACTH or ACTH-like
substance
Pancreatic carcinoma
Neural tumors
Syndrome of inappropriate
antidiuretic hormone secretion
Small-cell carcinoma of lung;
intracranial neoplasms
Antidiuretic hormone or atrial
natriuretic hormones
Hypercalcemia
Squamous cell carcinoma of
lung
Parathyroid hormone–related
protein (PTHRP), TGF-α,
TNF, IL-1
Breast carcinoma
Renal carcinoma
Adult T-cell
leukemia/lymphoma
Hypoglycemia
Fibrosarcoma
Insulin or insulin-like
substance
Other mesenchymal sarcomas
Carcinoid syndrome
Hepatocellular carcinoma
Bronchial adenoma
(carcinoid)
Serotonin, bradykinin
Pancreatic carcinoma
Polycythemia
Gastric carcinoma
Renal carcinoma
Erythropoietin
Cerebellar hemangioma
Clinical Syndromes
Major Forms of Underlying
Cancer
Causal Mechanism
NERVE AND MUSCLE SYNDROMES
Myasthenia
Bronchogenic carcinoma
Immunological
Disorders of the central and
peripheral nervous system
Breast carcinoma
DERMATOLOGIC DISORDERS
Acanthosis nigricans
Gastric carcinoma
Immunological; secretion of
epidermal growth factor
Lung carcinoma
Uterine carcinoma
Dermatomyositis
Bronchogenic, breast
carcinoma
Immunological
OSSEOUS, ARTICULAR, AND SOFT-TISSUE CHANGES
Hypertrophic
osteoarthropathy and clubbing
of the fingers
Bronchogenic carcinoma
Unknown
VASCULAR AND HEMATOLOGIC CHANGES
Venous thrombosis (Trousseau
phenomenon)
Pancreatic carcinoma
Tumor products (mucins that
activate clotting)
Bronchogenic carcinoma
Other cancers
Nonbacterial thrombotic
endocarditis
Advanced cancers
Hypercoagulability
Red cell aplasia
Thymic neoplasms
Unknown
OTHERS
Nephrotic syndrome
Various cancers
Tumor antigens, immune
complexes
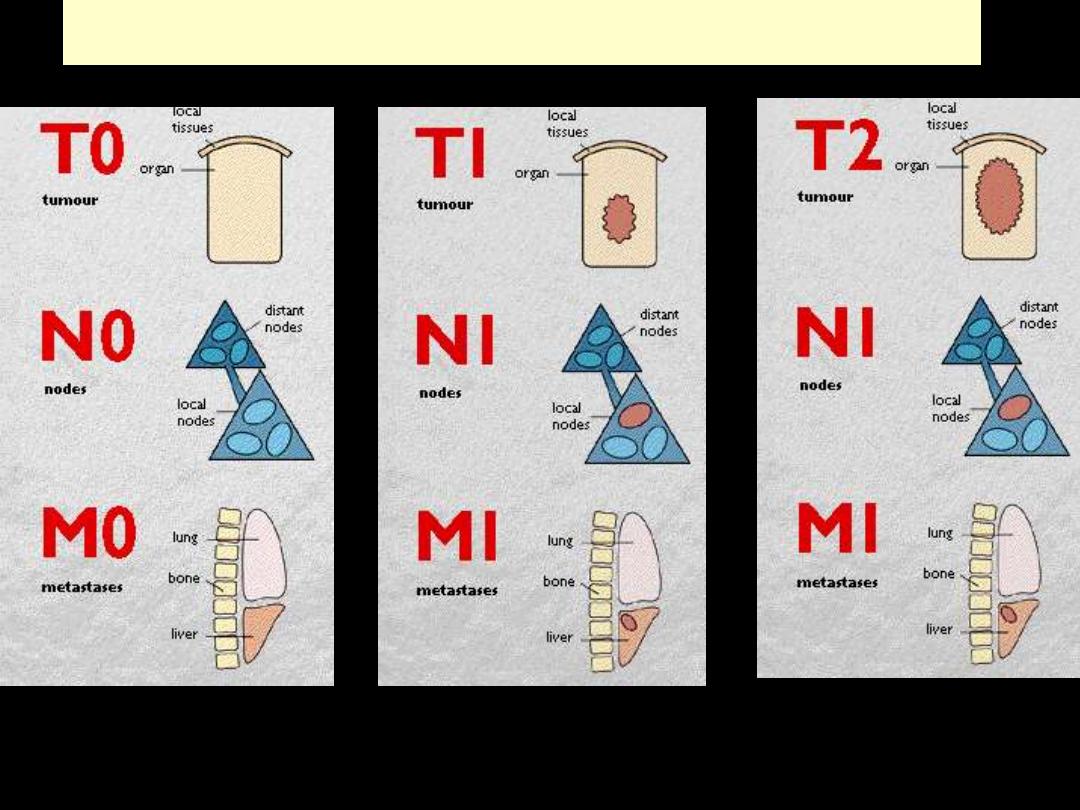
GRADING AND STAGING OF CANCERS
To assess prognosis & effectiveness of various forms of treatment
Separation of cancers into groups
each with members of high degree of similarity.
Systems of
grading &
staging
Reflecting seriousness of various cancers
Expresses degree of differentiation
+
Other micro. Features
- no. of mitoses
- Necrosis
Expresses extent of cancer spread
Grades 1 to 4
•
Staging is of great importance in selection of best therapy & has
proved to be of greater clinical value than grading.

• Staging of cancers is based on
1. Size of primary tumor
2. Extent of spread to regional LNs
3. Presence/absence of blood-borne metastases
• Two major staging systems in use
1. TNM (ICC
)
2. AJC on Cancer Staging.
•
The TNM varies for each specific form of cancer
General principles
- T1 to T4 with ↑size
- TIS (in situ)
- N0: no nodal involvement
- N1 to N3: involvement of an ↑number and range of nodes
- M0: no distant metastases,
- M1 or M2: presence of blood-borne metastases.
•
T
N
M

•The AJC: divides all cancers into
stages 0 to IV
, depending on
- Size
- Nodal spread
- Distant metastases.
TNM staging for ca breast

LABORATORY DIAGNOSIS OF CANCER
• Becomes more complex & specialized
• Several approaches to correct Dx
- Sometimes > than one approach employed
A. Histologic and Cytologic Methods
• Separating benign from malignant not usually difficult
- Difficulty is Dx of
borderline tumors
- Clinical data and surgical findings very useful

• Specimen delivered to lab must be
1. Adequate
2. Representative
3. Properly preserved
•
Several sampling approaches are available
1. Incisional or excisional biopsy specimen for
a. conventional histopathological diagnosis
b. frozen section diagnosis
2. Needle Biopsies
a. Fine needle aspiration material (cytology)
b. Needle-core biopsy material (histopathology)
3. Endoscopic biopsy material
4. Laparoscopic, or thoracoscopic biopsies
5. Cytologic smears from the tumor in question

• 1. Incisional biopsy
means that only a portion of the lesion is sampled, and therefore the
procedure is strictly of a diagnostic nature.
In excisional biopsies,
the entire lesion is removed, usually with a rim of
normal tissue, and therefore the procedure serves
both a diagnostic and
a therapeutic function.
When excision of the whole lesion is not possible, incisional biopsy is
performed, however, selection of an appropriate site for a biopsy of a
large mass by the surgeon requires awareness that the margins of the
lesion may not be representative and its center may be largely necrotic.
Requesting an intra-operative "quick-frozen section
" diagnosis is
sometimes desirable, for example,
in determining the nature of a mass
lesion or in evaluating the margins of an excised cancer to ascertain
that the entire neoplasm has been removed.
This method permits histologic evaluation within minutes, while the
patient is still under anesthesia. The results in such cases will modify
the course of the surgical operation.
•

2. Needle biopsies
Fine-needle aspiration of tumors
During fine-needle aspiration, a long, thin needle is inserted into the
suspicious area.
A syringe is used to draw out fluid and cells for analysis.
The material is then spread on a slide, stained and then examined for the
evaluation of the mass.
Core needle biopsy
A wide-bore needle with a cutting tip is used to draw a thin core of tissue
(the size of a match stick) out of a suspicious area.
The tissue obtained is processed to obtain histological sections for
evaluation.
Image-guided biopsy
combines an imaging procedure, such as X-ray,
computerized tomography (CT) or ultrasound, with a needle biopsy.
Image-guided biopsy allows access to suspicious areas that cannot be felt
through the skin, such as a suspicious lesion of the
liver or prostate.
Through the use of images, it possible to be sure that the biopsy needle
reaches the correct spot.

Multistep carcinogenesis

•
The
most commonly used method to determine tumor
clonality involves the analysis of methylation patterns
adjacent to the highly polymorphic locus of the human
androgen receptor gene, AR. The frequency of such
polymorphisms in the general population is more than 90%,
so it is easy to establish clonality by showing that all the
cells in a tumor express the same allele. For tumors with
acquired cytogenetic aberrations of any type (e.g., a
translocation) their presence can be taken as evidence that
the proliferation is clonal. Immunoglobulin receptor and
T-cell receptor gene rearrangements serve as markers of
clonality in B- and T-cell lymphomas, respectively.

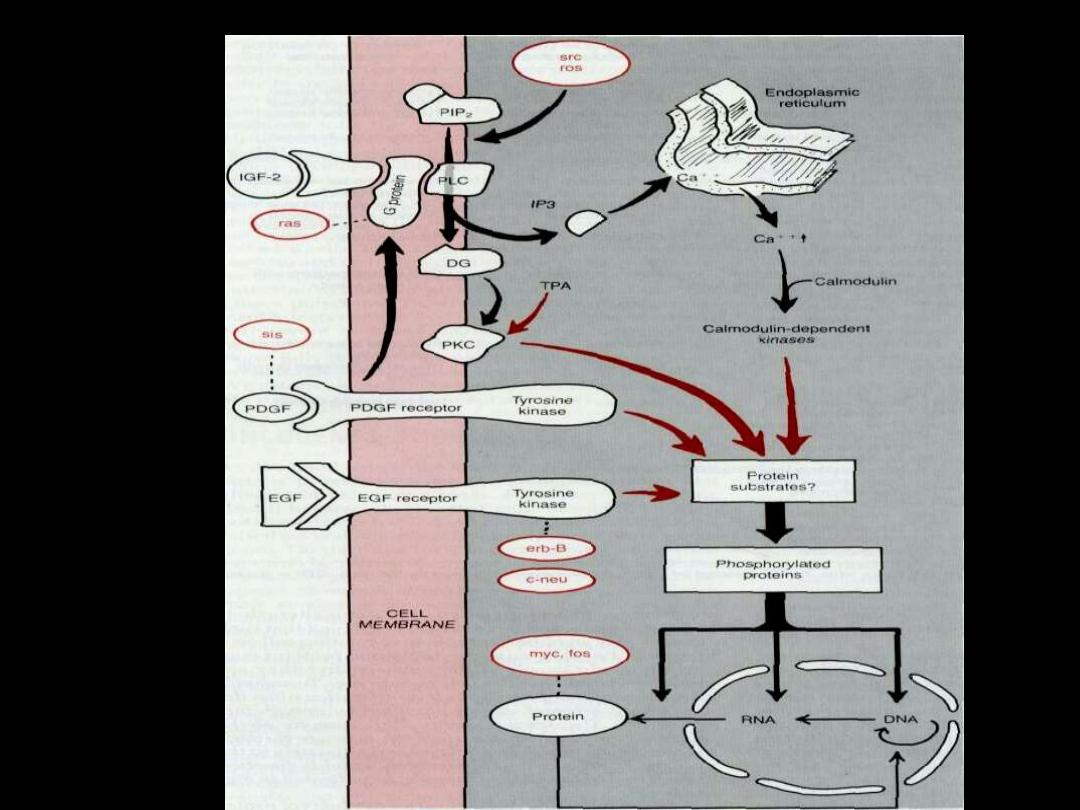
The sequence of events in normal
cell growth
1. The binding of growth factor to its receptor.
2. transient & limited activation of this complex
leads to activation of signal trasducing proteins.
3. Transmission of the signal via second
messengers.
4. Induction & activation of nuclear regulatory
factors that initiate transcription.
5. Entry & progression in the
cell cycle.