
1
Fifth stage
Ophthalmology
Lec-2
.د
نزار
30/11/2016
The lens and cataract
Introduction
The lens is biconvex and transparent. It is held in position behind the iris by the suspensory
ligament whose zonular fibers are composed of the protein fibrillin which attach its equator
to the ciliary body. Disease may affect structure, shape and position.
Cataract
Opacification of the lens of the eye (cataract) is the commonest cause of treatable blindness
in the world. The large majority of cataracts occur in older age as a result of the cumulative
exposure to environmental and other influences such as smoking, UV radiation and elevated
blood sugar levels. This is sometimes referred to as age-related cataract. A smaller number
are associated with specific ocular or systemic disease and defined physico-chemical
mechanisms. Some are congenital and may be inherited.
Ocular conditions associated with cataract
1. Trauma Uveitis
2. High myopia
3. Topical medication (particularly steroid eye drops) Intraocular tumor
Systemic causes
1. Diabetes
2. Other metabolic disorders (galactosaemia, Fabry’s disease, hypocalcaemia)
3. Systemic drugs (particularly steroids, chlorpromazine) Infection (congenital
rubella)
4. Myotonic dystrophy Atopic dermatitis
5. Systemic syndromes (Down’s, Lowe’s) Congenital, including inherited, cataract
X-radiation
SYMPTOMS
An opacity in the lens of the eye:
Causes a painless loss of vision;
Causes glare;
May change refractive error.
In infants, cataract may cause amblyopia (a failure of normal visual development) because
the retina is deprived of a formed image. Infants with suspected cataract or a family history
of congenital cataracts should be seen as a matter of urgency by an ophthalmologist.

2
SIGNS
Visual acuity is reduced. In some patients the acuity measured in a dark room may seem
satisfactory, whereas if the same test is carried out in bright light or sunlight the acuity will
be seen to fall, as a result of glare and loss of contrast.
The cataract appears black against the red reflex when the eye is examined with a direct
ophthalmoscope (see pp. 29–30). Slit lamp examination allows the cataract to be examined
in detail and the exact site of the opacity can be identified. (Fig. 8.2).
INVESTIGATION
This is seldom required unless a suspected systemic disease requires exclusion or the cataract
appears to have occurred at an early age.
TREATMENT
Management remains surgical. ’The test is whether or not the cataract produces sufficient
visual symptoms to reduce the quality of life. Patients may have difficulty in recognizing faces,
reading or achieving the driving standard. Some patients may be greatly troubled by glare.
Patients are informed of their visual prognosis and must also be informed of any coexisting
eye disease which may influence the outcome of cataract surgery.
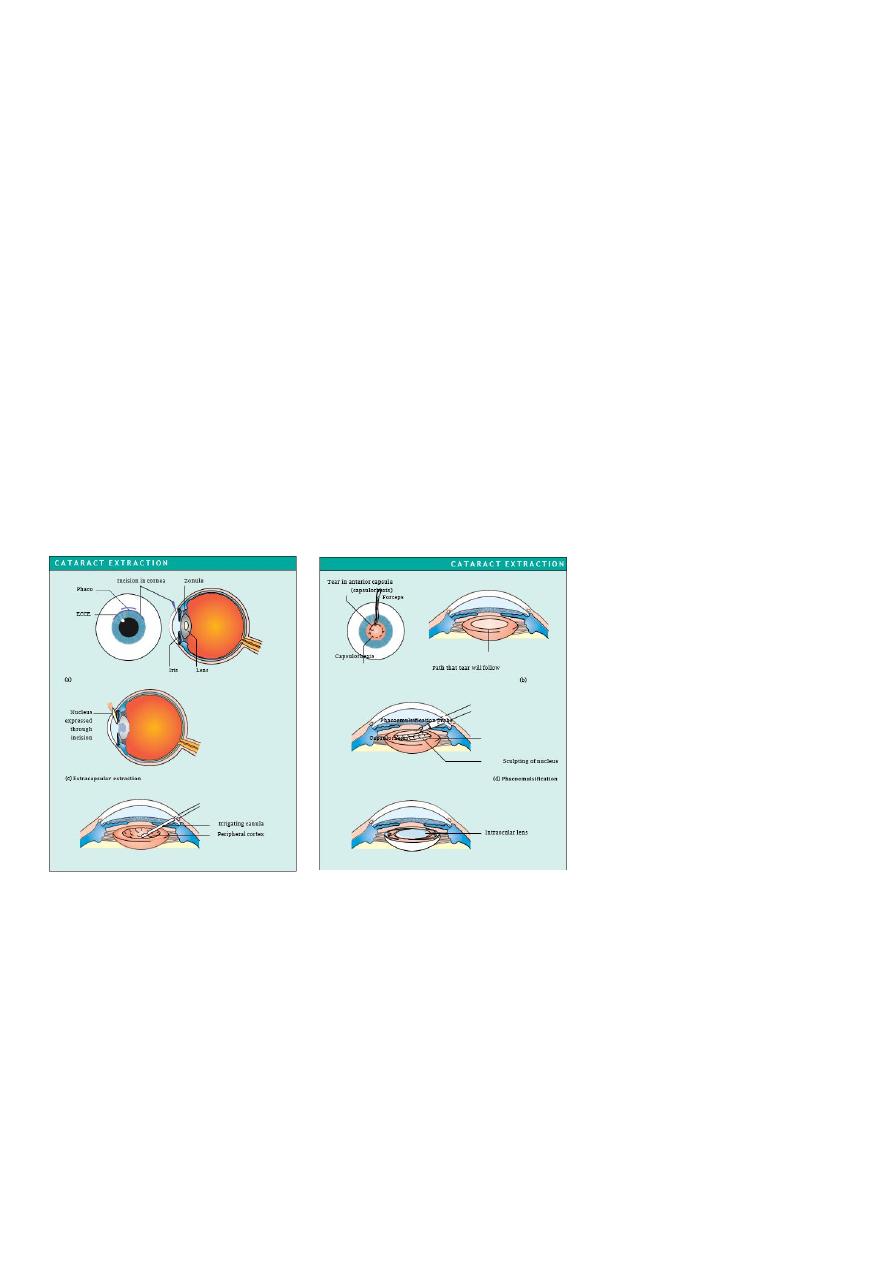
Cataract surgery
The operation involves removal of most of the lens and its replacement optically by a plastic
implant under local rather than general anaesthesia.
The operation can be performed:
• Through an extended incision at the periphery of the cornea or anterior sclera followed
by extra-capsular cataract extraction (ECCE). The incision must be sutured.
• By liquification of the lens using an ultrasound probe introduced through a smaller
incision in the cornea or anterior sclera (phacoemulsification). Usually no suture is
required. This is now the preferred method in the Western world.
The power of the intraocular lens implant to be used in the operation is calculated
beforehand by measuring the length of the eye ultrasonically and the curvature of the cornea
(and thus optical power) optically (this is called Biometry)
Visual rehabilitation and the prescription of new glasses is much quicker with
phacoemulsification. Since the patient cannot accommodate he or she will need glasses for
close work even if they are not needed for distance. Multifocal intraocular lenses are now in
use. Accommodating intraocular lenses are being developed.
3
Complications of cataract surgery
1. Vitreous loss.
2. Iris prolapse.
3. Endophthalmitis. A serious but rare infective complication of cataract extraction (less
than 0.3%). Patients present with:
A painful red eye;
Reduced visual acuity, usually within a few days of surgery;
A collection of white cells in the anterior chamber (hypopyon). The patient
requires urgent ophthalmic assessment, sampling of aqueous and vitreous for
microbiological analysis and treatment with intravitreal, topical and systemic
antibiotics.
4. Postoperative astigmatism.
5. Cystoid macular oedema.
6. Retinal detachment.
7. Opacification of the posterior capsule.
8. If the fine nylon sutures are not removed after surgery they may break in the following
months or years causing irritation or infection. Symptoms are cured by removal.
Fig. 8.3 Stages in the removal of a
cataract and the placement of an
intraocular lens. (a) An incision is
made in the cornea or anterior
sclera. A small, stepped self-sealing
incision
is
made
for
phacoemulsification.
(b)
The
anterior capsule of the lens is
removed. A variety of different
methods are used to do this. In ECCE
a ring of small incisions is made
with a needle to perforate the
capsule allowing the centre portion to be removed. In phacoemulsification the capsule is torn in a circle
leaving a strong smooth edge to the remaining anterior capsule. A canula is then placed under the anterior
capsule and fluid injected to separate the lens nucleus from the cortex allowing the nucleus to be rotated
within the capsular bag. (c) In ECCE the hard nucleus of the lens is removed through the incision, by
expression. Pressure on the eye causes the nucleus to pass out through the incision. (d) Alternatively the
nucleus can be emulsified in situ. The phacoemulsification probe, introduced through the small corneal or
scleral incision shaves away the nucleus. (e) The remaining soft lens matter is aspirated leaving only the
posterior capsule and the peripheral part of the anterior capsule. (f ) An intraocular lens is implanted into the
remains of the capsule. To allow implantation through the small phacoemulsification wound, the lens must
be folded in half or injected through a special introducer into the eye. The incision is repaired with fine nylon
sutures. If phacoemulsification has been used the incision in the eye is smaller and a suture is usually not
required.

4
Congenital cataract
The presence of congenital or infantile cataract is a threat to sight, not only because of the
immediate obstruction to vision but because disturbance of the retinal image impairs visual
maturation in the infant and leads to amblyopia (see pp. 170–171). If bilateral cataract is
present and has a significant effect on visual acuity this will cause amblyopia and an
oscillation of the eyes (nystagmus). Both cataractous lenses require urgent surgery and the
fitting of contact lenses to correct the aphakia. The management of contact lenses requires
considerable input and motivation from the parents of the child.
The treatment of uniocular congenital cataract remains controversial. Unfortunately the
results of surgery are disappointing and vision may improve little because amblyopia
develops despite adequate optical correction with a contact lens. Treatment to maximize the
chances of success must be performed within the first few weeks of life and be accompanied
by a coordinated patching routine to the fellow eye to stimulate visual maturation in the
amblyopic eye. Increasingly intraocular lenses are being implanted in children over 2 years
old. The eye becomes increasingly myopic as the child grows, however, making choice of the
power of the lens difficult.
CHANGE IN LENS SHAPE
Abnormal lens shape is very unusual. The curvature of the anterior part of the lens may be
increased centrally (anterior lenticonus) in Alport’s syndrome, a recessively inherited
condition of deafness and nephropathy. An abnormally small lens may be associated with
short stature and other skeletal abnormalities.
CHANGE IN LENS POSITION (ECTOPIA LENTIS)
Weakness of the zonule causes lens displacement. The lens takes up a more rounded form
and the eye becomes more myopic. This may be seen in:
Trauma.
Inborn errors of metabolism (e.g. homocystinuria, a recessive disorder with mental
defect and skeletal features. The lens is usually displaced downwards).
Certain syndromes (e.g. Marfan’s syndrome, a dominant disorder with skeletal and
cardiac abnormalities and a risk of dissecting aortic aneurysm. The lens is usually
displaced upwards). There is a defect in the zonular protein due to a mutation in the
fibrillin gene.
The irregular myopia can be corrected optically although sometimes an aphakic correction
may be required if the lens is substantially displaced from the visual axis. Surgical removal
may be indicated, particularly if the displaced lens has caused a secondary glaucoma but
surgery may result in further complications.

5
Uveitis
INTRODUCTION
Inflammation of the uveal tract (the iris, ciliary body and choroid) has many causes and is
termed uveitis (Fig. 9.1). It is usual for structures adjacent to the inflamed uveal tissue to
become involved in the inflammatory process. It may be classified anatomically:
• Inflammation of the iris, accompanied by increased vascular permeability, is termed
iritis or anterior uveitis (Fig. 9.2). White cells circulating in the aqueous humour of
the anterior chamber can be seen with a slit lamp. Protein which also leaks from the
blood vessels is picked out by its light scattering properties in the beam of the slit lamp
as a ‘flare’.
• An inflammation of the pars plana (posterior ciliary body) is termed
Cyclitis or intermediate uveitis.
• Inflammation of the posterior segment (posterior uveitis) results in inflammatory cells
in the vitreous gel. There may also be an associated choroidal or retinal inflammation
(choroiditis and retinitis respectively). A panuveitis is present when anterior and
posterior uveitis occur together.
HISTORY
The patient may complain of:
Ocular pain (less frequent with posterior uveitis or choroiditis);
Photophobia;
Blurring of vision;
Redness of the eye.
Posterior uveitis may not be painful.
The patient must be questioned about other relevant symptoms that may help determine
whether or not there is an associated systemic disease.
• Respiratory symptoms such as shortness of breath, cough, and the nature of any
sputum produced (associated sarcoidosis or tuberculosis).
• Skin problems. Erythema nodosum (painful raised red lesions on the arms and legs)
may be present in granulomatous diseases such as sarcoidosis and Behçet’s disease.
Patients with Behçet’s may also have thrombophlebitis, dermatographia and oral and
genital ulceration. Psoriasis (in association with arthritis) may be accompanied by
uveitis.

6
• Joint disease. Ankylosing spondylitis with backpain is associated with acute anterior
uveitis. In children juvenile chronic arthritis may be associated with uveitis. Reiter’s
disease (classically urethritis, conjunctivitis and a seronegative arthritis) may also be
associated with anterior uveitis.
• Bowel disease. Occasionally uveitis may be associated with inflammatory bowel
diseases such as ulcerative colitis, Crohn’s disease and Whipple’s disease.
Infectious disease. Syphilis with its protean manifestations can cause uveitis (particularly
posterior choroiditis). Herpetic disease (shingles) may also cause uveitis. Cytomegalovirus
(CMV) may cause a uveitis particularly in patients with AIDS. Fungal infections and
metastatic infections may also cause uveitis, usually in immunocompromised patients
SIGNS
On examination:
The visual acuity may be reduced.
The eye will be inflamed in acute anterior disease, mostly around the limbus (ciliary
injection).
Inflammatory cells may be visible clumped together on the endothelium of the cornea
particularly inferiorly (keratitic precipitates or KPs).
Slit lamp examination will reveal aqueous cells and flare. If the inflammation is severe
there may be sufficient white cells to collect as a mass inferiorly (hypopyon).
The vessels on the iris may be dilated.
The iris may adhere to the lens (posterior synechiae or PS).
The intraocular pressure may be elevated.
There may be cells in the vitreous.
There may be retinal or choroidal foci of inflammation.
Macular oedema may be present (see p. 121).
INVESTIGATIONS
These are aimed at determining a systemic association and are directed in part by the type
of uveitis present. An anterior uveitis is more likely to be associated with ankylosing
spondylitis and HLA-typing may help confirm the diagnosis. The presence of large KPs and
possibly nodules on the iris may suggest sarcoidosis; a chest radiograph, serum calcium and
serum angiotensin converting enzyme level would be appropriate. In toxoplasmic
retinochoroiditis the focus of inflammation often occurs at the margin of an old inflammatory
choroidal scar. A posterior uveitis may have an infectious or systemic inflammatory cause.
Some diseases such as CMV virus infections in HIV positive patients have a characteristic
appearance and with an appropriate history may require no further diagnostic tests.
Associated symptoms may also help point towards a systemic disease (e.g. fever, diarrhoea,
weight loss). Not all cases of anterior uveitis require investigation at first presentation unless
associated systemic symptoms are present.

7
TREATMENT
This is aimed at:
Relieving pain and inflammation in the eye;
Preventing damage to ocular structures; particularly to the macula and the optic nerve,
which may lead to permanent visual loss.
Steroid therapy is the mainstay of treatment. In anterior uveitis this is delivered by eye drops.
However, topical steroids do not effectively penetrate to the posterior segment. Posterior
uveitis is therefore treated with systemic steroids or steroids injected onto the orbital floor
or into the subtenon space.
In anterior uveitis, dilating the pupil relieves the pain from ciliary spasm and prevents the
formation of posterior synechiae by separating it from the anterior lens capsule. Synechiae
otherwise interfere with normal dilatation of the pupil. Dilation is achieved with mydriatics,
e.g. cyclopentolate or atropine drops. Atropine has a prolonged action. An attempt to break
any synechiae that have formed should be made with initial intensive cyclopentolate and
phenylephrine drops. A subconjunctival injection of mydriatics may help to break resistant
synechiae.
In posterior uveitis/retinitis visual loss may occur either from destructive processes caused
by the retinitis itself (e.g. in toxoplasma or CMV) or from fluid accumulation in the layers of
the macula (macular oedema). Apart from systemic or injected steroids, specific antiviral or
antibiotic medication may also be required. Some rare but severe forms of uveitis e.g. that
associated with Behçet’s disease may require treatment with other systemic
immunosuppresive drugs such as azathoprine or cyclosporin. Long-term treatment may be
necessary.

8
Fuchs’ heterochromic uveitis
This is a rare chronic uveitis usually found in young adults. The cause is uncertain and there
are no systemic associations.
HISTORY
The patient does not usually present with a typical history of iritis. Blurred vision and floaters
may be the initial complaint.
SIGNS
A mild anterior uveitis is present but without signs of conjunctival inflam- mation and there
are no posterior synechiae. There are KPs distributed diffusely over the cornea. The iris is
heterochromic due to loss of some of the pigment epithelial cells. The vitreous may be
inflamed and condensations (the cause of the floaters) may be present. About 70% of
patients develop cataract. Glaucoma occurs to a lesser extent.
TREATMENT
Steroids are not effective in controlling the inflammation and are thus not prescribed. The
patients usually respond well to cataract surgery when it is required. The glaucoma is treated
conventionally.
Toxoplasmosis
HISTORY
The infection may be congenital or acquired. Most ocular toxoplasmosis was thought to be
congenital with the resulting retinochoroiditis being reactivated in adult life. However, there
is now evidence that it is often acquired during a glandular fever-like illness. The patient may
complain of hazy vision, floaters, and the eye may be red and painful.
SIGNS
The retina is the principal structure involved with secondary inflammation occurring in the
choroid. An active lesion is often located at the posterior pole, appearing as a creamy focus
of inflammatory cells at the margin of an old chorioretinal scar (such scars are usually
atrophic, with a pigmented edge). Inflammatory cells cause a vitreous haze and the anterior
chamber may also show evidence of inflammation.
INVESTIGATION
The clinical appearance is usually diagnostic but a positive toxoplasma antibody test is
suggestive. However, a high percentage of the population have positive IgG titres due to prior
infection.

9
TREATMENT
The reactivated lesions will subside but treatment is required if the macula or optic nerve is
threatened or if the inflammatory response is very severe. Systemic steroids are
administered with an antiprotozoal drugs such as clindamycin. Care must be taken with the
use of sulphadiazines or clindamycin as pseudomembranous colitis may result from
clindamycin treatment. Patients must be warned that if diarrhoea develops they should seek
medical help immediately.
Acquired immunodeficiency syndrome (AIDS) and CMV retinitis
Ocular disease is a common manifestation of the acquired immunodeficiency syndrome.
Patients develop a variety of ocular conditions:
Microvascular occlusion causing retinal haemorrhages and cotton wool spots
(infarcted areas of the nerve fibre layer of the retina);
Corneal endothelial deposits;
Neoplasms of the eye and orbit;
Neuro-ophthalmic disorders including oculomotor palsies;
opportunistic infections of which the most common is CMV retinitis, (previously it was
seen in more than one-third of AIDS patients but the population at risk has decreased
significantly since the advent of highly active antiviral therapy (HAART) in the
treatment of AIDS). It typically occurs in patients with a CD4+ cell count of less than
50/ml). Toxoplasmosis, herpes simplex and herpes zoster are amongst other
infections that may be seen.
HISTORY
The patient may complain of blurred vision or floaters. A diagnosis of HIV disease has usually
already been made, often other AIDS defining features have occurred.
SIGNS
CMV retinopathy comprises a whitish area of retina, associated with haemorrhage, which
has been likened in appearance to ‘cottage cheese’. The lesions may threaten the macula or
the optic disc. There is usually an associated sparse inflammation of the vitreous.
TREATMENT
Chronic therapy with ganciclovir and/or foscarnet given parenterally are the current
mainstay of therapy; these drugs may also be given into the vitreous cavity. Cidofivir is
available for intravenous administration. Ganciclovir and its prodrug valganciclovir are
available orally. Systems of depot delivery into the vitreous are being actively researched for
local ocular CMV retinitis and a ganciclovir implant is available.
PROGNOSIS
Prolonged treatment is required to prevent recurrence.

11
SYMPATHETIC OPHTHALMITIS
A penetrating or surgical injury to one eye involving the retina may rarely excite a peculiar
form of uveitis which involves not only the injured eye but also the fellow eye. This is termed
sympathetic ophthalmitis (or ophthalmia).The uveitis may be so severe that in the worst
cases sight may be lost from both eyes. Fortunately systemic steroids, and particularly
cyclosporin, have greatly improved the chances of conserving vision. Sympathetic
ophthalmitis usually develops within 3 months of the injury or last ocular operation but may
occur at any time. The cause appears to be an immune response against retinal antigens at
the time of injury. It can be prevented by enucleation (removal) of the traumatized eye
shortly (within a week or so) after the injury if the prospects for visual potential in that eye
are very poor and there is major disorganization. Excision must precede the onset of signs in
the fellow eye.
SYMPTOMS
The patient may complain of pain and decreased vision in the Seeing Eye.
SIGNS
The iris appears swollen and yellow-white spots may be seen on the retina. There is a
panuveitis.
TREATMENT
High-dose systemic and topical steroids and also oral cyclosporin are required to reduce the
inflammation and try to prevent long term visual loss. It is vital to warn patients with ocular
trauma or multiple eye operations to attend an eye casualty department if they experience
any problems with their normal eye.
.

11
Glaucoma
INTRODUCTION
The glaucomas comprise a group of diseases in which damage to the optic nerve (optic
neuropathy) is usually caused by the effects of raised ocular pressure acting at the optic
nerve head. Independent ischaemia of the optic nerve head may also be important. Axon
loss results in visual field defects and a loss of visual acuity if the central visual field is
involved.
BASIC PHYSIOLOGY
The intraocular pressure level depends on the balance between production and removal of
aqueous humour. Aqueous is produced by secretion and ultrafiltration from the ciliary
processes into the posterior chamber. It then passes through the pupil into the anterior
chamber to leave the eye predominantly via the trabecular meshwork, Schlemm’s canal and
the episcleral veins (the conventional pathway). A small proportion of the aqueous (4%)
drains across the ciliary body into the supra-choroidal space and into the venous circulation
across the sclera (uveoscleral pathway).
Two theories have been advanced for the mechanism by which an elevated intraocular
pressure damages nerve fibres:
Raised intraocular pressure causes mechanical damage to the optic nerve axons.
Raised intraocular pressure causes ischaemia of the nerve axons by reducing
bloodflow at the optic nerve head.
Classification
of
the
primary
glaucomas (Fig. 10.2) is based on
whether or not the iris is:
Clear of the trabecular meshwork
(open angle);
Covering the meshwork (closed angle).

12
PATHOGENESIS
Primary open angle glaucoma
A special contact lens (gonioscopy lens) applied to the cornea allows a view of the
iridocorneal angle with the slit lamp. In open angle glaucoma the structure of the trabecular
meshwork appears normal but offers an increased resistance to the outflow of aqueous
which results in an elevated ocular pressure. The causes of outflow obstruction include:
Thickening of the trabecular lamellae which reduces pore size;
Reduction in the number of lining trabecular cells;
Increased extracellular material in the trabecular meshwork.
A form of glaucoma also exists in which glaucomatous field loss and cupping of the optic disc
occurs although the intraocular pressure is not raised (normal or low tension glaucoma).
It is thought that the optic nerve head in these patients is unusually susceptible to the
intraocular pressure and/or has intrinsically reduced blood flow (Fig. 10.3).
Conversely, intraocular pressure may be raised without evidence of visual damage or
pathological optic disc cupping (ocular hypertension). These subjects may represent the
extreme end of the normal range of intraocular pressure; however, a small proportion will
subsequently develop glaucoma.
Closed angle glaucoma
The condition occurs in small eyes (i.e. often hypermetropic) with shallow anterior
chambers. In the normal eye the point of contact between the pupil margin and the lens
offers a resistance to aqueous entry into the anterior chamber (relative pupil block). In angle
closure glaucoma, sometimes in response to pupil dilation, this resistance is increased and
the pressure gradient created bows the iris forward and closes the drainage angle. These
peripheral iris adhesions are called peripheral anterior synechiae (PAS). Aqueous can no
longer drain through the trabecular meshwork and ocular pressure rises, usually abruptly.
Secondary glaucoma
Intraocular pressure usually rises in secondary glaucoma due to blockage of the trabecular
meshwork. i.e (open angle) the trabecular meshwork may be blocked by:
1. Blood (hyphaema), following blunt trauma.
2. Inflammatory cells (uveitis).

13
Pigment from the iris (pigment dispersion syndrome).
• Deposition of material produced by the epithelium of the lens, iris and ciliary body in
the trabecular meshwork (pseudoexfoliative glaucoma).
• Drugs increasing the resistance of the meshwork (steroid-induced glaucoma).
Secondary glaucoma may also result from blunt trauma to the eye damaging the angle
(angle recession).
Angle closure may also account for some cases of secondary glaucoma:
• Abnormal iris blood vessels may obstruct the angle and cause the iris to adhere to the
peripheral cornea, closing the angle (rubeosis iridis). This may accompany proliferative
diabetic retinopathy or central retinal vein occlusion due to the forward diffusion of
vasoproliferative factors from the ischaemic retina (Fig. 10.4 and Chapter 12).
• A large choroidal melanoma may push the iris forward approximating it to the
peripheral cornea causing an acute attack of angle closure glaucoma.
• A cataract may swell, pushing the iris forward and closing the drainage angle.
• Uveitis may cause the iris to adhere to the trabecular meshwork.
Raised episcleral venous pressure is an unusual cause of glaucoma but may be seen in
caroticocavernous sinus fistula where a connection between the carotid artery or its
meningeal branches and the cavernous sinus, causes a marked elevation in orbital venous
pressure. It is also thought to be the cause of the raised intraocular pressure in patients
with the Sturge–Weber syndrome.
The cause of congenital glaucoma remains uncertain. The iridocorneal angle may be
developmentally abnormal, and covered with a membrane.
Chronic open angle glaucoma
EPIDEMIOLOGY
Chronic open angle glaucoma affects 1 in 200 of the population over the age of 40, affecting
males and females equally. The prevalence increases with age to nearly 10% in the over 80
population. There may be a family history, although the exact mode of inheritance is not
clear.
GENETICS
First degree relatives of patients with chronic open angle glaucoma have up to a 16% chance
of developing the disease themselves

14
HISTORY
The symptoms of glaucoma depend on the rate at which intraocular pressure rises. Chronic
open angle glaucoma is associated with a slow rise in pressure and is symptomless unless the
patient becomes aware of a severe visual deficit. Many patients are diagnosed when the signs
of glaucoma are detected by their optometrist.
EXAMINATION
Assessment of a glaucoma suspect requires a full slit lamp examination:
• To measure ocular pressure with a tonometer. The normal pressure is 15.5 mmHg.
The limits are defined as 2 standard deviations above and below the mean (11–21
mmHg). In chronic open angle glaucoma the pressure is typically in the 22–40 mmHg
range. In angle closure glaucoma it rises above 60 mmHg.
• To examine the iridocorneal angle with the gonioscopy lens to confirm that an open
angle is present.
• To exclude other ocular disease that may give rise to a secondary cause for the
glaucoma.
• To examine the optic disc and determine whether it is pathologically cupped. Cupping
is a normal feature of the optic disc (Fig. 10.5(a)). The disc is assessed by estimating
the vertical ratio of the cup to the disc as a whole (the cup to disc ratio). In the normal
eye the cup disc ratio is usually no greater than 0.4. There is, however, a considerable
range (0– 0.8) and the size of the cup is related to the size of the disc. In chronic
glaucoma, axons entering the optic nerve head die. The central cup expands and the
rim of nerve fibres (neuroretinal rim) becomes thinner. The nerve head becomes
atrophic. The cup to disc ratio in the vertical is greater than 0.4 and the cup deepens.
If the cup is deep but the cup to disc ratio is lower than 0.4, then chronic glaucoma is
unlikely unless the disc is very small. Notching of the rim implying focal axon loss may
also be a sign of glaucomatous damage.
• Scanning the disc with a confocal ophthalmoscope to produce an image of the disc.
The neuroretinal rim area can be calculated from the image (Fig. 10.6). Other
techniques record the thickness of the nerve fiber layer around the optic disc.
• Field testing (perimetry, see pp. 21–23) is used to establish the presence of islands of
field loss (scotomata) and to follow patients to determine whether visual damage is
progressive (Fig. 10.7). A proportion of nerve fibres may, however, be damaged before
field loss becomes apparent

15
Fig. 10.7 The characteristic pattern of visual field
loss in chronic open angle glaucoma: (a) an upper
arcuate scotoma, reflecting damage to a cohort
of nerve fibres entering the lower pole of the disc
(remember— the optics of the eye determine that
damage to the lower retina creates an upper field
defect);
(b) The field loss has progressed, a small central
island is left (tunnel vision), and sometimes this
may be associated with a sparing of an island of
vision in the temporal field.
Symptoms and signs of chronic open angle glaucoma.
• Symptomless
• Raised intraocular pressure
• Visual field defect
• Cupped optic disc
TREATMENT
Treatment is aimed at reducing intraocular pressure. The level to which the pressure must
be lowered varies from patient to patient, and is that which minimizes further glaucomatous
visual loss. This requires careful monitoring in the outpatient clinic. Three modalities of
treatment are available:
1 Medical treatment;
2 Laser treatment;
3 Surgical treatment.
MEDICAL TREATMENT
Topical drugs commonly used in the treatment of glaucoma are listed in Table 10.1. In chronic
open angle (although some of the newer drugs are challenging this, offering more
convenient dosing and fewer side effects, e.g. the prostaglandin analogue glaucoma topical
adrenergic beta- blockers are the usual first line treatment es). They act by reducing
aqueous production. Beta-selective beta-blockers, which may have fewer systemic side
effects, are available but must still be used with caution in those with respiratory disease,
particularly asthma, which may be exacerbated even by the small amount of beta-blocker
absorbed systemically. If intraocular pressure remains elevated the choice lies between:
• adding additional medical treatment;
• laser treatment;
• Surgical drainage procedures.
LASER TRABECULOPLASTY
16
SURGICAL TREATMENT
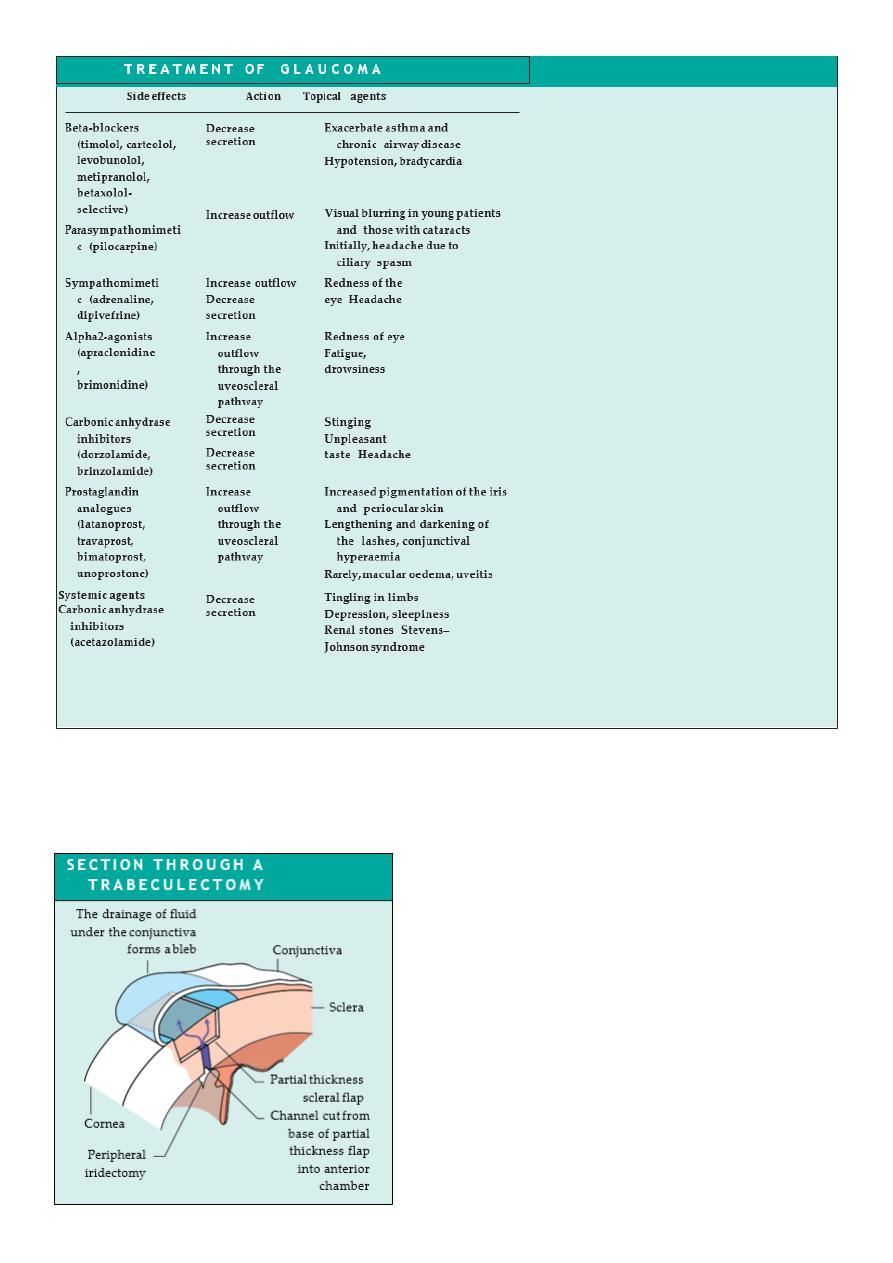
Drainage surgery (trabeculectomy) relies on the creation of a fistula between the anterior
chamber and the subconjunctival space (Fig. 10.8
Diagram showing a section through a trabeculectomy. An
incision is made in the conjunctiva, which is dissected and
reflected to expose bare sclera. A partial thickness scleral
flap is then fashioned. Just anterior to the scleral spur a
small opening (termed a sclerostomy) is made into the
anterior chamber to create a low resistance channel for
aqueous. The iris is excised in the region of the sclerostomy
(iridectomy) to prevent it moving forward and blocking the
opening. The partial thickness flap is loosely sutured back
into place. The conjunctiva is tightly sutured. Aqueous can
now leak through the sclerostomy, around and through the
scleral flap and underneath the conjunctiva where it forms
a bleb.

17
Complications of surgery include:
• Shallowing of the anterior chamber in the immediate postoperative period risking
damage to the lens and cornea;
• Intraocular infection;
• Possibly accelerated cataract development;
• Failure to reduce intraocular pressure adequately.
In patients particularly prone to scarring, antimetabolite drugs (5-flurouracil and mitomycin)
may be used at the time of surgery to prevent fibrosis.
Recent research has examined the benefit of modifying the trabeculectomy operation by
removing the sclera under the scleral flap but not making a fistula into the anterior chamber
(deep sclerostomy, visco- canalostomy). The long term benefit of the procedure is being
assessed.
NORMAL TENSION GLAUCOMA
Normal tension glaucoma, considered to lie at one end of the spectrum of chronic open angle
glaucoma, can be particularly difficult to treat. Some patients appear to have non-progressive
visual field defects and require no treatment. In those with progressive field loss lowering
intraocular pressure may be beneficial.
Primary angle closure glaucoma
EPIDEMIOLOGY
Primary angle closure glaucoma affects 1 in 1000 subjects over 40 years old, with females
more commonly affected than males. Patients with angle closure glaucoma are likely to be
long-sighted because the long-sighted eye is small and the anterior chamber structures more
crowded.
HISTORY
There is an abrupt increase in pressure and the eye becomes very painful and photophobic.
There is watering of the eye and loss of vision. The patient may be systemically unwell with
nausea and abdominal pain, symptoms which may take them to a general casualty
department.
Intermittent primary angle closure glaucoma occurs when an acute attack spontaneously
resolves. The patient may complain of pain, blurring of vision and seeing haloes around
lights.

18
EXAMINATION
On examination visual acuity is reduced, the eye red, the cornea cloudy and the pupil oval,
fixed and dilated.
TREATMENT
The acute and dramatic rise in pressure seen in angle closure glaucoma must be urgently
countered to prevent permanent damage to the vision. Acetazolamide is administered
intravenously and subsequently orally together with topical pilocarpine and beta-blockers.
Pilocarpine constricts the pupil and draws the peripheral iris out of the angle; the
acetazolamide and beta-blocker reduce aqueous secretion and the pressure across the iris.
These measures usually break the attack and lower intraocular pressure. Subsequent
management requires that a small hole (iridotomy or iridectomy) is made in the peripheral
iris to prevent subsequent attacks. This provides an alternative pathway to the pupil for fluid
to flow from the posterior to the anterior chamber reducing the pressure gradient across the
iris. This can be done with a YAG laser or surgically. If the pressure has been raised for some
days the iris becomes adherent to the peripheral cornea (peripheral anterior synechiae or
PAS). The iridocorneal angle is damaged and additional medical or surgical measures may be
required to lower the ocular pressure.
Secondary glaucoma
Secondary glaucomas are much rarer than the primary glaucomas. The symptoms and signs
depend on the rate at which intraocular pressure rises; most are again symptomless.
Treatment broadly follows the lines of the primary disease. In secondary glaucoma it is
important to treat any underlying cause, e.g. uveitis, which may be responsible for the
glaucoma.
In particularly difficult cases it may be necessary to selectively ablate the ciliary processes in
order to reduce aqueous production. This is done by application of a laser or cryoprobe to
the sclera overlying the processes
Congenital glaucoma
It may present at birth or within the first year. Symptoms and signs include:
• Excessive tearing;
• An increased corneal diameter (buphthalmos);
• A cloudy cornea due to epithelial oedema;
• Splits in Descemet’s membrane.

19
Congenital glaucoma is usually treated surgically. An incision is made into the trabecular
meshwork (goniotomy) to increase aqueous drainage or a direct passage between
Schlemm’s canal and the anterior chamber is created (trabeculotom
(
.
• Glaucoma is an optic neuropathy caused by an elevation of intraocular pressure.Y
POINTS
• Primary glaucoma is classified according to whether the trabecular meshwork is
obstructed by the peripheral iris (angle closure) or not (open angle glaucoma).
• Treatment of glaucoma relies on lowering ocular pressure to reduce or prevent
further visual damage.
• Ocular pressure can be reduced with topical and systemic medications, laser
treatment and surgery.
• Beware patients who are acutely debilitated with a red eye; they may have acute
angle closure glaucoma.
• If the diagnosis is made late arresting the glaucoma completely may still result in
visual loss during the patient’s lifetime. This emphasizes the need for early diagnosis
